伪狂犬病病毒核酸检测能力验证样品制备及其应用
2015-04-18乔彩霞高志强张利峰张鹤晓
乔彩霞,尹 羿,蒲 静,高志强,汪 琳,任 彤,张 伟,张利峰,张鹤晓
伪狂犬病病毒核酸检测能力验证样品制备及其应用
乔彩霞,尹 羿,蒲 静,高志强,汪 琳,任 彤,张 伟,张利峰,张鹤晓
(北京出入境检验检疫局,北京朝阳100026)
能力验证样品的制备是实验室病原核酸检测能力验证的难点和核心内容,本研究以伪狂犬病病毒南阳株细胞培养物为材料,通过高温处理的方式灭活病毒,研制了伪狂犬病病毒核酸检测的能力验证样品,经均匀性和稳定性检验证实样品达到中国合格评定国家认可委员会对能力验证样品的要求。利用能力验证样品,设计和实施了“BIQTC-2013-01《猪伪狂犬病病毒核酸检测》能力验证计划”,共有7家实验室参试,验证满意率达100%。伪狂犬病病毒核酸检测能力验证样品的研制和在能力验证计划中的应用,为评估我国各级实验室伪狂犬病病毒核酸检测的能力提供了较有价值的借鉴和参考。
伪狂犬病病毒;核酸检测;能力验证
伪狂犬病病毒(Pseudorabies Virus,PrV)属于疱疹病毒科(Herpesviridae)α-疱疹病毒亚科水痘病毒属的猪疱疹病毒I型,能引起猪、牛、羊、犬等多种家畜和野生动物发病,其中对养猪业危害最大。猪感染后主要表现为母猪的繁殖障碍和仔猪的高病死率,病死猪是PRV的贮存宿主和传染源。伪狂犬病呈全球性分布,通过实施根除计划,美国、荷兰等国家已经扑灭了该病。但在我国和世界许多国家,本病仍频繁发生,不仅给养猪业造成了巨大的经济损失,而且直接影响生猪及其产品的国际贸易,成为制约养猪业发展的重要因素[1-2]。
核酸检测技术因具有快速、灵敏、特异性强等优点,在伪狂犬病病毒的病原学检测和临床诊断中得到了广泛的应用。国内外学者研制了多种伪狂犬病病毒核酸检测技术,其中应用最多的是普通PCR和荧光PCR技术[3-4]。这些检测技术的商品化试剂盒也呈现出复杂多样的趋势,加之我国各级兽医实验室条件、技术水平差异较大,对伪狂犬病毒核酸检测等能力差异较大。同时,对于病病毒的核酸扩增检测技术,包括了样品制备、核酸提取、PCR和结果分析等众多环节,每一环节的不当均会直接影响到检测结果的准确性和可靠性。正确、可靠的核酸检测结果有赖于使用统一的质控样品对检测方法和试剂进行严格的质量控制。因此一种理想的病毒核酸质控样品也是试剂溯源、测量程序评价和不同实验室间检测结果比较的基本条件。
为了合理评估各级实验室伪狂犬病病毒核酸检测的技术水平和能力,我们在研制伪狂犬病病毒核酸检测能力验证样品的基础上,设计和实施了“BIQTC-2013-01《猪伪狂犬病病毒核酸检测》能力验证计划”,为今后伪狂犬病核酸检测能力的评估验证提供了有价值的参考和借鉴。
1 材料与方法
1.1 毒株和细胞伪狂犬病病毒南阳株(Namy⁃angjuGQ325658.1)和PK15细胞由本实验室保存。1.2主要试剂MEM细胞培养、胎牛血清,购自Gibco公司;DNAZol、Taq DNA酶、dNTP等PCR扩增试剂,购自Promega公司。
1.3 主要检测方法及引物、探针应用的检测方法有伪狂犬病病毒荧光PCR,由本实验室建立[4],普通PCR,参照国家标准《伪狂犬病诊断方法》(GB/T 18641-2002)操作。引物、探针详细序列信息见表1。

表1 能力验证样品制备所用检测方法及引物和探针
1.4 能力验证样品的制备
1.4.1 阳性质控样品将已长成单层的PK15细胞弃去生长液,按1%(V/V)接种PRV南阳株毒种,37℃吸附1 h,加入含2%牛血清的MEM细胞培养液,置37℃下培养观察3~5 d,当75%~95%细胞出现病变时收获,置-70℃下冻融3次,1 000 r/min离心10min,取上清液置于56℃水浴箱加热灭活30 min,-70℃保存备用。病毒培养液的灭活检验,选用PK15细胞,接种上述样品,观察3~5 d,应无细胞病变出现。样品的稀释,用PBS(0.01mol/L,pH值7.2)将PRV病毒培养液做10倍系列稀释,采用荧光PCR和普通PCR分别检测,选取荧光PCR的Ct值在18~22之间,普通PCR出现特异性扩增条带的稀释倍数,作为最终稀释倍数,将培养液充分稀释混匀后,每管分装500μL,作为PRV核酸检测能力验证的阳性样品。1.4.2阴性质控样品不含PRV的PBS(0.01mol/ L,pH值7.2)溶液,每管分装500μL,作为PRV核酸检测能力验证的阴性样品。
1.5 能力验证样品的分析
1.5.1 均匀性检验为保证验证样品的均匀分布,随机从-20℃保存的能力验证样品中各抽取10支,编号后提取DNA,采用伪狂犬病病毒荧光PCR方法进行检测,该检测为一次操作,一次上机完成。对检测获得的Ct值,采用单因子方差分析进行统计,分析其变异系数。
1.5.2 稳定性检验作为能力验证样品需通过快递方式向参试实验室发放样品,为了确保样品的稳定性,我们模拟了样品的实际运输保存条件,测试其稳定性。随机抽取制备好的能力验证阳性样品,在以下3种条件下各放置10支:室温(20℃~25℃),相对湿度20%~50%,14 d取出进行测试;冰箱冷藏(温度2℃~8℃),14 d取出进行测试;对照(-20℃),长期放置保存。应用PRV荧光PCR检测,对获得的Ct值采用两样本均数显著性检验-t检验进行统计,分析样品的稳定性。
1.6 能力验证的实施
1.6.1 组织形式本次能力验证为自愿参与,北京出入境检验检疫局技术中心作为CNAS认可的能力验证提供者,统一提供上述制备的PRV能力验证阳性和阴性样品,每个实验室随机发放6个样品(至少含1个阴性样品),不指定方法,也不提供试剂盒;参试实验室根据实际情况选择不同方法和检测试剂,以客观反映实验室伪狂犬病病毒核酸检测的真实状态,检测完毕结果报验证单位审核评价。
1.6.2 参试实验室及参试方法本次能力验证计划为自愿参加,共有分别来自上海、广东和吉林3个省的7家来自动物疫病预防控制机构和出入境检验检疫技术中心的实验室参加了能力验证。所有参试实验室均报送了有效结果。参试检测方法有2种:方法1,伪狂犬病病毒普通PCR检测技术;方法2,伪狂犬病病毒实时荧光PCR检测技术。
1.6.3 能力验证结果评价本次能力验证计划是对猪伪狂犬病病毒核酸检测的定性判定,以实施机构报送的测试结果为依据,对验证结果给予评价,如全部样品检测结果与样品背景相符判定为满意,如有不相符(假阴性或假阳性)的样品,则判为不满。荧光PCR的Ct值仅作为参考,不予评价。
2 结果
2.1 能力验证样品的制备将PRV南阳株接种PK15细胞,48 h后细胞出现明显细胞病变,细胞肿胀变圆,开始呈散在的灶状,并逐渐扩展,细胞不断圆缩脱落,同时有大量多核巨细胞形成。收取PRV细胞培养物经56℃水浴箱灭活30min后,再次接种PK15细胞未出现细胞病变,表明病毒已灭活完全,无生物传染性,可用于制备能力验证阳性样品。
将灭活的PRV培养液用PBS做10倍系列稀释,采用荧光PCR和普通PCR检测,结果荧光PCR最低可检测108稀释的PRV病毒培养液,而普通PCR最低能检测到105稀释的PRV培养液。在保证样品经荧光PCR和普通PCR检测均为阳性的条件下,我们将PRV细胞培养液做105倍稀释,混匀后分装作为能力验证阳性样品。见图1、2。

图1 荧光PCR对10倍梯度稀释PRV病毒培养液进行检测
2.2 均匀性检测随机抽取制备好的能力验证阳性和阴性样品各10管,提取DNA,用伪狂犬病病毒荧光PCR进行检测,对获得的Ct值进行统计学分析,结果阳性样品各管间变异系数为1.70%(见表2),小于5%,表明样品间差异不显著,样品均匀性良好。阴性样品经检测无特异性扩增曲线,均为阴性。
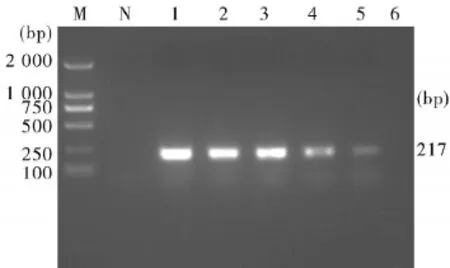
图2 普通PCR对10倍梯度稀释PRV细胞培养物进行检测M:DL-2 000DNAMarker;N:Negtive control;1~6:101~106diluted PRV
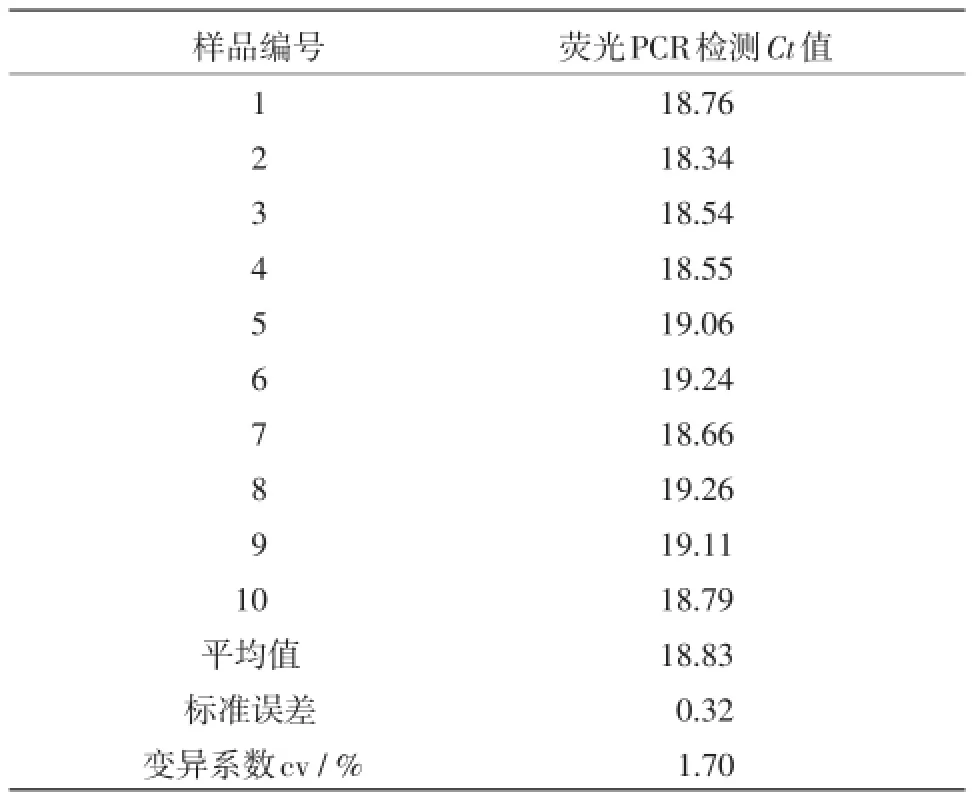
表2 能力验证阳性样品均匀性检验
2.3 稳定性检测将制备的能力验证阳性样品分别在室温、2℃~8℃和-20℃(对照)保存一定时间,之后提取DNA进行荧光PCR检测。检测组与对照组(-20℃)数据作t检验分析,结果检测组与对照组差异均无统计学意义(P>0.5),表明样品20℃~25℃和2℃~8℃保存14 d,稳定性很好,可以满足能力验证样品传递的要求,见表3。

表3 能力验证样品在不同保存条件下的稳定性研究
2.4 能力验证结果本次能力验证共有7家实验室参试,其中有2家实验室选择了普通PCR检测方法,5家实验室选择了实时荧光PCR检测方法。7家实验室的检测结果均与预期结果一致,结果满意,见表4。

表4 能力验证结果评价汇总
3 讨论
实验室能力验证是实验室管理部门、实验室用户和认可机构判定实验室检测能力的重要手段,也是实验室质量控制的必要组成部分。北京出入境检验检疫局是CNAS认可的能力验证计划提供者(CNASPT0012),根据实际需要,我们组织实施了此次《猪伪狂犬病病毒核酸检测》能力验证计划。
普通PCR和荧光PCR技术是应用于伪狂犬病病毒核酸检测的主要方法,也是本次能力验证考核的技术指标。我们利用灭活的伪狂犬病病毒细胞培养物制备了能力验证阳性样品,并对灭活效果进行了评价,经检测病毒完全灭活,确保了能力验证实施过程的生物安全。此外,在能力验证样品的制备上,我们兼顾两种不同方法的敏感性,选择了合适浓度的病毒作为阳性样品。均匀性和稳定性试验表明,制备的能力验证样品,达到了中国合格评定委员会对能力验证样品的要求[5]。
本次能力验证计划为自愿参加,共有7家实验室参试,均获得了满意的结果,预示我国现有的动物防疫机构和出入境检验检疫技术中心均具备开展伪狂犬病疫情监测和诊断的能力。鉴于荧光PCR方法比与普通PCR方法更加简便、快速和灵敏,参试实验室中有5家选择了荧光PCR方法,仅有2家选择了普通PCR方法,这也表明随着实验室条件的改进,自动化、高灵敏的荧光PCR成为PRV核酸检测技术的首选。但鉴于当前用于伪狂犬病病毒检测的普通PCR方法已经有相应的国家标准,但荧光PCR方法还缺泛相应的标准,建议及时制定相应标准以指导该方法在临床检测中的标准化和规范化使用。
[1]甘孟侯,杨汉春.中国猪病学[M].北京:中国农业出版社,2005:117-182.
[2]邓仕伟,汪勇,薛春芳.我国伪狂犬病流行现状及新特点[J].动物医学进展,2006,27(9):105-107.
[3]OIE.TerrestrialManualChapter 2.1.2-Aujeszky′s disease[EB/OL]2.0http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/ 2012,2.01.02_AUJESZKYS_DIS.pdf.
[4]朱淑芬,朱瑞良,乔彩霞,等.检测伪狂犬病毒gB基因荧光定量PCR方法的建立[J].中国兽医学报,2012,32(10):1413-1417.
[5]中国合格评定国家认可委员会.能力验证样品均匀性和稳定性评价指南[EB/OL].http://www.cnas.org.cn/fwzl/nlyzzl/nlyzxgzcyzl/ images/2012/11/30/4531B182D5936810C8AD6519B4F6897E.pdf CNAS—GL03:1-7,2006-6.
Development and application evaluation of sam ples for proficiency testing for Pseudorabies Virus nucleic acid detection
QIAOCai-xia,YIN Yi,PU Jing,GAO Zhi-qiang,WANG Lin,REN Tong,ZHANGWei,ZHANG Li-feng,ZHANG He-xiao
(Beijing Enrty-exit Inspection and Quarantine Bureau,Beijing 100026,China)
Appraisal sample preparation was the focal point and core of the Proficiency Testing(PT)program for pathogen nu⁃cleic acid assay.In this study,we used cell cultures of pseudorabies virus Nanyang strain as originalmaterials,and prepared the test samples of nucleic acid assay for pseudorabies virus by dry heat inactivated viruses.Based on the results of uniformityand sta⁃bility test,the samplesmet the needs of China national accreditation service for conformity assessment,and could be used for Profi⁃ciency Testing(PT)program of nucleic acid assay of pseudorabies(BIQTC-2013-01).A total of seven labs participated in the PT program and feedback the results,and the satisfactory ratewas 100%.In summary,we developed test samples and used them in the appraisal program of nucleic acid assay for pseudorabies virus,which lays the foundations for the certification and accreditation of laboratory testingmethods.
pseudrabiesvirus;nucleic acid test;proficiency testing
ZHENGHe-xiao
S852.659
A
0529-6005(2015)12-0006-04
2015-06-11
质检公益性行业科研专项《动物疫病核酸标准物质制备关键技术研究》(201310253)
乔彩霞(1978-),女,高级兽医师,博士,主要从事动物疫病检测技术研究,E-mail:qiaocx@bjciq.gov.cn
张鹤晓,E-mail:aqlzhx@126.com
