实时荧光定量RT-PCR检测猪传染性胃肠炎病毒方法的建立及应用
2015-04-18方振华
方振华,丁 利
(1.海南职业技术学院生物工程学院,海南海口570216;2.海南师范大学生命科学学院,海南海口571158)
实时荧光定量RT-PCR检测猪传染性胃肠炎病毒方法的建立及应用
方振华1,丁 利2
(1.海南职业技术学院生物工程学院,海南海口570216;2.海南师范大学生命科学学院,海南海口571158)
本研究将猪传染性胃肠炎病毒(TGEV)N基因部分片段克隆并连接到pGEM-T Easy载体上,得到重组质粒,以此为标准模板进行SYBR GreenⅠ荧光定量RT-PCR扩增并制作标准曲线,建立TGEV的荧光定量RT-PCR检测方法。该方法检测灵敏度可达10拷贝/μL,具有良好的特异性和重复性;对20份临床疑似病料进行检测,发现14份为荧光定量RT-PCR阳性,而常规RT-PCR只能检测出10份。结果表明,建立的实时荧光定量RT-PCR方法具有特异、敏感、快速、重复性好等优点,可用于临床TGEV感染的早期诊断以及分子流行病学调查。
猪传染性胃肠炎病毒;实时荧光定量RT-PCR;SYBRGreen I
猪传染性胃肠炎(Transmissible gastroenteritis of swine,TGE)是由猪传染性胃肠炎病毒(TGEV)引起的一种高度接触性传染病,以呕吐、严重腹泻、脱水以及致两周龄内仔猪高死亡率为主要临床特征,是我国法定重点防控的疫病之一。随着中国集约化养猪产业的程度愈来愈高,TGE的发生与流行有明显加重的趋势,且与其他病原混合感染和继发感染已成为当今猪群发病的普遍规律,导致临床诊断难度大大增加,因此研究特异灵敏的诊断方法对快速检测及防治TGE具有十分重要的意义。目前,常规检测TGEV的方法大部分操作繁琐,且灵敏度不高[1-2],而实时荧光定量PCR技术具有灵敏度高、特异性强、操作简便快捷等特点,且可以有效防止检测过程中的污染及假阳性,可大大提高检测效率[3]。本研究以TGEV N基因序列为靶基因,建立一种特异的实时定量PCR方法,用于TGEV的实时检测,该法快速、灵敏、准确,从而为TGEV的早期快速诊断提供理论依据。
1 材料与方法
1.1 毒株、菌株猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒三联苗,购自中国兽药监察所;猪传染性胃肠炎病毒、猪乙型脑炎病毒、猪伪狂犬病病毒、猪细小病毒、PK-15细胞、大肠杆菌DH5α均由本实验室保存;TGEV临床检测病料来自各地市自然感染猪。
1.2 主要试剂T载体、Taq DNA聚合酶、dNTP等均为Fermentas公司产品;DNA凝胶快速回收试剂盒、质粒提取试剂盒为Vigorous公司产品;反转录试剂盒,购自北京全式金生物科技有限公司;2× SYBRGreen-IMasterMix为宝生物工程(大连)有限公司产品,其他常规试剂均由本实验室提供。
1.3 引物设计与合成根据Gen Bank公布的TGEV N基因序列,设计N基因引物,由南京金斯瑞生物技术有限责任公司合成。序列为上游引物:5′-ACAAACACACCTGGAAGAGAACT-3′;下游引物:5′-GAATGCTAGACACAGATGGAACAC-3′,预计扩增片段165 bp。
1.4 质粒标准模板的制备病毒总RNA提取按TRIZol试剂说明书进行。反转后的cDNA用于目的基因片段的扩增,然后将目的片段与pGEM-T Easy载体连接,转化DH5α感受态细胞,并对重组质粒进行PCR鉴定,将鉴定正确的重组质粒进行测序验证。经验证阳性的重组质粒,测定质粒模板浓度,计算标准品的拷贝数,然后将其10倍倍比稀释作为实时荧光定量PCR阳性标准模板。
1.5 实时荧光定量PCR扩增用标准品作为模板,进行SYBRGreenⅠ荧光定量PCR扩增。分别对反应体系中的引物浓度、退火温度等条件进行优化,通过预试验对反应条件进行优化,最终确定最佳反应体系和反应条件。
1.6 实时荧光定量PCR标准曲线的制备以10倍梯度稀释的质粒为模板进行荧光定量PCR扩增,并利用Bio-Rad iQ5软件进行分析,得到扩增曲线、溶解曲线和标准曲线。
1.7 特异性、重复性和敏感性试验将猪轮状病毒、猪流行性腹泻病毒、猪乙型脑炎病毒、猪伪狂犬病病毒、猪细小病毒样品的cDNA或DNA,按照优化的条件进行荧光定量PCR,验证其特异性、重复性和敏感性。
1.8 临床样品的检测对各地市送检的20份临床病料进行处理,提取RNA,应用普通RT-PCR方法和荧光定量PCR方法检测。
2 结果
2.1 普通PCR结果与测序分析以TGEV N基因设计引物进行普通RT-PCR扩增,PCR产物经电泳鉴定,与预期结果一致。将目的片段回收、纯化、克隆到pGEM-TEasy载体(简称pGEM-T-N),质粒PCR产物测序结果进行BLAST比对,结果与TGEV相应区域100%同源。
2.2 实时荧光定量PCR条件的优化对TGEV SYBR GreenⅠ荧光定量PCR扩增条件进行优化,最终确定如下:反应总体系为25μL,2×SYBRGreen-IMaster Mix 12.5μL,上、下游引物各0.5μL(20μmo l/L),模板1μL,灭菌去离子水10.5μL。循环条件为:95℃预变性10min;95℃5 s,60℃30 s。40个循环数,在该条件下扩增曲线起跳早,荧光值较高,溶解曲线峰狭窄单一。
2.3 标准曲线的绘制将标准样品10倍倍比稀释,并分别以此为模板进行荧光定量PCR扩增。从图1可知,在溶解曲线上有单一的峰,说明本方法特异性高。经IQ5荧光定量PCR仪软件绘制质粒标准模板的标准曲线(图2),由结果可知斜率为R2=0.998,扩增效率为100.2%。说明在稀释的范围内线性关系良好。

图1 TGEV荧光定量RT-PCR溶解曲线
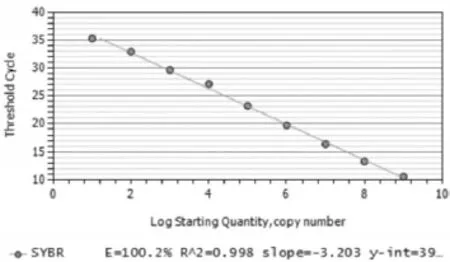
图2 TGEV荧光定量RT-PCR标准曲线
2.4 荧光定量PCR的特异性、重复性和敏感性试验将TGEV、猪流行性腹泻病毒、猪轮状病毒、猪乙型脑炎病毒、猪伪狂犬病病毒、猪细小病毒的模板进行荧光定量PCR检测,结果发现除TGEV能够扩增出S型曲线外,其他对照病毒均不能检测出S型曲线,表明所建立的方法具有较强的特异性(图3)。选取同一稀释倍数的重组质粒为模板,进行荧光定量PCR检测。由图4可知,同一浓度所得的Ct值基本相同,变异很小,表明此方法的重复性良好。将模板质粒稀释成浓度为101,102,103,104,105,106,107,108,109的标准品,并分别以此为模板进行荧光定量PCR扩增,由扩增曲线可知其灵敏度为10拷贝/μL(图5)。

图3 TGEV荧光定量RT-PCR特异性试验

图4 TGEV荧光定量RT-PCR重复性试验

图5 TGEV荧光定量RT-PCR敏感性试验
2.5 临床样品检测结果比较对20份临床病料应用所建立的荧光定量RT-PCR方法和普通RTPCR方法同时检测,设置阳性病料2份和阴性病料2份作为对照。结果显示,用常规RT-PCR检出10份TGEV阳性病料,而荧光定量PCR检出14份阳性病料,荧光定量PCR检测灵敏度高于常规RT-PCR。
3 讨论
实时荧光定量PCR是一种新型的核酸定量技术,由于其灵敏度高、重复性好、污染少等优点,被广泛应用于医学检测、基因表达研究、病原体检测、病毒荷载量测定等方面[6]。常用的PCR定量方法主要包括SYBRGreen I染料法、Taq Man探针法、分子信标法、杂交探针法等[4]。SYBR Green I荧光定量PCR方法只需在SYBR Green I反应混合液中加入引物和待测样品,其成本相对低廉。与Taq Man探针法相比,更加简便,无需合成价格昂贵的探针[5]。该技术应用于TGEV检测,能在病毒隐性感染和猪发病早期进行快速确诊和实时监测。部分学者利用TGEV基因序列设计合成引物和探针,建立了Taq Man荧光定量RT-PCR方法,其检测敏感性比常规RT-PCR方法提高了多倍[6-7]。张云、王建中等研究者针对TGEV的S基因等建立了SYBRGreen I荧光定量RT-PCR检测方法,敏感性高、特异性强、稳定性好[8-10]。本试验建立的TGEV荧光定量RT-PCR检测方法灵敏度可达10拷贝/μL,与猪轮状病毒、猪流行性腹泻病毒、猪乙型脑炎病病毒、猪伪狂犬病病毒、猪细小病毒不发生交叉反应,具有重复性好、特异性强、灵敏度高等优点。与普通RT-PCR相比,SYBRGreen IPCR的扩增和检测都在同一管内完成,不需要后续的电泳检测,有效解决了污染问题,而且操作更简便,检测时间更短,可作为规模化猪场TGEV的净化检测方法,同时也可用于临床TGEV感染的早期诊断以及分子流行病学调查。
[1]李小兰,聂福平,李应国,等.猪传染性胃肠炎病毒NASBA检测方法的建立[J].中国预防兽医学报,2010,32(6):451-454.
[2]Liu C,Kokuho T.A serodiagnostic ELISA using recombi-nant antigen of swine transmissible gastroenteritis virus nueleoprotein[J].JVet Med Sci,2001,63(11):1253-1256.
[3]阳成波,印遇龙,黄瑞林,等.实时定量RT-PCR的原理及方法[J].免疫学杂志,2003,19(3):145-150.
[4]陈旭,齐凤坤,康立功,等.实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010,41(8):148-155.
[5]刘歆,徐根明,郭江峰,等.基于SYBRGreenⅠ的双链DNA定量方法[J].中国生物工程杂志,2008,28(1):55-60.
[6]白兴华,冯力,陈建飞,等.猪传染性胃肠炎病毒Taq Man荧光定量RT-PCR检测方法的建立[J].畜牧兽医学报,2007,38(5):476-481.
[7]徐丽秋,苏永生,赵玉军,等.检测猪传染性胃肠炎病毒Taq⁃Man荧光定量RT—PCR方法的建立与初步应用[J].畜牧与兽医,2009,41(9):14-17.
[8]董玲娟,张彦明,何雷,等.猪传染性胃肠炎病毒荧光定量RT-PCR检测方法的建立[J].西北农林科技大学学报(自然科学版),2012,40(2):13-19.
[9]王建中.猪传染性胃肠炎病毒S基因实时荧光定量RT-PCR检测方法的建立及初步应用[J].中国畜牧兽医,2014,41(1):66-71.
[10]张云,王亚宾,陈丽颖,等.猪传染性胃肠炎病毒S基因的SYBR Green I荧光定量RT-PCR检测[J].湖南农业大学学报(自然科学版),2011,37(5):521-525.
Development of real-time RT-PCR for detecting transm issible gastroenteritisvirus and its prelim inary application
FANG Zhen-hua1,DING Li2
(1.School of Biological Engineering,Hainan College of Vocation and Technique,Haikou 570216,China;2.College of Life Sciences,Hainan Normal University,Haikou 571158,China)
Transmissible gastroenteritis virus(TGEV)N genewas cloned into pGEM-TEasy vector,which is used as the standard template for real-time RT-PCR.Then,the standard curvewasmade,and the real-time RT-PCRmethod was established for TGEV detection.The sensitivity of themethod could reach 10 copies/μLwith good specificity and repeatability.20 samples from sick pigswere tested,ofwhich 14 were positive by real-time RT-PCR detection,while only 10 were tested positive by conventional RT-PCR.These results showed that the real-time RT-PCRmethod was specific,sensitive,rapid and good repeatability.Thus,Thismethod established RT-PCR can be used for the early diagnosis of TGEV infection andmolecular epidemiological investigation.
transmissible gastroenteritis virus;real-time RT-PCR;SYBR GreenⅠ
DING Li
S852.65+1
A
0529-6005(2015)12-0020-03
2014-07-14
国家自然科学基金(31502036);海南省自然科学基金(314076;20153086)
方振华(1980-),男,讲师,硕士,从事动物饲养管理及疾病防治教学和科研工作,E-mail:okay1688@163.com
丁利,E-mail:dingli705@163.com
