黄芪多糖MP EG-P LA 嵌段共聚纳米微球制备及体外释放研究
2015-04-18杜雄伟刘三俠宋志元张要齐张新蕾孙雪峰
杜雄伟,储 君,刘三俠,宋志元,刘 建,张要齐,张新蕾,孙雪峰
(1.大连民族大学生命科学学院,大连116600;2.河南惠通天下生物工程有限公司,新郑451162;3.河南惠通天下动物药业有限公司,郑州450008)
现代研究表明,在中药研究中,应用纳米技术,可以使药物活性和生物利用度提高,甚至产生新的特性,改变中药剂型过于老化、单一的现状,实现中药现代化[1]。本项目拟选聚乳酸-聚乙二醇(PLA-PEG)嵌段共聚物作为包载材料[2],通过PLA-PEG纳米载体体系包被处理的黄芪多糖不仅具有很好的控释性、减少用药次数,而且还具有提高生物利用度,减少用药次数,而且还具有提高生物利用度,减少用药量,增强对机体作用部位的靶向性,提高疗效等优点[3]。
l 材料
1.1 仪器与设备 精密电子分析天平(上海精密科学仪器设备有限公司),紫外可见光分光光度计(上海美谱达仪器有限公司),真空冷冻干燥机(北京博医实验仪器有限公司),高速搅拌器(上海人迈仪器有限公司),磁力加热搅拌器(姜堰市新康医疗器械有限公司),高速离心机(安徽中科中佳科学仪器有限公司),激光粒度分析仪(济南微纳颗粒仪器股份有限公司),透射电镜(日本电子公司),数控超声波清洗器(昆山市超声仪器有限公司。)
1.2 药品与试剂 黄芪多糖、聚乳酸-聚乙二醇共聚物,二氯甲烷、聚乙烯醇、硫酸、苯酚、蒸馏水,以上均为分析纯。
2 方法与结果
2.1 纳米粒的制备 本实验采用复乳法[4]来制备黄芪多糖MPEG-PLA嵌段共聚纳米微球。将多糖溶液加入到MPEG-PLA二氯甲烷溶液的油相中,在高速搅拌下得到乳白色初乳液,将初乳液加入到聚乙烯醇(PVC) 水溶液中,高速搅拌2-5分钟,随后将复乳液放在磁力搅拌器上以50-200rpm的速度搅拌直至有机溶剂挥发完,最后,将所剩乳白液高速离心15min,弃上清,取沉淀,沉淀经三蒸水反复洗涤3次后,冷冻干燥后即得黄芪多糖MPEG-PLA嵌段共聚纳米微球。
2.2 检测方法的建立(硫酸-苯酚法[5])
2.2.1 试剂的配制 取苯酚100g,加铝片0.1g和碳酸氢钠0.05g,蒸馏,收集182℃馏分,称取此镏分5g,加95m l蒸馏水,置棕色瓶中,得浓度为5%的苯酚试液。
2.2.2 测定波长的选择 精密称取一定量纳米粒供试品溶于2ml二氯甲烷中,完全溶解后,加入5m l蒸馏水,将其在漩涡混合器上充分混合,然后静置1h,使水相与油相分离并收集水相。余下的油相按上述方法再处理一次,将两次分离收集的水相溶液混合在一起,经2000r/min离心5min后,取上清液2.0ml于具塞试管中,加5%的苯酚试液1m l,混匀,迅速加5m l浓硫酸,剧烈速冷却,以苯酚-硫酸溶液作空白,在200-800nm范围进行扫描,结果见图1,确定测定波长为491nm。
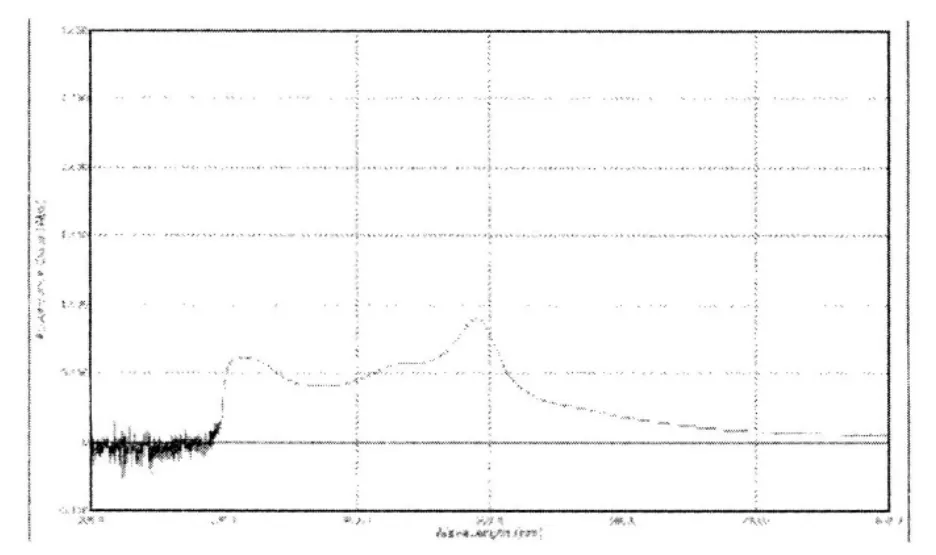
图1 波长扫描图
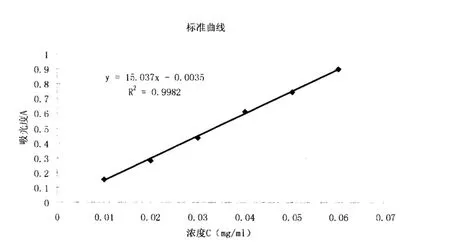
图2 标准曲线图
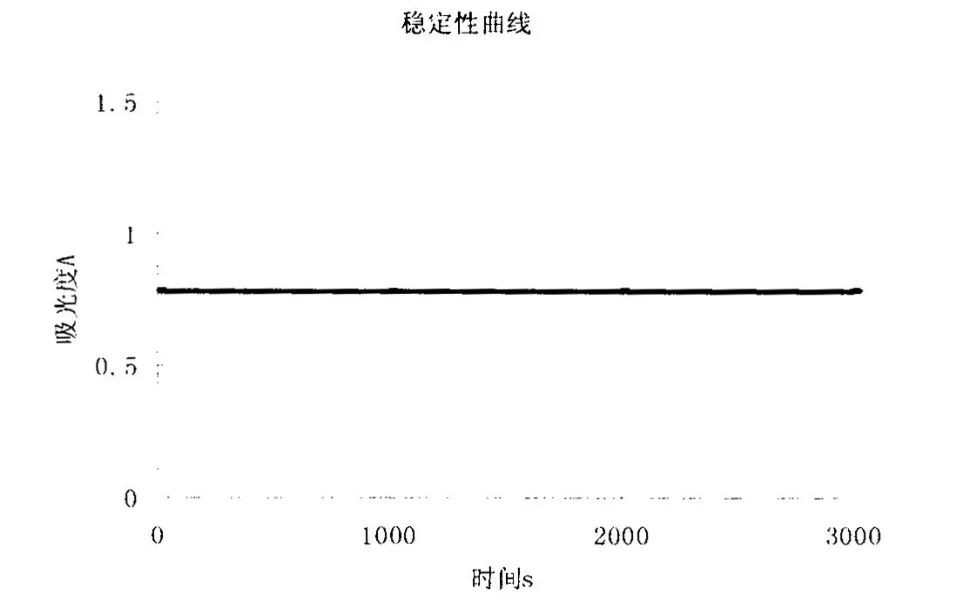
图3 稳定性曲线图
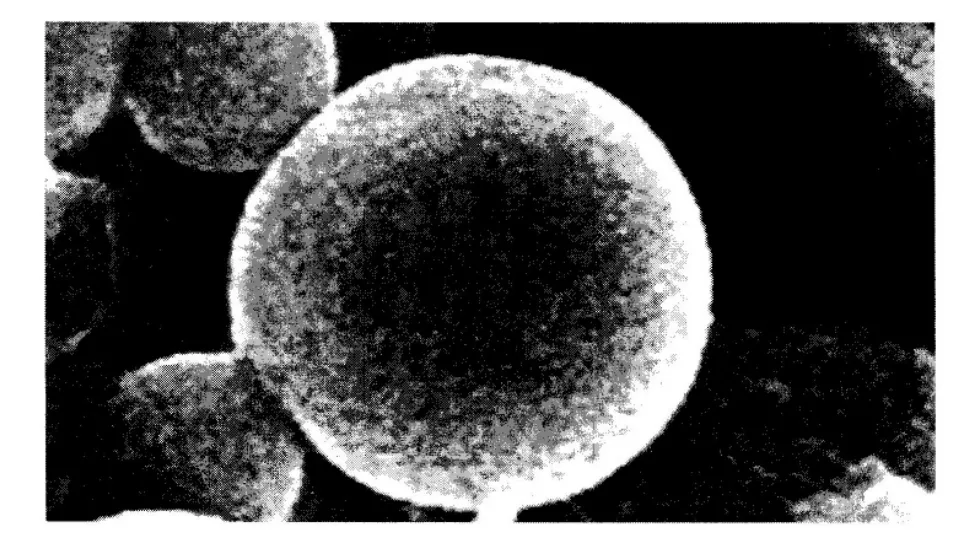
图4(a) 黄芪多糖MPEG-PLA 嵌段共聚纳米微球
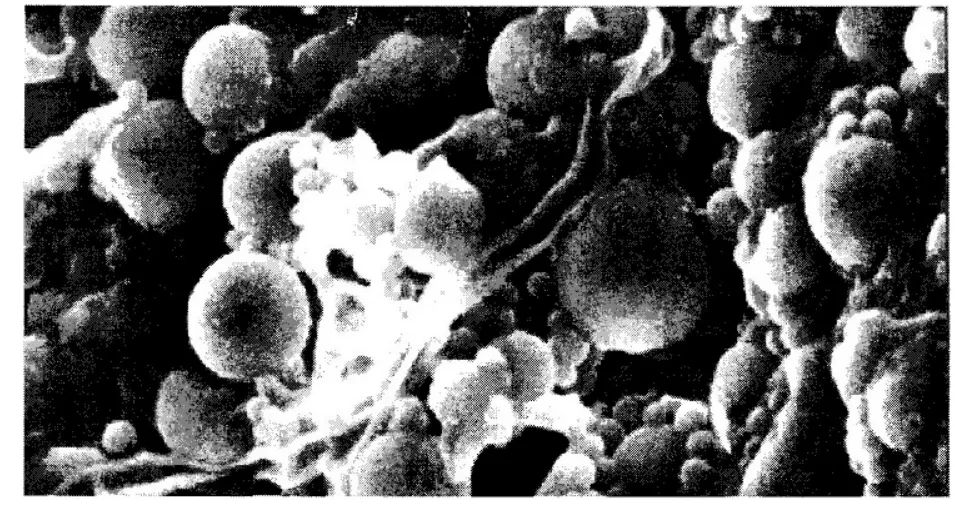
图4(b) 黄芪多糖MPEG-PLA 嵌段共聚纳米微球
2.2.3 标准曲线的绘制 精密称取在105℃下干燥至恒重的葡萄糖标准品100mg于干净小烧杯中,加水溶解并定量至l00mL的容量瓶中,加水稀释至容量刻度,混匀,即得Img/mL的葡萄糖标准品溶液。分别精密吸取该葡萄糖标准品溶液l.0mL.2.0mL、3.0mL.4.0mL、5.0mL.6.0mL置于l00mL容量瓶中,加蒸馏水稀释至刻度。分别吸取以上各种浓度的葡萄糖标准品稀释标准溶液2mL于具塞试管中,加5%的苯酚试液1mL,混匀,迅速加5mL浓硫酸,剧烈振摇2分钟,然后置沸水浴加热1 5分钟,取出至冷水中迅速冷却,备用。以苯酚.硫酸溶液作空白,于491nm处测定吸光度。以吸光度A为纵坐标,浓度C为横坐标进行线性回归。由图2可知,黄芪多糖MPEG-PLA嵌段共聚纳米微球回归方程为:y=15.03 7x--0.0035,r=0.9992(n=6),纳米粒在0.01-0.06mg/ML的浓度范罔内线性关系良好。
2.2.4 稳定性考察 取同一批次的黄芪多糖MPEG-PLA嵌段共聚纳米微粒,按2.2.2中波长选择中样品的处理方法操作,在波长491nm处进行稳定性测定,样品在1h内显色稳定,可用于比色测定,结果见图3。
2.3 微观形态及粒径检测 取少量纳米微球混悬液滴在洁净的盖玻片上,室温下自然干燥,在扫描电镜上进行观察,取少量纳米微球混悬液,以蒸馏水稀释100倍,用激光粒度仪测定纳米微球粒径及其粒度分散指数。黄芪多糖MPEG-PLA嵌段共聚纳米微球在扫描电镜下观察呈典型的球形,大小较均匀,表面光滑,分散性较好,无明显粘连及融合。动态光散射法测定其平均粒径为873nm,分散系数为0.753.结果见图4(a)、4(b)。
2.4 载药量(DL) 和包封率(ER) 的测定 精密称取质量为W的冻干微粒复溶之后,超速离心使纳米粒沉淀在底部,没有载上的药物游离在上清液中,测定上清液中的药物量,记为游离药物W f;另取W 冻干微粒复溶后超声破坏纳米粒,离心,测定上清液中的药物量,记为总的药量WT。黄芪多糖MPEG-PLA嵌段共聚纳米微球包封率和载药量计算公式:载药量=WT/W×100% 包封率=(Wt-Wf) /WT×100%
2.5 正交工艺设计 采用两步乳化法制备复乳,相关影响因素较多,主要包括制备PLA-PEG浓度,PVA浓度、多糖浓度、制备初乳时油相体积、内水相体积,油水两相体积比、搅拌速度、载药量等。现根据文献及单因素预实验结果[6],固定MPEG-PLA二氯甲烷溶液作为油相的体积为20m l、多糖浓度为0.05g/m l、PVA外水相体积为100ml、采用四因素三水平的正交设计,重点考察MPEG-PLA浓度(mg/ml)、PVA浓度、内水相体积、搅拌速度对黄芪多糖MPEG-PLA嵌段共聚纳米微粒的粒径、包封率和载药量的影响,以确定最佳制备工艺。正交试验设计各因素水平见表1,具体正交实验方案见表2.按照正交表制备纳米粒,测定样品的各个质量评价指标。
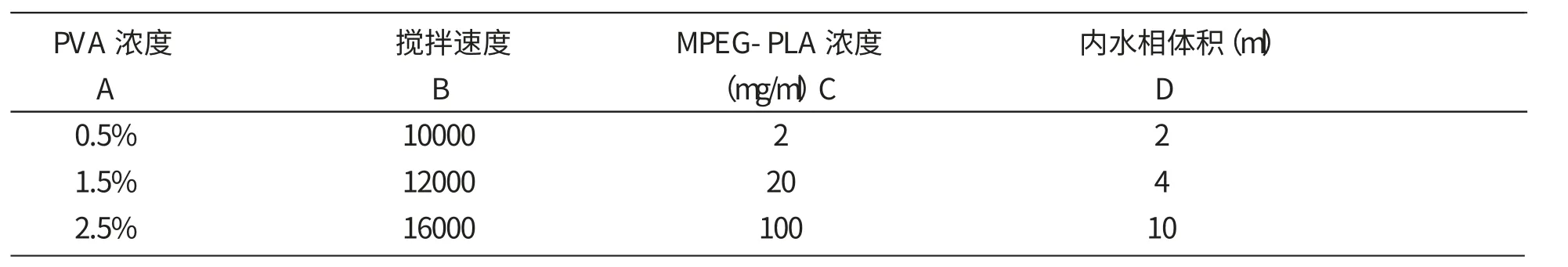
表1 因素水平表

表2 正交试验表

表3 不同工艺组微球载药量
2.6 正交试验结果 按照正交试验设计制备纳米微球,测定样品的各个质量评价指标,具体结果见表2。
从上表极差分析结果可以看出,PVA浓度和内水相体积对微球平均粒径影响较大;搅拌速度和内水相体积对微球的包封率影响较大。而对于纳米微球米说,粒径越小越好,包封率越大越好,故选择PVA浓度为0.5%,搅拌速度为16000rpm。内水相体积选择D3有利于包封率增人,选择D1有利于粒径减小。
2.7 微球的载药量 固定PVA浓度为0.5%(Al),搅拌速度为16000rpm(B3),选择A1B3C2D1、A1B3C2D3、AIB3C3D1利AIB3C3D3四个工艺制备微球,经硫酸-苯酚法测定各组微球的载药量,见表3。
根据正交试验结果可知内水相体积对包封率和粒径影响较大且刚好相反,从表3可知内水相体积为D3的工艺组载药量远远大于D1,故应选择内水相体积为10mL(D3)。
从表3可以看出,MPEG-PLA浓度选择C2或C3对载药量影响不大,考虑到MPEG-PLA的昂贵成本,故选择MPEG-PLA浓度为20mg/mL(C2)。综上所述,微球制备的最佳工艺条件是:
黄芪多糖溶液体积为10mL、浓度为0.05g/mL,MPEG-PLA嵌段共聚物浓度为20mg/mL,PVA浓度为0.5%,搅拌速度为16000rpm,其中MPEG-PLA二氯甲烷作为油相固定体积为20mL,PVA外水相体积为l00mL。
2.8 体外释放试验 参照优化的工艺参数条件,按2,1方法制各黄芪多糖MPEG-PLA嵌段共聚纳米微球。
称取微球样品加入装有50mL生理盐水的烧杯中,分别于4h、ld、2d、3d、4d、6d、1Od等,不同时间取样2mL于具塞试管中,加5%的苯酚试液ImL,混匀,迅速加5mL浓硫酸,剧烈振摇2分钟,然后置沸水浴加热15分钟,取出至冷水中迅速冷却,作为供试晶溶液,用紫外可见分光光度计测各组不同时间释放到介质中多糖的吸光度,另取同一批次的微球样品,用超声波破碎后,同法测定吸光度。计算出不同时间段的累计释放率。以时间d为横坐标,多糖累计释放率为纵坐标,作出载糖微球体外释放曲线,结果见图5。
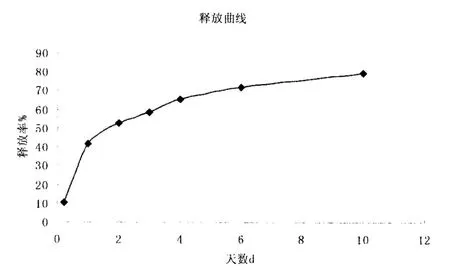
图5 释放曲线图
3 讨论
本试验采用复乳法制备微球,所得到的载药微球电镜扫描结果外形圆滑,颗粒大小均匀,平均粒径873nm,包封率为78%,释放率高达79.7%,释放时间较长为10天,且释放平缓,突释率较低。说明采用MPEG-PLA二氯甲烷溶液作为油相、黄芪多糖水溶液作为内水相,PVA水溶液作为外水相制备黄芪多糖MPEG-PLA嵌段共聚纳米微球的工艺稳定可行,可用丁实际生产中参考。
[1]苑娟,宪龄,万焱,等.纳米技术在中药研究中的应用与思考[J].价值工程,2011,34:302-303.
[2]魏芬芬.星型PLA-PEG嵌段共聚物的合成及其在药物负载中的应用[D].华南理工大学,材料学,2010,
[3] Rao JP,Geckeler EK.Polymernanopartcles:preparation techniquesan d size-controlparameters[J].Progress in polymer science,2011,36(7):887-913
[4]Zhang ZP.Lee HS.CheeW,etal,in vitro and in vivo investigation on pal-tpgsnanoparticles for controlled and sustained smallmolecule chemotherapy[J].Pharm Res,2008,25(8):1925-1935
[5]赵文,任永凤,樊建航,伊犁黄芪与蒙古黄芪成分的比较及多糖含量的测定[J].中草药,2001(2):122-124
[6]Feng SS,Zhao LY.Tang JT,Nanomedicine fororal chemotherapy[J].Int JNanomedicine,2011.6(3):407-410.
