刺五加注射液对大鼠肾缺血再灌注损伤的影响
2015-04-15靳书滨霍韶军张瑞刚
李 强,靳书滨,李 峰,霍韶军,张瑞刚
(邯郸市中心医院泌尿外科,河北 邯郸 056001)
刺五加注射液对大鼠肾缺血再灌注损伤的影响
李 强,靳书滨,李 峰,霍韶军,张瑞刚
(邯郸市中心医院泌尿外科,河北 邯郸 056001)
目的 探讨刺五加(Aeanthopanax senticosus,AS)注射液预处理对大鼠肾缺血再灌注损伤(Ischemia reperfusion injury,IRI)的保护作用及其机制。方法于2013年12月至2014年5月,实验采用单动脉夹闭法构建大鼠急性肾IRI模型。选用36只健康雄性SD大鼠,按照随机数字法,随机分为六组,每组6只:(1)对照5 h组(Control 5 h组);(2)对照10 h组(Control 10 h组);(3)缺血再灌注损伤5 h组(IRI 5 h组);(4)缺血再灌注损伤10 h组(IRI 10 h组);(5)刺五加注射液预处理后肾缺血再灌注损伤5 h组(AS 5 h);(6)刺五加注射液预处理后肾缺血再灌注损伤10 h组(AS 10 h)。Control组术中仅切除右肾;IRI组及AS组采用切除大鼠右肾,夹闭左侧肾动脉,45min后解除夹闭。AS组于术前5 d每天给予1次及术前0.5 h给予1次刺五加注射液,按100 mg/kg腹腔注射;Control组及IRI组术前5 d及术前0.5 h给予腹腔注射和AS同等剂量的生理盐水。各组于相应的时间点采集下腔静脉血及左肾组织,然后处死各组实验大鼠,检测各组大鼠血清肌酐(Scr)、尿素氮(BUN),肾组织超氧化物岐化酶(SOD)活性及丙二醛(MDA)含量,HE染色光镜下观察各组大鼠肾脏组织的病理变化。结果AS预处理组肾组织病理变化轻于IRI组;与Control组相比较,IRI组的BUN、Scr水平升高(P<0.05),肾组织中的SOD降低及MDA水平增加(P<0.05)。而AS预处理组的Scr、BUN和肾组织的MDA均比IRI组低(P<0.05),而肾组织中的SOD水平升高(P<0.05)。结论AS对肾脏缺血再灌注损伤具有保护作用,其机制可能是通过抗氧化作用实现的。
刺五加注射液;肾缺血再灌注损伤;超氧化物歧化酶;丙二醛
肾缺血再灌注损伤(Ischemia reperfusion injury,IRI)在临床上比较常见。外科常见的是外伤急性失血、术中失血、心脏骤停、肾部分切除术、肾移植、肾动脉重建、肾盂积水、肾挤压伤等,是目前国内外研究的重要课题。再灌注损伤发生时最重要病理机制是大量氧自由基的产生,产生的大量自由基通过脂质过氧化严重损伤细胞。研究证明刺五加(Aeanthopanax senticosus,AS)具有良好的抗氧化、清除氧自由基、增强机体抗氧化功能的作用[1-2]。本研究在建立大鼠肾IRI模型的基础上研究AS对大鼠肾IRI的防治作用。
1 材料与方法
1.1 试剂及仪器 刺五加注射液:黑龙江乌苏里江制药厂生产,每支100ml,含总黄酮300 mg。SOD、MDA试剂盒由南京建成生物工程研究所提供;722分光光度计产于江苏无锡柯达智能仪器厂;电热恒温隔水式培育箱产于湖北省黄石市医疗器械厂;高速低温离心机产于Sigma公司;超低温冰箱产于Forma scientific company。
1.2 动物及分组 本实验采用单动脉夹闭法构建大鼠急性肾缺血再灌注损伤模型。选用36只健康雄性SD大鼠,按照随机数字法,随机分为六组,每组各6只:(1)对照5 h组(Control 5 h组);(2)对照10 h组(Control 10 h组);(3)缺血再灌注损伤5 h组(IRI 5 h组);(4)缺血再灌注损伤10 h组(IRI 10 h组);(5)AS预处理后肾缺血再灌注损伤5 h组(AS 5 h组);(6)AS预处理后肾缺血再灌注损伤10 h组(AS 10 h组)。
1.3 方法 Control组术中仅切除右肾;IRI组及AS组采用切除大鼠右肾,夹闭左侧肾动脉,45min后解除夹闭。AS组于术前5 d每天给予1次及术前0.5 h给予1次刺AS,按100 mg/kg腹腔注射;Control组及IRI组术前5 d及术前0.5 h给予腹腔注射和AS同等剂量的生理盐水。各组于相应的时间点采集下腔静脉血及左肾组织,然后处死各组实验大鼠,检测各组大鼠血清肌酐(Scr)、尿素氮(BUN),肾组织超氧化物岐化酶(SOD)活性及丙二醛(MDA)含量;HE染色光镜下观察各组大鼠肾脏组织的病理变化,
1.4 观察指标
1.4.1 肾组织病理检查 将甲醛固定后的肾脏组织用乙醇阶梯脱水后,二甲苯透明,HE染色,连续切片,切片厚度为3~4 μm,光学显微镜下观察,了解肾组织的损伤情况。
1.4.2 实验室检查 (1)Scr、BUN标本由邯郸市中心医院检验科自动生化分析仪检测。(2)肾组织匀浆SOD活力、MDA含量按说明书方法测定,组织蛋白测定用双缩脲法。
2 结果
2.1 肾组织病理改变 HE染色光镜下,Control组可见肾小球、肾小管结构较清楚,形态基本正常,肾小管上皮细胞未见明显肿胀,无变性、坏死,肾间质改变和炎性细胞浸润不明显(见图1);IRI组病变主要在肾小管,可见到肾小管上皮细胞空泡变性,细胞脱落,炎性细胞浸润明显,部分肾小管可见细胞碎片,肾间质水肿、充血、炎症细胞浸润(见图2);而AS组主要病理表现为肾小管变性,细胞脱落较IRI组减少,肾间质水肿、充血、炎性浸润等病理改变较IRI组明显减轻(见图3)。
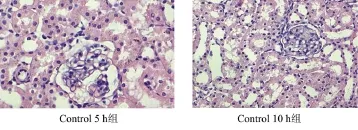
图1 Control 5 h组和Control 10 h组的大鼠肾组织病理变化(HE染色×200)

图2 IRI 5 h组和IRI 10 h组的大鼠肾脏组织病理变化(HE染色×200)

图3 AS 5 h组和AS 10 h组的大鼠肾脏组织病理变化(HE染色×200)
2.2 各组Scr、BUN水平的变化 由表1可以看出,在5 h时IRI与Control组比较Scr、BUN均明显升高,差异有统计学意义(P=0.000、P=0.001),10 h比较差异也有统计学意义(P=0.002、P=0.001)。在5 h时AS组与Control组比较,Scr、BUN均明显升高,差异有统计学意义(P=0.001、P=0.000);10 h时比较发现Scr、BUN均升高,差异有统计学意义(P=0.000、P= 0.003)。在缺血再灌注5 h时,AS组与IRI组比较,发现Scr、BUN明显降低,差异有统计学意义(P=0.000、P=0.000),在10 h时Scr、BUN也明显降低,差异有统计学意义(P=0.000、P=0.001)。从IRI 5 h组和IRI 10 h组相比较结果来看,IRI 10 h组Scr、BUN明显升高,差异有统计学意义(Scr:t=-5.439,P=0.001;BUN:t=-6.777 2,P=0.000)。
表1 各组大鼠不同时间点Scr、BUN水平变化(±s)

表1 各组大鼠不同时间点Scr、BUN水平变化(±s)
注:a表示与Control组同时比较,P<0.05;b表示与IRI组同时比较,P<0.05;c表示与IRI 5 h组比较,P<0.05。
组别BUN(mmol/L)例数Scr(μmol/L) Control 5 h组Control 10 h组IRI 5 h组IRI 10 h组AS 5 h组AS 10 h组3.89±0.29 4.26±038 16.89±1.78a21.4±2.5ac7.51±5.53ab11.54±1.28ab6 6 6 6 6 6 48.42±4.2 46.44±3.9 155.31±15.68a224.26±18.75ac103.39±8.60ab106.51±9.8ab
2.3 各组肾组织MDA、SOD水平的变化 由表2可以看出,在5 h和10 h两个时间点分别比较:IRI组与Control组比较,SOD活性明显降低,MDA含量明显升高,差异有统计学意义(5 h:P=0.002、P=0.003;10 h:P=0.003、P=0.001)。AS组与Control组比较SOD活性明显降低,MDA含量明显升高,差异有统计学意义(5 h:P=0.003、P=0.002;10 h:P=0.003、P= 0.002)。AS组与IRI组比较SOD活性升高,MDA含量则下降,差异有统计学意义(5 h:P=0.001、P=0.002;10 h:P=0.000、P=0.002)。
表2 各组大鼠不同时间点肾组织MDA、SOD水平变化(±s)

表2 各组大鼠不同时间点肾组织MDA、SOD水平变化(±s)
注:a表示与Control组同时比较,P<0.05;b表示与IRI组同时比较,P<0.05;c表示与IRI 5 h组比较,P<0.05。
组别MDA(nmol/mg)例数SOD(U/mg) Control 5 h组Control 10 h组IRI 5 h组IRI 10 h组AS 5 h组AS 10 h组8.08±1.23 7.5±1.45 26.45±3.25a40.32±4.22ac13.16±2.14ab11.38±2.2ab6 6 6 6 6 6 112.7±11.08 125.45±6.35 55.48±6.15a45.61±4.76ac78.24±4.52ab63.78±5.28ab
3 讨论
组织细胞的正常功能,需要良好的血液循环。各种损伤使组织血液灌注减少后,可使组织细胞发生缺血性损伤,及时恢复组织血供,是治疗缺血性损伤的主要方法。但发现部分患者恢复血液再灌注后,细胞功能及结构破坏反而加重,这种现象称为缺血-再灌注损伤。其发病机制至今尚未完全阐明,目前研究表明它与大量氧自由基的生产、细胞内钙超载、中性粒细胞激活、凋亡基因的调控、内皮素等介导的肾小管、肾小球细胞损伤等具有密切关系[3]。
病理过程中,氧自由基对组织的氧化损伤起重要作用。由氧诱发的自由基称为氧自由基或活性氧,如超氧阴离子、羟自由基及单线态氧等非脂性自由基。黄嘌呤氧化酶(Xanthine oxidase,XO)及其前身为黄嘌呤脱氢酶(Xanthine dehydrogenase,XD),二者主要存在毛细血管内皮细胞内。正常时XD占90%,XO只占10%。组织缺血、缺氧,使ATP减少,膜泵失灵,离子转运功能障碍,Ca2+进入细胞增多,激活钙依赖性蛋白酶,使XD转变为黄嘌呤氧化酶XO。同时因缺血缺氧,ATP依次降解为ADP、AMP、腺苷和次黄嘌呤,次黄嘌呤自身不能代谢生成黄嘌呤,使得次黄嘌呤大量蓄积。再灌注时,随着血液的进入,缺血组织重新得到氧,在缺血时大量蓄积的次黄嘌呤在XO的作用下形成黄嘌呤,继而又催化黄嘌呤转化为尿酸,这两步反应都有电子转移,以分子氧作为电子受体,氧分子可得到电子,生成大量超氧阴离子自由基(氧自由基)。而此时肾脏内的SOD、过氧化氢酶(CAT)等因为缺血缺氧,清除氧自由基的能力下降。氧自由基大量蓄积,氧自由基和脂性自由基的性质极为活泼,易于失去电子(氧化)或夺取电子(还原),特别是其氧化作用强,故具有强烈的引发脂质过氧化损伤的作用,它最易损伤膜脂质,导致钙泵、钠泵等膜蛋白功能受到损伤,发生细胞肿胀和钙超载,细胞信号转导发生障碍。Araujo等[4]研究证实,氧自由基在肾IRI中起了非常重要的作用,是肾脏再灌注损伤的重要介质。氧化损伤也可使细胞产生凋亡,Chatterjee等[5]发现IRI能引发广泛的细胞凋亡现象。
国内外许多学者将具有抗氧化作用的药物应用于缺血再灌注损伤的研究。SOD是组织产生的清除氧自由基的重要酶之一,和其他抗氧化剂协同作用将超氧阴离子歧化为H2O2,进而转变为H2O,从而使得超氧阴离子对生物体细胞损伤作用消失,起到保护作用。SOD反映机体清除氧自由基的能力,是抗氧化指标之一。MDA是脂质过氧化的代谢产物。通过检测MDA含量可以估计肾组织中脂质过氧化反应的强弱。
刺五加注射液是纯天然五加科植物刺五加的茎叶经水醇法提取,利用现代科学技术精制而成,主要成分为总黄酮,能扩张血管,降低血液粘稠度[6],促进血液循环,减少组织耗氧量和组织代谢,有抗疲劳、抗应激、抗炎[7]作用,能清除氧自由基及提高人体超氧化物歧化酶活性及清除氧自由基的能力。很多动物实验研究表明,刺五加注射液对缺血再灌注的心脏、脑、肝脏、肠、肢体均具有保护作用[8-10],其作用机制与其清除氧自由基、防止脂质过氧化有关。其用于肾脏缺血再灌注损伤的研究尚无报道。本试验结果:从IRI 5 h组和IRI 10 h组相比较结果可见,大鼠肾IRI模型建立后,肾功能发生明显障碍,而且在早期的一段时间内(5 h、10 h),BUN、Scr逐渐升高,肾功能障碍逐渐加重。从AS组、IRI组分别与Control组相比较结果可见,BUN、Scr均明显升高,说明造模较成功,AS组、IRI组大鼠肾功能均发生明显障碍。进一步看AS组与IRI组相比较的结果,AS组BUN、Scr均降低,可见AS预处理可使大鼠肾IRI后肾功能明显改善,起到保护作用。HE染色可见Control组肾小球、肾小管结构清晰,无水肿、炎细胞浸润、细胞变性、管腔狭窄等病理改变;IRI组出现明显病理改变,其肾小球形态结构变化不明显,病变主要集中在肾小管,可见到肾小管上皮细胞空泡变性,细胞脱落,炎性细胞浸润明显,部分肾小管可见细胞碎片,肾间质水肿、充血、炎症细胞浸润,说明造模后由于IRI导致大鼠肾脏出现明显病理改变;而AS组主要病理表现为肾小管变性,细胞脱落较IRI组减少,肾间质水肿、充血、炎性浸润等病理改变较IRI组明显减轻,考虑AS预处理对缺血再灌注损伤起到保护作用,病理改变明显减轻。从AS组、IRI组分别与Control组相比较结果可见:大鼠肾组织的MDA水平均明显升高,而SOD活性均明显降低,提示大鼠肾IRI后脂质过氧化反应增强,内源性自身抗氧化能力减弱。而从AS组与IRI组相比较结果可见:AS组较IRI组MDA水平明显降低,SOD活性显著升高,可看出组织抗氧化能力提高,氧化损伤反应减轻。
综合以上试验结果,我们考虑AS预处理可对大鼠肾缺血再灌注损伤起到保护作用,其机理可能与其有抗氧化作用,能提高细胞的抗氧化能力,减轻氧自由基大量释放导致的组织脂质过氧化反应,而产生保护作用。由于缺血再灌注损伤病理机制极其复杂,AS预处理对于其的保护作用,还需要进一步、多方面试验进行观察。
[1]刘文闯,刘春明,陆 娟,等.刺五加叶中总黄酮的分离提取及抗氧化活性研究[J].辽宁中医杂志,2009,38(8):1622-1625.
[2]Sparg SG,Light ME,Staden JV.Biological activities and distribution of plant saponins[J].J Ethnopharm,2004,94:219-243.
[3]Ramesh G,Reeves WB.Inflammatory cytokines in acute renal failure[J].Kinney Int,2004,91(Suppl):56-62.
[4]Araujo M,Welch WJ.Oxidative stress and nitric oxide in kidney function[J].Curr Opin Nephrol Hypertens,2006,15(1):72-77.
[5]Chatterjee PK,Brown PA,Cuzzocrea S,et al.Calpain inhibitor reduces renal ischemia reperfusion injury in the rat[J].Kidney International,2001,59(6):2073-2083.
[6]韩晓东.刺五加注射液对急性血淤模型大鼠血液流变学的影响[J].中国实用医药,2009,4(36):45-47.
[7]Lee YJ,Chung HY,Kwak HK,et al.The effects of A senticosus supplementation on serum lipid profiles,biomarkers of oxidative stress, and lymphocyte DNA damage in postmenopausal women[J].Biochem Biophys Res Commun,2008,375(1):44-48.
[8]何化林,罗 维,刘伟新,等.刺五加注射液对肠缺血再灌注损伤保护作用的实验研究[J].黑龙江医药科学,2005,28(6):5-6.
[9]刘天丹,黄良国,王凤英,等.刺五加注射液对脑出血大鼠血肿周围组织含水量、SOD、MDA水平的影响[J].中西医结合心脑血管病杂志,2009,7(9):1055-1057.
[10]王瑞国,黎万友,张延明,等.刺五加注射液对肢体缺血再灌注损伤的影响[J].中医正骨,2005,17(3):9-11.
Effect of Aeanthopanax senticosus pretreatment on acute renal ischemia-reperfusion injury in rats.
LI Qiang, JIN Shu-bin,LI Feng,HUO Shao-jun,ZHANG Rui-gang.Department of Urology,Handan Central Hospital,Handan 056001,Hebei,CHINA
ObjectiveTo observe the protective effect of Aeanthopanax senticosus(AS)and discuss its possible mechanism on rats with acute renal ischemic reperfusion injury(IRI).MethodsRats with acute renal ischemia reperfusion injury model were constructed by single-artery occlusion.Thirty-six healthy male SD rats were selected and randomly divided into six groups:Control 5 h group,Control 10 h group,IRI 5 h group,IRI 10 h group,AS 5 h group,AS 10 h group.In Control group,right kidney was removed.In IRI and AS group,right kidney was removed, and the left renal was occlusived for 45minutes.AS 5 h group,AS group rats were injected 100 mg/kg AS intraperitoneally once per day in the 5 days before surgery and 30minutes before surgery.Control group and IRI group rats were injected saline at the equivalent dose at the same time.Venous blood and left kidney tissue were taken at corresponding time point(5 h and 10 h)in each group.The levels of Scr and BUN were measured,as well as SOD and MDA activity of kidney tissue.Pathological changes of renal tissue were observed by H-E staining technique.ResultsPathological changes of renal tissue were lighter in AS group than IRI group.Compared with Control group,BUN,Scr levels in IRI were significantly increased(P<0.05),with SOD decreased and MDA increased(P<0.05).Compared with IRI group,Scr,BUN,MDA in AS group were significantly lower(P<0.05).ConclusionAeanthopanax senticosus could protect the kidney against renal ischemia reperfusion injury,which might be realized by its antioxidant.
Aeanthopanax senticosus;Renal ischemia reperfusion injury;Superoxide dismutase;Malondialdehyde
R-332
A
1003—6350(2015)04—0475—04
2014-08-13)
10.3969/j.issn.1003-6350.2015.04.0174
李 强。E-mail:xinghuoliqiang@163.com
