胶孢炭疽菌侵染柱花草叶片的显微观察
2015-04-15杨茂霞林国彪陈彩虹王荟罗丽娟
杨茂霞,林国彪,陈彩虹,王荟,罗丽娟
(海南大学农学院,海南省热带生物资源可持续利用重点实验室,海南 海口 570228)
胶孢炭疽菌侵染柱花草叶片的显微观察
杨茂霞,林国彪,陈彩虹,王荟,罗丽娟*
(海南大学农学院,海南省热带生物资源可持续利用重点实验室,海南 海口 570228)
为了研究胶孢炭疽菌在柱花草叶片上的侵染进程和植株接种病原菌后的反应,用胶孢炭疽菌孢子悬浮液接种生长6周的热研2号柱花草幼苗,显微观察接种后炭疽菌在柱花草叶片上的侵染过程,统计植株病情指数。结果表明,接种4 h时孢子开始萌发、少量形成附着胞;6 h孢子大量萌发,12 h时大量附着胞形成并形成侵染钉;36 h时开始产生菌丝;48 h时菌丝大量产生纠结成网状;60 h时开始形成分生孢子梗;72 h时产生新的分生孢子。接种72 h部分病原菌完成了一个侵染循环。同时柱花草发病症状为:叶片24 h黄化,有侵染点细胞膜破裂,48 h出现褐色病斑,72 h病斑出现黑褐色坏死线、点状菌核、绒毛状菌丝,96 h细胞崩解死亡,组织液外流。8 d病情指数为54.52,11 d有55%的接种植株死亡。
柱花草;柱花草炭疽菌;侵染;显微结构;病害症状
柱花草(Stylosanthesespp.)是热带及亚热带地区最重要的豆科牧草之一,广泛分布于澳大利亚北部、亚洲东南部、南美和非洲,具有草质好、产量高、耐旱、耐酸性贫瘠等特点[1],在我国的南方省区广泛种植。炭疽病是危害柱花草生产的主要因素之一,该病造成茎叶枯萎脱落,严重影响产量[2]。柱花草炭疽病主要由刺盘胞属胶孢炭疽菌(Colletotrichumgloeosporioides)引起,自1975年在南美的哥伦比亚爆发后迅速蔓延[3]。在我国华南地区,高温高湿多雨条件下发病极快,3~5 d连续高温多雨天气柱花草叶片均发黄,出现不同程度的褐色病斑[4-5]。因此培育优良的抗病品种对柱花草的推广种植至关重要。
炭疽菌属(Colletotrichum)真菌在世界范围内危害多种重要经济作物,引起植物炭疽病。炭疽菌采用不同的致病机制来瓦解寄主的防御机制,包括胞内半活体侵染,角质层下层侵染,胞内死体侵染[6]。胶孢炭疽菌是一种半活体营养寄生菌((hemibiotroph),侵染特点包括在侵染初期短暂的活体营养阶段和后期的死体营养两个阶段[7]。前人在柱花草胶孢炭疽菌的遗传多样性[8-10]、各柱花草品种的抗病性等方面的研究均有大量报道[11-12]。对柱花草炭疽病发病过程的研究则多集中在侵染中后期的寄主表型,缺乏病原菌侵染植株前期的细胞学过程,具体侵染行为、侵染时期、侵染方式等侵染循环的研究。
本研究通过对胶孢炭疽菌侵染柱花草叶片的动态显微观察及植株的病情统计,明确胶孢炭疽菌对柱花草叶片的侵染过程及寄主对病原菌侵染的反应,在细胞学水平上了解病原菌-寄主植物互作机制,对抗病育种及病害防治有重要意义。
1 材料与方法
1.1 实验材料
供试柱花草品种为热研2号(S.guianensiscv. Reyan2)。种子来自热带农业科学院儋州牧草中心,2014年5月14日播种,10 cm×10 cm苗盆每盆1粒,盆土为灭菌土∶腐殖土∶蛭石按2∶1∶1混合,置于海南大学农学院基地大棚内生长6周,种植期间大棚温度为25~35℃,每天或隔天浇水保持土壤适当水分。
接种用病原菌为采自儋州牧草种质圃的柱花草病叶,单菌落分离的胶孢炭疽菌。将病原菌接种于直径8 cm的PDA培养皿上,在温度28℃条件下暗培养7 d,用无菌牙签对平板划线,培养3~5 d,直到平板大量产孢,无菌水冲洗孢子,双层无菌纱布过滤,将洗出的孢子用无菌水配成浓度为1×106个/mL的孢子悬浮液,4℃保存备用,接种前加入0.2%的Tween-20。
1.2 接种方法
喷雾器均匀喷洒上述孢子悬浮液,直到植株叶片滴水。对照用加有0.2%Tween-20的无菌水喷洒,处理对照各40株,重复3次。接种植株28℃暗培养12 h,再置于温度28℃,光照4000 lx,光照时长14 h,湿度大于90%的密闭接种室内培养,观察并记录植株病害症状,并于接种后第8天统计各接种植株炭疽病病情级别,据此计算病情指数,病情分级标准参照Kelemu等[8]的文献记载。
1.3 材料的制备与显微观察
分别于接种后0,4,6,9,12,24,36,48,60,72,96,120 h,取处理、对照柱花草第3和4片完全展开叶。将采集叶片切成直径5 mm小块,用于制备不同样品观察。
制备观察孢子形态及侵染特征的样品。借鉴方中达[13]的真菌染色方法加以改进,将样品用饱和的水合氯醛抽真空脱色36 h,期间12 h换1次脱色液。然后取出小叶用无菌水洗去残留溶液,吸水纸吸干,0.5%的水溶苯胺蓝(aniline blue)加热沸腾后染色3 min,洗去染液,50%甘油保存。镜检时用水作浮载剂。显微镜观察(Olympus BX51)接种后各时间点的病原菌形态发育特征,并统计孢子萌发,产生附着胞、侵染钉、菌丝、分生孢子梗和新分生孢子的时间点和百分率。孢子萌发,附着胞、侵染钉、菌丝产生每次随机统计30个孢子,分生孢子梗产生及产孢每次随机统计30个侵染点,3次重复。
制备观察细胞致死及胼胝质产生的样品。采用台盼蓝染色寄主细胞,如果胶孢炭疽菌侵入细胞膜,造成细胞膜被破坏,台盼蓝染液进入寄主胞质,寄主细胞将会被染成蓝色。健康的柱花草细胞,台盼蓝不会进入胞质,细胞不会被染上颜色。参照Stone等[14]的方法,将样品用乳酚(V酚∶V甘油∶V乳酸∶V水=1∶1∶1∶1)及2倍体积的乙醇脱色(抽真空15~30 min),65℃水浴30~45 min直到叶片透明,然后用乳酚冲洗,之后将样品置于含2.5 mg/mL的台盼蓝染色液中(乳酚油配制),沸水浴2 min,冷却染色1 h,然后在乳酚中脱色1 h。之后置于脱色苯胺蓝染液(150 mmol/L K2HPO4,pH 9.5,0.01% Trypan Blue)中复染15 min,50%甘油保存。镜检用水作浮载剂。
制备电子显微镜观察样品。将采集叶片于冷冻干燥机(SCIENTZ-10N)中冷冻干燥9 h,然后平整贴于粘有导电黑胶的圆形铜台上,送入真空镀膜机中喷金,在S-3000N型扫描电镜下进行观察和拍照。
1.4 数据统计与分析

2 结果与分析
2.1 病害症状与病情指数
接种后的柱花草叶片大多从叶尖开始发病,病症逐步向叶基蔓延。后期少数幼叶从中部发病,向四周蔓延。接种12 h内无明显症状,24 h左右叶尖略微黄化,且病状扩大。接种48 h,叶片开始出现0.5~1.0 mm大小褐色软腐水渍状病斑。接种72 h,病斑出现黑褐色坏死线、点状菌核、绒毛状菌丝病症(图1)。随着病斑的扩大,发病叶片脱落,发病茎秆从植株中部靠上的位置折断,接种后8 d统计病情指数为54.52,为感病。11 d统计死亡株数,55%的接种植株死亡。
2.2 接种孢子在柱花草叶片上的侵染循环
接种孢子首先附着于植株表面,接种4 h病菌孢子从端部或近端部萌发出棒状芽管,6 h大量孢子萌发。随后芽管顶端开始膨大,分化成特异的侵染结构附着胞,12 h超过50%的孢子产生附着胞,附着于寄主叶片表面,附着胞产生侵染钉。随后分生孢子的端部再出芽产生第2个附着胞,或从芽管上分化出侧枝产生附着胞,这个现象在接种24 h到72 h均观察到。接种36 h孢子产生有分枝的菌丝,同时伴随着接种孢子异化成有隔、间距短的粗壮菌丝。接种48 h大量菌丝生成,相互交错成网状,集聚在叶片上。接种60 h内生菌丝产生短棒状的分生孢子梗,突破寄主表皮细胞在叶片表面呈花环状排列。接种72 h部分孢子梗上产生新的分生孢子,成串排列,完成一个侵染循环,成熟孢子脱落附着在叶片上准备下一次侵染循环。病原菌通过不断循环侵染植株,导致病害蔓延,直至整株发病死亡(图2)。
以各侵染结构统计比率达到50%作为阈值,统计各侵染结构形成高峰期,得出柱花草炭疽菌感染寄主的5个关键时期:1)接种4~6 h为孢子萌发高峰期;2)接种9~12 h为附着胞及形成高峰期;3)接种36~48 h为菌丝形成高峰期;4)接种60~72 h为分生孢子梗形成高峰期;5)接种72~120 h为产孢高峰期。前两个时期为侵染前期,柱花草叶片无明显症状;第3个时期为病原物的潜育期,植株叶片出现病斑;后两个时期为侵染后期,为炭疽菌第2次侵染宿主提供病原物,植株病斑扩大,有明显病症。
2.3 附着胞在寄主叶片上的发育进程及病原菌对寄主侵染结构的超微观察
附着胞生长发育过程如下:首先分生孢子芽管顶端开始膨大(图3A)。膨大部分生长形成有吸附作用的中间凹陷,四周凸起的吸盘状结构,此时的附着胞颜色较浅,胞质较稀疏(图3B)。当吸盘结构与柱花草叶片接触一段时间后,其吸附口紧贴叶片,吸附于叶片表面,呈心形、水滴形及圆形等各种不规则形态,附着胞在形态的分化成熟过程中,附着胞胞壁逐渐黑色素化,胞质稠密(图3C)。当附着胞附着在寄主叶片表面后,在中间位置形成1个圆形小亮点,即侵染钉,侵染钉穿透寄主角质层和细胞壁,开始第1次侵染(图3D)。在第1次侵染之后,孢子会从两端继续萌发出芽管,多数形成2~3个,少数形成4~5个附着胞多位点侵染(图3E、F)。
当病原菌识别寄主后,开始产生一系列的侵染结构:附着胞、侵染钉、侵染菌丝。除了通过上述的附着胞产生侵染钉侵染寄主(图3D),电镜扫描寄主上表皮观察到接种后24 h病原菌从附着胞处形成侵染菌丝定植于寄主细胞(图4A),形成内生菌丝在寄主细胞间蔓延。接种后36 h,寄主表面附着胞、表面菌丝穿透寄主细胞直接侵染寄主(图4B)。

图1 接种后热研2号柱花草发病症状Fig.1 The symptom of S. guianensis cv. Reyan2 after inoculating
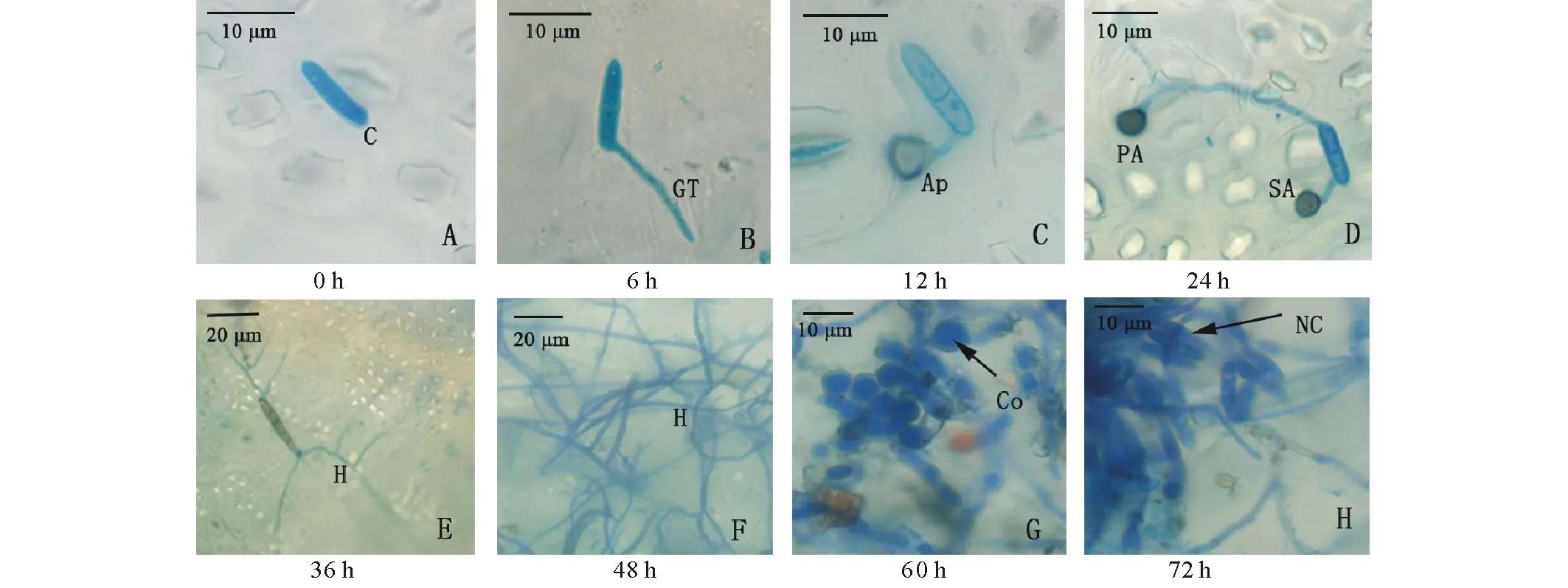
图2 接种后胶孢炭疽菌在柱花草上的侵染循环Fig.2 Infecting cycle of C. gloeosporioide after inoculating Stylosanthese A:0 h接种孢子附着在叶片上 Inoculated spores adhere to the leaves at 0 h; B:6 h孢子萌发长出芽管 Germination of germ tube at 6 h; C:12 h孢子产生附着胞 Formation of appressorium at 12 h; D:24 h孢子产生多个附着胞 Formation of more than one appressoria at 24 h; E:36 h孢子上产生多条菌丝 Formation of multi-hyphea on one spore at 36 h; F:48 h生成大量菌丝且纠结成网状 Formation of affluent hyphea at 48 h; G:60 h产生分生孢子梗 Generation of conidiophores at 60 h; H:72 h产生分生孢子 Production of new spores; C:分生孢子Conidium; GT:芽管Germ tube; Ap:附着胞Appressoria; PA:第1个附着胞Primary appressoria; SA:第2个附着胞Second appressoria; H:菌丝Hyphea; Co:分生孢子梗Conidiophores; NC:新产生的分生孢子New spores.

图3 附着胞在植株上的生长发育进程Fig.3 Developmental progress of the appressoria on the plant A:芽管顶端膨大开始分化附着胞 Enlargement of the top of the germ tube; B:膨大部分形成吸盘状结构附着胞 The enlargement part turns into appressoria with sucker shape and light color; C:吸盘状附着胞吸附在寄主表面呈现心形、水滴形和圆形等不规则形态且细胞壁内黑色素加深 The appressoria adsorbs on the cuticle with the color become dark and presents irregular shapes such as heart, water-drop and roundness; D:附着胞中间亮点部分为侵染钉 Formation of penetration peg (internal light spot) and penetration; E、F:孢子形成多个附着胞多位点侵染Formation of multi-appressorium and penetration by more than one points; ILS:内部亮点Internal light spot; PA:第1个附着胞Primary appressoria; SA:第2个附着胞Second appressoria; TA:第3个附着胞Third appressoria.

图4 胶孢炭疽菌侵染柱花草叶片扫描电镜观察Fig.4 Observation of C. gloeosporioides infecting the leaves of Stylosanthese by SEM A:24 h侵染菌丝侵染柱花草叶片 Penetration hpyhea penetrate host leaves at 24 h; B:36 h附着胞及菌丝均侵染叶片 Plentiful appressorium and hpyhea penetrate host leaves at 36 h. PH:侵染菌丝Penetration hpyhea; SM:叶片表面菌丝Surface mycelium; IH:内生菌丝Internal hpyhea; Ap:附着胞Appressoria.
2.4 寄主细胞对胶孢炭疽菌侵染的反应
接种后0~24 h均未观察到寄主细胞被台盼蓝染液染上蓝色,24 h部分胶孢炭疽菌附着胞侵染点细胞被染色,表明接种后24 h胶胞炭疽菌初次侵入寄主细胞(图5A、B),在侵染钉穿透寄主细胞壁后,形成初生菌丝穿透细胞膜,使寄主细胞染色。而部分菌产生多个附着胞、侵染钉多次侵染仍然没有造成寄主细胞膜的破裂,侵染点细胞未着色(图5C)。接种后96 h寄主细胞崩解,组织液外流粘附在叶片表面(图5D、E),此时的病原菌已经进入了第2次侵染循环。
由于胼胝质与脱色苯胺蓝反应,产生荧光反应。对各时间点采集叶片进行脱色苯胺蓝染色、荧光显微镜观察,均未检测到荧光,说明寄主感病前期无胼胝质的形成。

图5 胶孢炭疽菌侵染致死寄主细胞及寄主细胞的崩解Fig.5 The host cells killed by C. gloeosporioides and collapse A、B:接种后24 h附着胞侵入寄主细胞,台盼蓝进入细胞,侵染点细胞被染上蓝色 The blue host cell near the infection point indicated that the appressoria have infected the host after 24 h inoculated; C:接种后48 h孢子产生5个附着胞,5个位点侵染寄主,无任何侵染点着色,未穿透寄主细胞膜 The colorless cell near the infection point indicated that the spores haven’t infected host after five times inoculated; D、E:96 h寄主细胞崩解,大量褐色组织液外流,粘附在叶片表面 After 96 h inoculated the host cell collapses, a lot of brown tissue liquid flows out and adheres to the leaf surface.
3 结论与讨论
胶孢炭疽菌与豆炭疽菌(C.lindemuthianum)的侵染模式相同,均属于胞内半活体营养菌(intracellular hemibiotrophy),与寄主建立了两个营养关系:活体营养和死体营养[16-17]。活体营养阶段,寄主细胞保持活力,病原菌形成一系列特殊的侵染结构。为了侵入寄主的表皮细胞,病原菌在识别寄主后开始萌发长出芽管,然后快速分化出高度特异的侵染结构附着胞。附着胞附着在寄主表面后,其内的渗透活性复合物逐渐合成黑色素,黑色素对寄主细胞壁有选择渗透性,结合附着胞的渗透力会产生巨大的膨压,形成侵染钉侵入寄主,宽的初生菌丝形成。半活体营养菌侵染过程中活体营养阶段都较短,一般为一天到几天[18-19]。之后窄的次生菌丝产生,其为更具有破坏性的死体营养菌,次生菌丝的产生标志着侵染进入了死体营养阶段。死体营养阶段,菌丝需穿透寄主细胞壁,在细胞间蔓延[20-22]。本实验仅观察到侵染钉、侵染菌丝的侵染,及菌丝在细胞内的蔓延;但未能从形态上直接区别初生菌丝和次生菌丝,因此不能确定整个侵染过程中活体营养阶段和死体营养阶段的分界点。最后寄主表面出现分生孢子梗并产孢,完成一个侵染循环,且确定其在接种后72 h就完成。
Ranathunge等[23]用平头炭疽菌接种辣椒,孢子萌发始于接种后2 h,12 h大量产生附着胞,12~24 h侵染钉大量产生,72 h菌丝侵染。Vinijsanun等[10]用B型胶孢炭疽菌侵染爱德华柱花草(Endeavour),24 h产生附着胞和侵染钉,72 h内生菌丝形成,此时寄主细胞并未崩解。而本研究用B型菌侵染热研2号柱花草,发病提前,接种后72 h病原菌完成侵染循环,96 h寄主细胞崩解。发病进程的差异与病原菌致病性、寄主抗病性、接种菌量和培养条件等有关。病原菌的致病性强,寄主感病,接种孢子浓度大,培养条件高温高湿,则植株发病迅速,反之,植株发病较慢。本研究通过对接种叶片的侵染形态观察,明确了炭疽菌各侵染结构的形成过程及形成的关键时期,并揭示了柱花草的整个发病过程、坏死及崩解反应;为柱花草与胶孢炭疽菌的互作,抗病相关代谢产物及抗病基因的研究提供了依据,同时也为病害防控奠定了基础。
[1] Irwin J A G, Cameron D F, Lenne J M. The Biology and Agronomy ofStylosanthes[M]. Sydney, Australia: Academic Press, 1984: 73-101.
[2] Sonoda R M. Incidence ofColletotrichumleaf spot and stem canker on introductions and selections ofStylosantheshumilis. Plant Disease Reporter, 1973, 57(9): 747-749.
[3] Baldion R W, Lozano J C, Grof B. Evaluation of resistance ofStylosanthesspp. anthracnose (Colletotvichumgloeospovioides). Fitopathologia, 1975, 10(2): 104-108.[4] Feng S F, Li F E, He C Z. Bionomics and epidemiology go anthracnose onStylosanthesspp..Chinese Journal of Tropical Crops, 1994, 15(1): 87-94.
[5] Yi K X, Zheng J L, Xi J G,etal. Preliminary study of epidemic factors ofColletotrichumgloeosporioidesin stylo. Chinese Journal of Tropical Agriculture, 2014, 34(2): 74-78.
[6] Bailey J A, Jeger M. Colletotrichum: Biology, Pathology and Control[M]. Wallingford: UK CAB International Press, 1992: 88-120.
[7] Mendgen K, Venue M H. Plant infection and the establishment of fungal biotrophy. Trends in Plant Science, 2002, 7(8): 352-356.
[8] Kelemu S, Skinner D Z, Badel J L. Genetic diversity in South AmericanColletotrichumgloeosporioidesisolates fromStylosanthesguianensis, a tropical forage legume. European Journal of Plant Pathology, 1999, 105(3): 261-272.
[9] Kelemu S, Badel J L, Moreno C X,etal. Virulence spectrum of South American isolates ofColletotrichumgloeosporioideson selectedStylosanthesguianensisgenotypes. Plant Disease, 1996, 80: 1355-1358.
[10] Vinijsanun T, Irwin J A G, Cameron D F. Host range of three strains ofColletotrichumgloeosporioidesfrom tropical pasture legumes, and comparative histological studies of interactions between type B disease-producing strains andStylosanthesscabra(Non-host) andS.guianensis(Host). Australian Journal of Botany, 1987, 35(6): 655-677.
[11] Zhang W L, Guo Z F. Preliminary identification of the pathogen of stylo anthracnose disease and assessment of resistance ofStylosanthesspp..Guangdong Agricultural Sciences, 2007, 2: 51-54.
[12] Irwin J A G, Cameron D F. Two diseases inStylosanthesspp. caused byColletotrichumgloeosporioidesin Australia, and pathogenic specialization within one of the causal organisms. Crop and Pasture Science, 1978, 29(2): 305-317.
[13] Fang Z D. Research Methods of Plant Desease[M].Third edition. Bengjing: China Agriculture Press, 1998: 104-116.
[14] Stone J M, Heard J E, Asai T,etal. Simulation of fungal-mediated cell death by fumonisin B1 and selection of fumonisin B1-resistant (fbr)Arabidopsismutants. The Plant Cell, 2000, 12: 1811-1822.
[15] Wang S L, Liang P, Liu W B,etal. Cytological analysis of compatible interactions between rubber tree andOidiumheveae. Plant Protection, 2014, 40(3): 26-36.
[16] Connell R J, Bailey J A, Richmond D V. Cytology andphysiology of infection ofPhaseolusvulgarisbyColletotrichumlindemuthianum. Plant Pathology, 1985, 27: 75-98.
[17] Zhang J Z, Xu T. Cytological characteristics of the infection in different species, varieties and organs of persimmon byColletotrichumgloeosporioides. Mycosystema, 2005, 24(1): 116-122.
[18] Deising H B, Werner S, Wernitz M. The role of fungal appressoria in plant infection. Microbes Infect, 2000, 2(13): 1631-1641.
[19] Mendgen K, Deising H. Infection structures of fungal plant pathogens- a cytological and physiological evaluation. New Phytologist, 1993, 124(2): 193-213.
[20] Muhammed Z, Brlansky R H, Timmer L W. Intection of flower and vegetative tissues of Citrus byColletrichumacutatumandC.gloeosporioides. Mycological Society of America, 1996, 88(1): 121-128.
[21] Binyamini N, Nacel M S. Latent infection in Avocado fruit due toColletotrichumgloeosporioides. Phytopathology, 1971, 62: 592-594.
[22] Coates L M, Muirhead I F, Irwin J AG,etal. Initial infection processes byColletotrichumgloeosporioideson avocado fruit. Mycological Research, 1993, 97(11): 1363-1370.
[23] Ranathunge N P, Mongkolporn O, Ford R,etal.Colletotrichumtruncatumpathosystem onCapsicumspp: infection, colonization and defence mechanisms. Australasian Plant Pathology, 2012, 41(5): 463-473.
参考文献:
[4] 冯淑芬, 李凤娥, 何朝族. 笔花豆炭疽病菌生物学特性和流行条件研究. 热带作物学报, 1994, 15(1): 87-94.
[5] 易克贤, 郑金龙, 习金根, 等. 柱花草炭疽病流行因子初探. 热带农业科学, 2014, 34(2): 74-78.
[11] 张伟丽, 郭振飞. 柱花草炭疽病菌初步鉴定及柱花草抗性分级研究. 广东农业科学, 2007, 2: 51-54.
[13] 方中达. 植病研究方法[M]. 第三版. 北京: 中国农业出版社, 1998: 104-116.
[15] 万三连, 梁鹏, 刘文波, 等. 橡胶树与白粉病菌Oidiumheveae亲和互作组织细胞学研究. 植物保护学报, 2014, 40(3): 26-36.
[17] 张敬泽, 徐同. 柿树炭疽菌侵染不同柿树种、品种和部位的细胞学特征. 菌物系统, 2005, 24(1): 116-122.
Microscopic observation ofStylosantheseinfected byColletotrichumgloeosporioides
YANG Mao-Xia, LIN Guo-Biao, CHEN Cai-Hong, WANG Hui, LUO Li-Juan*
AgronomyofHainanUniversity,HainanProvincialKeyLaboratoryofTropicalBiologicalResourcesSustainableUtilization,Haikou570228,China
In order to study the disease progress of Stylo anthrocnose and the inoculated plants reaction, the 6 weeks old ofStylosantheseguianensiscv. Reyan2 inoculated by the suspension liquid ofColletotrichumgloeosporioidesspores. Microscopic observations of the leaves revealed the infecting process and counting the disease index through plant symptoms. Spores germinated and a few spores formed appressorium at 4 h. Most of spores germinated at 6 h, and a large quantity of geminating spores formed appressorium at 12 h and began to form penetration pegs. The inoculated spores began to produce hyphae at 36 h, a lot of hyphae formed and staggered into a mesh on the surface of the leave at 48 h. The geminating spores began to form conidiophores at 60 h. Numerous of new spores began to produce at 72 h. Parts of inoculated spores have finished disease cycle in 72 h. In the same time, plants appeared disease symptom gradually: leaves color became yellow, the host cell membrane rupture at 24 h, brown necrosis appeared at 48 h, then dead line,sclerotinite,mycelium appeared on the leaves surface at 72 h. The host cell began to collapse at 96 h. Disease index is 54.52 at 8 days, 55% of inoculated plants dead at 11 days.
Stylosanthese; Stylo anthrocnose; infection; microstructure; desease symptom
10.11686/cyxb20150521
http://cyxb.lzu.edu.cn
2015-01-27;改回日期:2015-03-12
国家自然科学基金(31360575)和国家牧草产业技术体系热带牧草育种(CARS-35-03)资助。
杨茂霞(1989-),女,四川达州人,在读硕士。E-mail:18789231651@163.com *通讯作者Corresponding author. E-mail:luoljd@126.com
杨茂霞, 林国彪, 陈彩虹, 王荟, 罗丽娟. 胶孢炭疽菌侵染柱花草叶片的显微观察. 草业学报, 2015, 24(5): 175-181.
Yang M X, Lin G B, Chen C H, Wang H, Luo L J. Microscopic observation of Stylo infected byColletotrichumgloeosporioides. Acta Prataculturae Sinica, 2015, 24(5): 175-181.
