Wnt 信号通路在有氧运动改善高脂饮食诱导C57BL/6 小鼠胰岛素抵抗中的作用
2015-04-15孙婧刘素娟牛燕媚傅力
孙婧 刘素娟 牛燕媚 傅力
1 天津医科大学基础医学院生理学与病理生理学系(天津300070)
2 天津医科大学基础医学院解剖与组织胚胎学系
3 天津医科大学康复与运动医学系
1 前言
胰岛素抵抗(Insulin Resistance, IR) 指胰岛素作用的靶器官对胰岛素作用敏感性下降, 即正常剂量的胰岛素产生低于其正常生物学效应的状态。 IR的发生涉及多个信号通路,是一种多位点、多层次胰岛素信号共同作用异常的状态[1]。现代人们生活方式如偏爱富含饱和脂肪酸、 单糖和胆固醇的西式饮食和疏于运动是导致IR及其合并代谢综合征发病率俱增的主要因素。
长期规律性有氧运动已成为防治代谢综合征的有效手段之一,而其中的分子生物学机制尚不完全清楚。 运动对胰岛素敏感性及相关信号传导通路的作用效果极其复杂,主要与运动方式、运动强度及持续时间有关[2,3]。 有研究发现运动可通过增加一些关键蛋白质的表达及提高其活性以增强机体利用和摄取葡萄糖的能力。 这些关键蛋白质主要指与骨骼肌细胞葡萄糖摄取及代谢相关的调控蛋白; 与骨骼肌细胞胰岛素信号传导相关的蛋白质(AMPK和AS160);与线粒体形成相关、可促进机体脂氧化能力的蛋白质[4]。
近年有研究发现Wnt信号通路不仅在胚胎发育、肿瘤发生中有重要作用, 还与IR、T2DM及肥胖的发生发展有密切关系[5,6]。有研究发现Wnts通过增加胰高血糖素样多肽1(Glucagon Like Peptide-1, GLP-1)的表达,诱导胰岛β细胞增殖并减少其凋亡,促进葡萄糖刺激胰岛素分泌[7,8]。 有研究显示胰岛β细胞基因GSK3β敲除(β-GSK-3β-/-)小鼠可改善机体葡萄糖耐受能力,促进β细胞增殖而抵抗高脂饮食诱导IR发生[9]。还有研究发现糖尿病大鼠表皮干细胞内β-catenin 和细胞周期蛋白(Cyclin D1)的mRNA及蛋白表达与其对照组相比显著下降,这可能是糖尿病患者伤口不易愈合的原因之一[10]。 另有研究发现人类骨骼肌的收缩活动可调节GSK3和βcatenin分子的生物活性[11]。
鉴于Wnt信号通路及通路关键信号蛋白GSK3β和β-catenin与IR发生及运动改善IR之间关系密切, 推测有氧运动可通过增加小鼠骨骼肌细胞GSK3βSer9蛋白磷酸化表达,降低其下游信号蛋白β-cateninSer33/37,βcatenin Thr41磷酸化激活Wnt信号通路,由此调控机体糖脂代谢,提高机体外周组织对胰岛素敏感性,从而防治IR。 因此,本实验通过10周高脂饮食喂养C57BL/6小鼠诱导IR发生,随后通过6周有氧跑台训练,比较分析高脂饮食及有氧运动干预下各组C57BL/6小鼠骨骼肌细胞GSK3β和β-catenin基因、蛋白及其磷酸化的表达,旨在探讨有氧运动对高脂饮食诱导IR发生中的作用及潜在分子机制。
2 材料和方法
2.1 实验动物
实验选用80只、4周龄雄性C57BL/6小鼠,平均体重为14.8 ± 0.39 g, 购于军事医学科学院实验动物中心。将小鼠随机分笼饲养,自由进食饮水,光照12小时/天,动物室室温为20~25°C,湿度为30%~40%。
2.2 IR 动物模型建立
1周适应性喂养后, 将小鼠随机分为正常对照组(Con组)和胰岛素抵抗模型组(IR组),分别饲以标准饲料和高脂饲料10周。 通过检测小鼠口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)及空腹血清胰岛素(fasting serum insulin, FINs)鉴定模型建立情况。 高脂饲料成分为:蛋白质20% kcal、碳水化合物35% kcal、脂肪45% kcal。
2.3 有氧运动动物模型建立
将已发生IR的小鼠随机分为高脂饮食安静组(HC组)和高脂饮食运动组(HE组),继续喂饲高脂饲料;正常对照组随机分为正常饮食安静(NC组)和正常饮食运动组(NE组),继续喂饲标准饲料。 各运动组进行为期6周75% VO2max有氧跑台运动,60 min/次/天,5次/周。
2.4 OGTT
分别检测高脂饮食10周后及有氧运动6周后小鼠空腹血糖值。首先将小鼠禁食16小时,称量并记录禁食后小鼠体重。 小鼠尾静脉取血微量, 检测空腹血糖值(T0), 随后根据小鼠体重 (10μl/g) 迅速经口腔灌注20%葡萄糖溶液。 分别检测并记录灌注葡萄糖后15、30、60和120 min的血糖值。
2.5 动物血液、骨骼肌和胰腺样本提取
小鼠为期6周有氧跑台实验结束后, 禁食16小时。采用摘取小鼠眼球取血法留取小鼠血液样本, 静置30分钟后,4°C,3000 g/min离心15 分钟,取上层血清。 分离并留取小鼠胰腺组织,浸泡于10%中性甲醛。 随后,迅速分离小鼠小腿腓肠肌液氮速冻后,保存于-80°C冰箱备用。
2.6 FINs
取提取的小鼠血清,选用ELISA法检测10周高脂饮食后及6周有氧运动后小鼠空腹血清胰岛素水平。
2.7 胰岛β细胞形态学观察
将小鼠胰腺组织从10%中性甲醛固定液中取出,流水下冲洗10分钟。 由脱水机进行乙醇梯度脱水过夜,两次浸入二甲苯,每次30分钟,使组织透明。 随后进行石蜡包埋,切片和HE染色。 高倍镜观察胰岛β细胞形态学变化。
2.8 Real-time PCR方法检测小鼠骨骼肌GSK3β和βcatenin mRNA表达
采用Trizol Reagent法提取骨骼肌总RNA。 随后取1μl RNA经由1%的琼脂糖凝胶电泳; 由分光光度计测定提取RNA的浓度和纯度。 以总RNA为模板, 选用SuperScript TMIIIFirst-Strand Synthesis System for RTPCR试剂盒(Invitrogen)合成cDNA 第一链。选用IQ5实时定量PCR仪,以合成的第一链cDNA为模板,进行Realtime PCR反应(引物序列见表1)。取SYBR Green 10 μl,5’ Primer 0.5 μl,3’ Primer 0.5 μl,cDNA 3 μl,ddH2O 6 μl混匀,放入PCR仪中进行扩增。 设置程序为94°C 2分钟,40个循环(94°C 30 s;目的基因退火温度30 s;72°C 1分钟),65°C 30 s, 95°C 30 s。
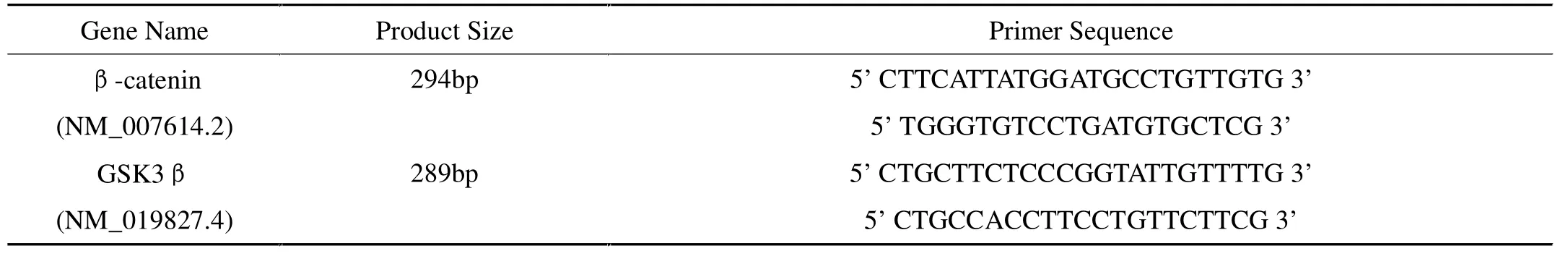
表1 Real-time PCR引物序列
2.9 Western Blot 方 法 检 测 小 鼠 骨 骼 肌GSK3β 和βcatenin蛋白及其磷酸化表达
采用NP-40方法提取小鼠骨骼肌总蛋白质,紫外分光光度计测定蛋白质浓度。 取蛋白80~100 μg 进行聚丙烯酰胺凝胶电泳(SDS-PAGE)。 电泳条件为:60V,30分钟;后110V,2小时。 采用湿法电转印,条件为:4°C,300 mA,2 小时。 转膜结束后,取出PVDF膜,放入5%脱脂奶粉封闭液中封闭1小时, 摇床转速为40 Rpm,后TBST洗涤PVDF膜。用含有5%BSA的抗体稀释液按比例(GSK3β, pGSK3βSer9,β-catenin 和 pβ-cateninSer33/37Thr41抗体分别按1∶3000、1∶2000、1∶4000和1∶2000 稀释)稀释一抗,4°C孵育过夜,TBST洗膜3次,10分钟/次。 用含有5% BSA的抗体稀释液按照1∶10000 的比例稀释二抗, 室温孵育1小时后,TBST洗膜3次,10分钟/次。 加ECL-Plus发光底物,于暗室曝光,胶片显影和定影。 扫描图片后用蛋白质定量分析软件统计。
NP-40裂解液成分为:50 mM/L Tris-base,150 mM/L NaCl, 15 mM/L EDTA, 1% NP-40,PH 8.0。 聚丙烯酰胺凝胶电泳缓冲液组成为:250 mmol/L甘氨酸、25 mmol/L Tris-Base, 0.1% SDS,pH 8.3。转膜缓冲液组成如下:39 mmol/L甘氨酸,48 mmol/L Tris-Base,0.037% SDS,20%甲醇,pH 8.3。
2.10 统计学分析
所有实验数据由SPSS 统计软件 (SPSS11.5 for Windows) 处理。 数据采用单因变量双因素方差(Univariate Analyses of Variance)分析。 各组间差异性检验的显著性水平定为P < 0.05。
3 结果
3.1 OGTT 和FINs
如图1-A所示:与Con组相比,IR组小鼠血糖峰值明显升高,峰值出现时间点明显后移,且峰值后血糖恢复速度显著下降,并且120 min 时仍不能恢复至血糖基础水平。
如图1-B所示:HC组与NC组相比, 血糖峰值明显升高,峰值时间点明显延迟,且血糖恢复到基础水平的速度明显下降(尤其是30~60 min时间段),并且在120 min时仍不能恢复至正常水平。HE组与HC组相比,血糖峰值明显下降,峰值时间点前移,且在峰值出现后血糖恢复到基础水平的速度明显增加。 NE组与NC组相比,虽然血糖峰值以及峰值时间点无显著变化, 但在15~30 min时间段,NE组小鼠血糖恢复至基础水平的速度增加。
如图1-C所示:IR组FIN较其对照组显著性增加了52.7%(P < 0.05)。
如图1-D及统计结果 (数据未列出) 所示:HC组FINs较NC组显著增加44.40%(P < 0.01);HE组FINs较HC组显著降低20.80%(P < 0.05)。
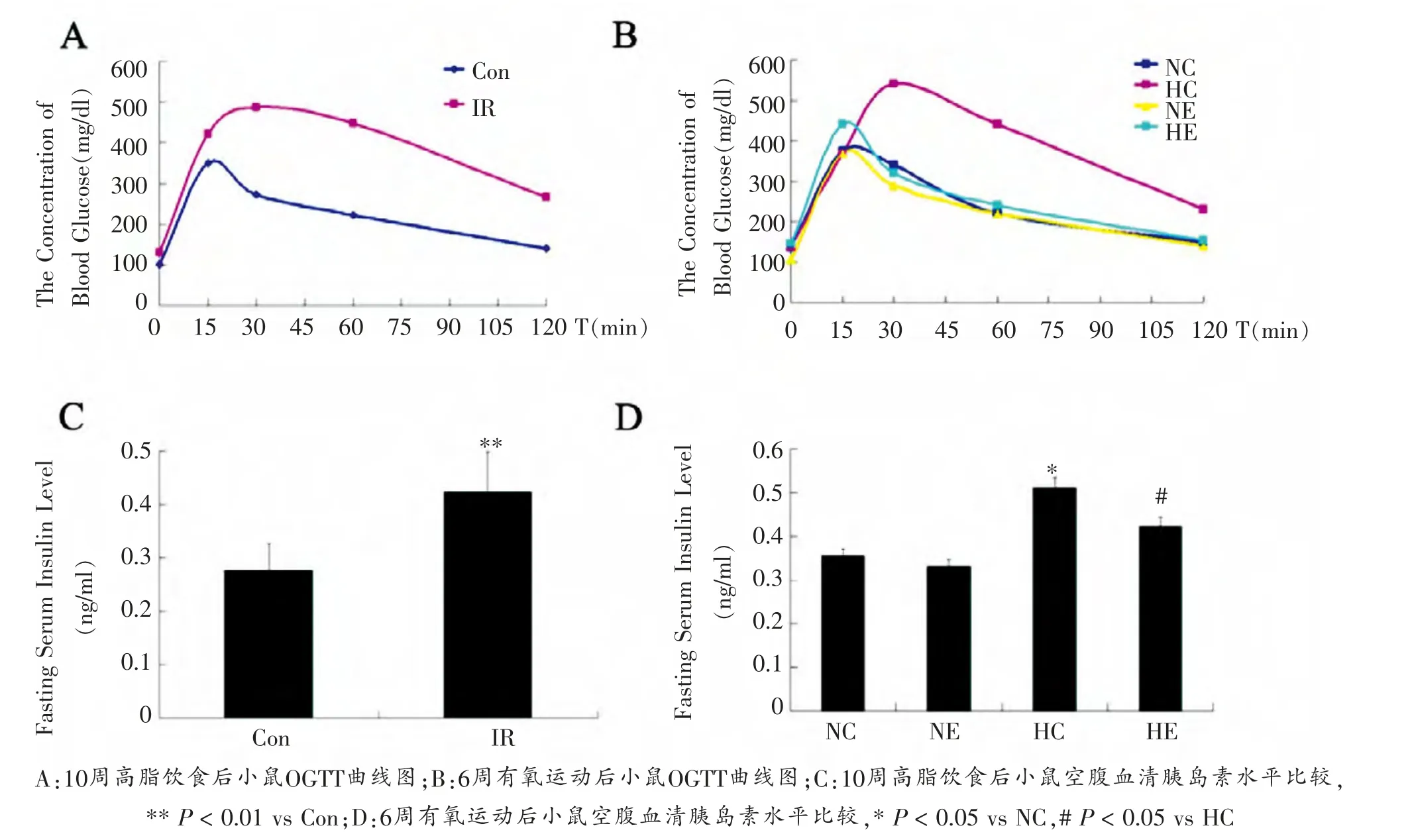
图1 各组小鼠OGTT和FINs比较
3.2 胰岛β细胞形态学变化
高倍镜下观察各组动物胰岛β细胞团面积及形态变化, 如图2所示:HC组小鼠胰岛β细胞团面积较NC组显著增加,且细胞团边缘模糊,界限不清,伴有炎症浸润发生; 而HE组小鼠胰岛β细胞团面积较HC组显著减小,炎症浸润症状减缓。
3.3 小鼠骨骼肌GSK3β mRNA表达和GSK3β蛋白及其磷酸化表达
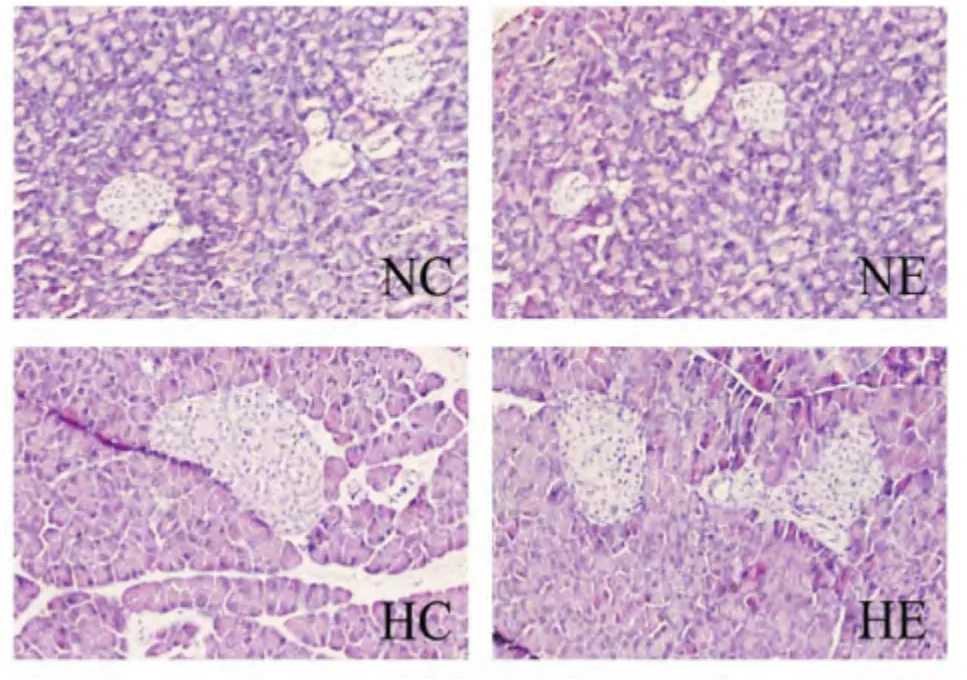
图2 胰岛β细胞团面积及形态比较(40 ×)
骨骼肌组织GSK3β mRNA、 蛋白表达及pGSK3 βSer9蛋白表达如图3、图4所示:
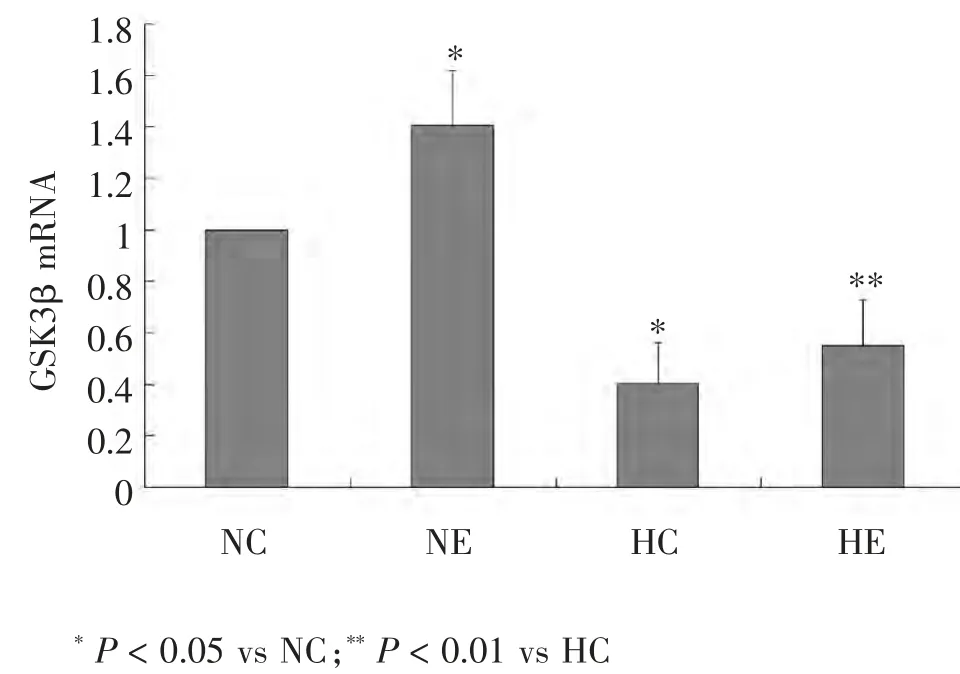
图3 各组小鼠骨骼肌GSK3β mRNA水平比较
骨骼肌细胞GSK3β mRNA结果(图3)显示:NE组较NC组GSK3β mRNA表达增加40.00% (P < 0.05);HE组较HC组GSK3β mRNA表达增加37.5%(P < 0.01);而HC组较NC组小鼠骨骼肌GSK3β mRNA表达显著下降60%(P < 0.05)。

图4 各组小鼠骨骼肌GSK3β蛋白和pGSK3βSer9蛋白磷酸化水平比较
骨骼肌GSK3β蛋白表达统计结果(图4-A)显示:饮食和运动两个主效应以及其交互作用对GSK3β蛋白表达均无显著性影响。NE组较NC组、HE组较HC组GSK3β蛋白表达分别增加36.11%、16.60%, 但无显著性差异(数据未列出)。 HC组较NC组GSK3β蛋白表达降低69.30%,亦无显著性差异。而骨骼肌pGSK3βSer9蛋白表达结果(图4-B)显示:饮食和运动两个主效应及其交互作用对pGSK3βSer9蛋白表达均有显著性影响, 且与其mRNA表达趋势一致。 运动主效应分析显示:NE组和HE组pGSK3βSer9蛋白表达较其安静对照组分别增加20.01%(P < 0.05)、7.60%(P < 0.01); 饮食主效应分析显示: 与NC组相比,HC组pGSK3βSer9蛋白表达降低1.19%(P < 0.05)。
3.4 小鼠骨骼肌β-catenin mRNA表达和β-catenin蛋白及其磷酸化表达
小鼠骨骼肌组织β-catenin mRNA和蛋白表达及pβ-cateninSer33/37Thr41蛋白表达见图5、图6:
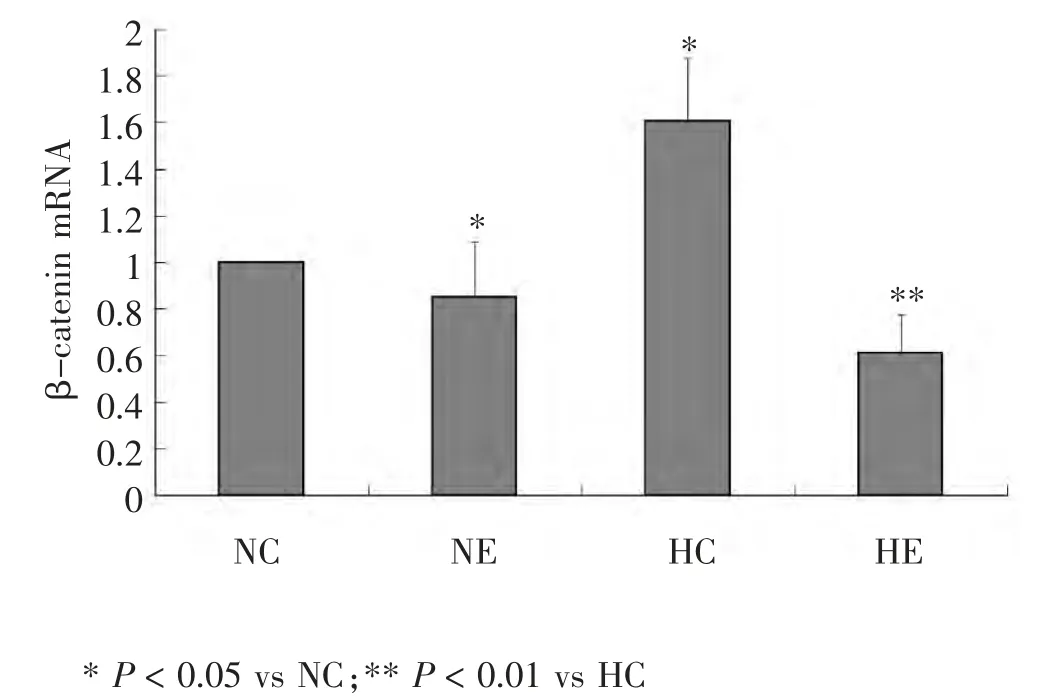
图5 各组小鼠骨骼肌β-catenin mRNA水平比较
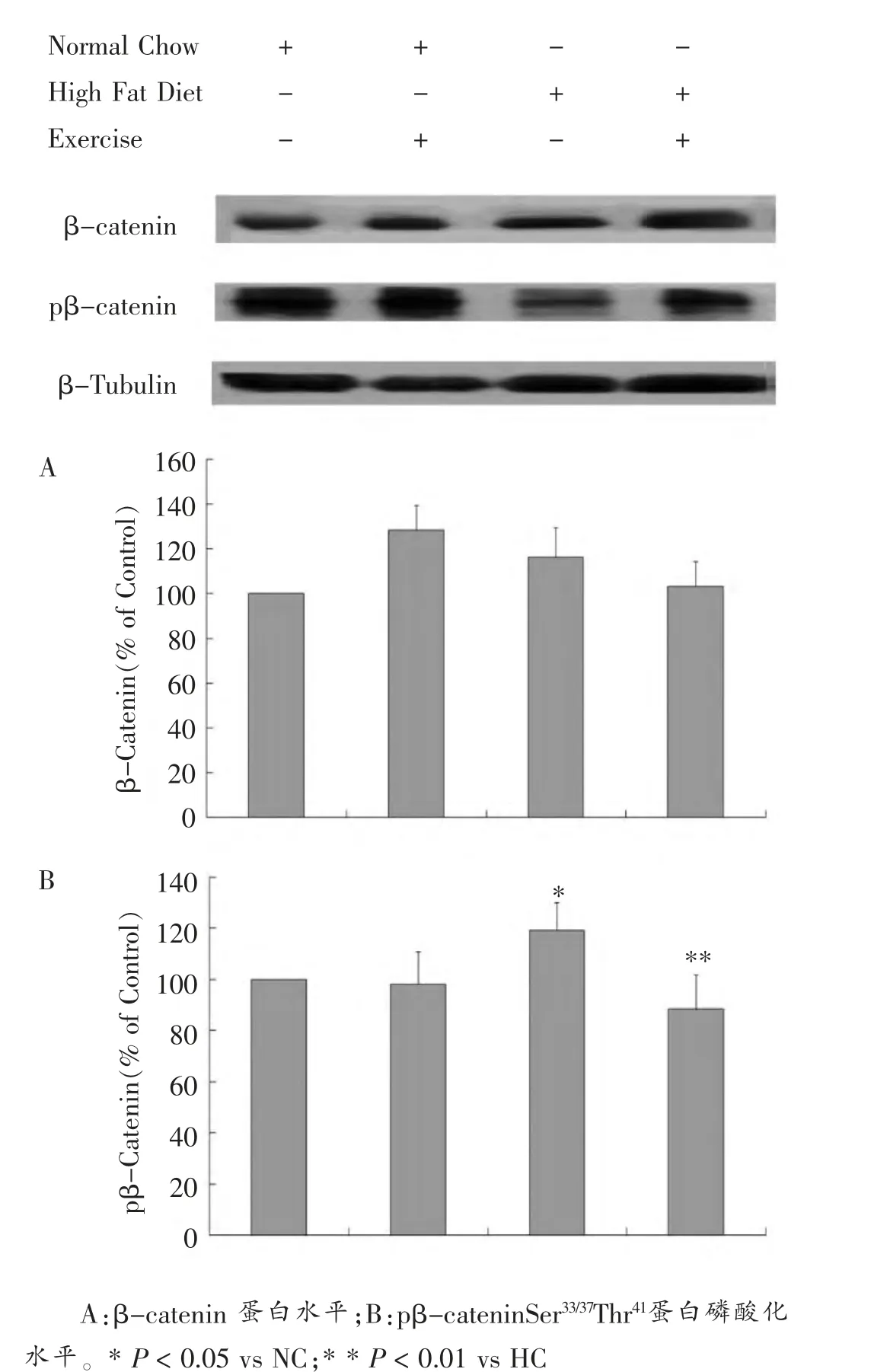
图6 各组小鼠骨骼肌β-catenin 蛋白和pβ-cateninSer33/37Thr41蛋白磷酸化水平比较
骨骼肌细胞β-catenin mRNA结果(图5)显示:NE组 较NC 组β-catenin mRNA 表 达 降 低15.00%(P <0.05);HE组较HC组β-catenin mRNA表达降低61.9.0%(P < 0.01); 而比较HC组和NC组小鼠骨骼肌β-catenin mRNA 表达时发现,HC 组表达显著增加60%(P <0.05)。
骨骼肌β-catenin蛋白表达统计结果(图6-A)所示:饮食和运动两个主效应及其交互作用对骨骼肌细胞βcatenin蛋白表达均无显著性影响。 HC组较NC组βcatenin蛋白表达增加16.21%;HE组较HC组β-catenin蛋白表达降低11.10%, 均无统计学差异。 骨骼肌pβcateninSer33/37Thr41蛋白表达结果(图6-B)显示:饮食和运动两个主效应对pβ-cateninSer33/37Thr41蛋白表达有显著性影响, 但其交互作用对pβ-cateninSer33/37Thr41蛋白无显著影响,与其mRNA表达趋势一致。 饮食主效应分析显示:HC组与NC组相比,pβ-cateninSer33/37Thr41蛋白表达增加19.23%(P < 0.05)。 运动主效应分析显示:与其安静对照组比较,HE组pβ-cateninSer33/37Thr41蛋白表达降低25.8%(P < 0.01)。
4 讨论
4.1 Wnt信号通路与高脂饮食诱导IR发生的关系
Wnt信号传导通路参与机体细胞的生长、 增殖、分化、移动和细胞极性等过程[12],该通路失调时可诱发多种癌症以及糖脂代谢的紊乱。 近年来研究发现该通路的异常与肥胖、IR和T2DM等代谢性疾病的发生密切相关[5,13]。
研究发现激活状态下的Wnt 信号通路可通过抑制转录因子(C/EBPα)和过氧化物酶体增生物激活受体γ(Peroxisome Proliferator-activated Receptor γ, PPARγ)的表达而抑制小鼠脂肪前体细胞分化为脂肪细胞[14]。另外,Wnts对胰岛β细胞的形态和功能有重要调节作用,Wnt诱导葡萄糖刺激胰岛素分泌和胰岛β细胞的增殖[15]。 经典Wnt信号通路可调节胰高血糖素基因转录过程,增加GLP-1表达,从而直接促进胰岛β细胞增殖而减少其凋亡[16]。
人类遗传学研究发现Wnt10b基因突变而导致功能缺失的杂合子与肥胖发生有密切关系[17],同样,LRP5基因的两个单核苷酸多态性(Single Nucleotide Polymorphisms, SNPs)也与肥胖有关[18]。 多个研究证实Wnt通路中转录因子7类似物2 (Transcription Factor 7-Like 2,TCF7L2)编码基因的多态性增加了人群对T2DM的易感性[19-22]。 而完全敲除TCF7L2基因的小鼠,出生后短时间内即死亡, 尸检发现其小肠绒毛间小囊缺少增生性小室,表明肠内L细胞分泌GLP-1的功能受损[23],导致胞内GLP-1对Wnt信号通路的负反馈调节异常, 影响胰岛β细胞的生理功能[24]。
近年多个研究发现Wnt信号通路关键信号蛋白GSK3β和β-catenin与IR发生密切相关。研究发现胰岛β细胞基因GSK3β敲除(β-GSK-3β-/-)的小鼠可通过改善机体糖耐受能力及促进β细胞增殖而抵抗高脂饮食诱导的IR[9,25],而对骨骼肌细胞,GSK3β蛋白过表达的转基因雄性小鼠的一项研究发现GSK3β蛋白过高表达可导致小鼠糖耐量受损, 这与由IR导致T2DM的患者机体GSK3β蛋白表达水平升高是一致的[26]。且最近有研究表明GSK3作为胰岛素受体的下游信号分子之一,在胰岛素信号传导过程中发挥着负调控作用, 其抑制剂(CT 99021和CT 20026) 在治疗IR及T2DM等代谢性疾病中发挥着重要作用。 Ye等采用RNA干扰技术沉默βcatenin时, 发现β-catenin作为PI3-Akt-GSK3β信号通路一个重要的下游信号分子,可调控机体血清IGF-1生理功能,与IR和T2DM的发生密切相关[27]。 本实验通过小鼠高脂饮食10周建立IR动物模型。 与Con组小鼠相比,IR组小鼠的OGTT、FINs 及胰岛β细胞形态学结果显示,10周高脂饮食可成功诱导小鼠IR发生。 本实验结果显示发生IR的小鼠骨骼肌GSK3β基因和GSK3βSer9蛋白磷酸化表达下调, 而β-catenin基因、 β-catenin-Ser33/37和β-catenin Thr41蛋白磷酸化表达上调。
综上,Wnt信号通路及其信号传导通路的多个信号分子 (如Wnt10b、LRP5、TCF7L2、GSK3β 和β-catenin)在胰岛素信号传导及调控中发挥重要作用, 与IR的发生密切相关。
4.2 Wnt信号通路与有氧运动改善IR的关系
运动调控机体骨骼肌组织的多个代谢和转录过程,既可以引起基因转录过程的短时变化,也可以使蛋白质代谢率发生长期适应性变化, 因此在IR等代谢性疾病的预防及治疗中发挥重要作用, 但其中的分子机制尚不完全清楚。 本实验6周有氧运动干预后,OGTT、FINs及胰岛β细胞形态学结果显示:6周有氧运动可显著增强机体葡萄糖代谢能力,提高机体胰岛素敏感性,部分逆转长期高脂饮食诱导的机体糖耐量受损状况,改善IR症状。 小鼠骨骼肌基因及蛋白表达结果显示:相较HC组小鼠,HE组小鼠骨骼肌GSK3β基因和GSK3β-Ser9蛋 白 磷 酸 化 表 达 增 加, 而β-catenin 基 因、 βcatenin-Ser33/37和β-catenin-Thr41蛋白磷酸化表达降低。提示有氧运动可能通过激活Wnt信号通路及影响该通路的关键信号分子表达而抑制和改善高脂饮食诱导的IR发生。
GSK3β是Wnt信号通路上的一个重要信号分子,当GSK3β被蛋白激酶B(PKB/Akt)激活后可使下游信号分子β-catenin发生磷酸化。 β-catenin调控细胞骨架及黏附生理过程,在骨的形成和发育过程中发挥重要作用。由此推测运动或机械力刺激可能对GSK3β和β-catenin的表达具有调控作用。 目前,运动对组织细胞GSK3β和β-catenin的表达及活性影响尚存争议。 出现不同实验结果的原因还不清楚, 推测可能与实验所采用的运动强度、 运动方式、 运动时间及选用动物种属等因素有关。 研究发现人类骨骼肌的收缩活动可调节GSK3和βcatenin分子的生物活性。 当以75%和125%的最大负荷运动时, 股外侧骨骼肌细胞GSK3α上Ser21位点的磷酸化水平升高,其活性均降低了30%,而GSK3β的活性却无明显变化, 推测运动可能部分影响GSK3蛋白的活性;而β-catenin在Ser33/37及Thr41位点的磷酸化水平降低并伴随活性下降50%~60%[11]。 但Wojtaszewski等研究发现,50%和75%最大负荷的运动可使GSK3α活性增强[28]。还有研究表明运动并不能引起GSK3α在Ser21位点发生磷酸化,仅增加了GSK3β在Ser9位点的磷酸化水平,且对其活性无影响[29]。 另有研究发现,在一次极限运动时, 不论是红肌纤维还是白肌纤维,β-catenin在Ser33/37及Thr41位点均发生完全去磷酸化; 且其去磷酸化程度随着运动强度增大升高,活性也显著增加,但与运动时间无密切关联[9]。提示β-catenin的磷酸化与运动时骨骼肌消耗糖原高度相关, 而糖原的消耗量正是评价运动强度的一个指标。 还有研究发现,受试者接受为期8周力量运动训练及力量-速度运动训练后, 只有力量-速度运动训练组受试者的骨骼肌细胞β-catenin蛋白表达量上调,而力量运动训练组未出现显著变化[30]。 Baltgalvis等选用Apc(Min/+)小鼠进行有氧运动,发现运动组小鼠息肉组织内β-catenin的磷酸化水平较其对照组升高3.3倍, 证明有氧运动可抑制机体肠息肉细胞肿瘤的发生[31]。
本研究发现长期有氧运动可改变小鼠骨骼肌组织GSK3β和β-catenin基因及蛋白磷酸化表达水平, 显著激活Wnt信号传导通路。 而激活的Wnt信号通路可抑制脂肪的形成及促进胰岛β细胞的增殖,调控机体糖脂代谢等。 这可能是信号分子GSK3β和β-catenin通过有氧运动改善IR的分子机制之一。
此外,Wnt信号通路可与细胞内多个胰岛素信号通路发生相互作用, 而信号分子GSK3β和β-catenin作为诸多通路“交叉点”发挥生理效能。研究发现Wnt可以激活哺乳动物雷帕霉素靶蛋白 (Mammalian Target of Rapamycin,mTOR)信号通路而促进机体蛋白翻译和细胞生长。 一磷酸腺苷活化蛋白激酶 (AMP-activated Protein Kinase, AMPK)和GSK3作用于结节性硬化复合物蛋白2(Tuberous Sclerosis Complex 2, TSC2),使其发生磷酸化[32]。 有研究认为长期有氧运动可以抑制细胞mTOR信号通路活性, 抑制mTOR及其下游信号分子核糖体S6激酶1(S6K1)的表达,通过显著上调过氧化物酶体增殖物激活受体γ辅助激活因子α(PGC-1α)的表达而提高细胞线粒体能量代谢, 增强组织细胞对胰岛素的敏感性,从而改善机体IR[33,34]。 本实验同组人员检测小鼠6周有氧运动后骨骼肌细胞mTOR及S6K1的表达变化,发现与上述研究结果一致。 近年多项研究已证实有氧运动激活AMPK信号通路可改善机体IR症状[35,36]。 另有研究认为GSK3抑制胰岛素效能的途径可能有以下两种:(1)通过磷酸化糖原合酶抑制其活性;(2)通过磷酸化胰岛素受体1 (Insulin Receptor Substrate-1, IRS-1)使其降解,从而减少与胰岛素受体的相互作用,并抑制葡萄糖的转运[11]。 GSK3也是经典胰岛素信号通路磷脂酰肌醇-3激酶/蛋白激酶B (PI3K/PKB) 的下游信号分子, 而近年来研究已证实有氧运动可通过该通路提高机体胰岛素敏感性,预防和治疗IR[37,38]。因此Wnt信号分子GSK3β和β-catenin可能通过与多个胰岛素信号通路的交互作用发挥生理功能, 这可能是它们通过有氧运动改善IR的另一种分子机制。
5 结论
6周有氧运动可增加小鼠骨骼肌组织GSK3β基因和GSK3β-Ser9蛋白磷酸化表达, 降低其下游信号βcatenin基因和β-catenin-Ser33/37、β-catenin-Thr41蛋白磷酸化表达。表明有氧运动可调控Wnt通路关键信号分子的表达,显著性激活此通路,从而发挥其抑制机体脂肪细胞生成,促进胰岛β细胞的增殖等生理功能,部分缓解高脂饮食诱导的IR。 本研究结果为有氧运动提高机体胰岛素敏感性而改善IR分子生物学机制研究及临床治疗代谢性疾病提供理论依据。
[1] BoucherJ,KleinriddersA,KahnCR.Insulin receptor signaling in normal and insulin-resistant states.Cold Spring Harb Perspect Biol, 2014, 6(1). doi: 10.1101/cshperspect.a009191.
[2] de Assis AM, Rieger DK, Longoni A, et al. High fat and highly thermolyzed fat diets promote insulin resistance and increase DNA damage in rats. Exp Biol Med,2009,234(11):1296-1304.
[3] Cui J, Bai Y, Li M, et al. Effects of different intensity exercise on blood glucose, adolescent obesity rats insulin sensitivity and RBP4. Wei Sheng Yan Jiu,2014, 43(4):535-540.
[4] Hawley JA, Lessard SJ. Exercise training-induced improvements in insulin action. Acta Physiol (Oxf),2008, 192(1):127-135.
[5] Colaianni G, Brunetti G, Faienza MF. Osteoporosis and obesity: Role of Wnt pathway in human and murine models.World J Orthop,2014, 5(3):242-246.
[6] Tian F, Zhang YJ, Li Y, et al. Celecoxib ameliorates nonalcoholic steatohepatitis in type 2 diabetic rats via suppression of the non -canonical Wnt signaling pathway expression. PLoS One,2014, 9 (1):e83819. doi: 10.1371/journal.pone
[7] Schinner S. Wnt -signaling and the Metabolic Syndrome.Horm Metab Res,2009, 41(2): 159-163.
[8] Kim MH, Jee JH, Park S, et al. Metformin enhances glucagon-like peptide 1 via cooperation between insulin and Wnt signaling. J Endocrinol,2014, 220(2):117-128.
[9] Liu Y, Tanabe K, Baronnier D, et al. Conditional ablation of Gsk-3β in islet beta cells results in expanded mass and resistance to fat feeding -induced diabetes in mice.Diabetologia,2010, 53(12):2600-2610.
[10] Zhong QL, Liu FR, Liu DW, et al. Expression of β-catenin and cyclin D1 in epidermal stemcells of diabetic rats. Mol Med Report,2011, 4(2):377-381.
[11] Pearce NJ, Arch JR, Clapham JC, et al. Development of Glucose Intolerance in Male Transgenic Mice Overexpressing Human Glycogen Synthase Kinase-3β on a Muscle-Specific Promoter. Metabolism,2004, 53(10):1322-1330.
[12] Lien WH, Fuchs E. Wnt some lose some: transcriptional governance of stem cells by Wnt/β-catenin signaling. Genes Dev,2014, 28(14):1517-1532.
[13] Christodoulides C, Lagathu C, Sethi JK, et al. Adipogenesis and WNT signalling. Trends Endocrinol Metab,2009, 20(1):16-24.
[14] Kim MB, Song Y, Kim C, et al. Kirenol inhibits adipogenesis through activation of the Wnt/β-catenin signaling pathway in 3T3-L1 adipocytes. Biochem Biophys Res Commun,2014,445(2):433-438.
[15] Fujimoto WY. The importance of insulin resistance in the pathogenesis of type 2 diabetes mellitus. Am J Med,2000,108 Suppl 6a:9S-14S.
[16] Xiong X, Shao W, Jin T. New insight into the mechanisms underlying the function of the incretin hormone glucagon-like peptide-1 in pancreatic β-cells: the involvement of the Wnt signaling pathway effector β-catenin. Islets,2012, 4 (6):359-365.
[17] Wend P, Wend K, Krum SA, et al. The role of WNT10B in physiology and disease. Acta Physiol (Oxf),2012, 204(1):34-51.
[18] Joiner DM, Ke J, Zhong Z, et al. LRP5 and LRP6 in development and disease. Trends Endocrinol Metab,2013, 24(1):31-39.
[19] Le Bacquer O, Shu L, Marchand M, et al. TCF7L2 splice variants have distinct effects on beta -cell turnover and function. Hum Mol Genet,2011, 20(10):1906-1915.
[20] Uma Jyothi K, Jayaraj M, Subburaj KS, et al. Association of TCF7L2 gene polymorphisms with T2DM in the population of Hyderabad, India. PLoS One,2013, 8(4):e60212. doi: 10.1371/ journal. pone.0060212.
[21] Hussain H,Ramachandran V,Ravi S,et al. TCF7L2 rs 7903146 polymorphism and diabetic nephropathy association is not independent of type 2 diabetes-a study in a south Indian population and meta-analysis. Endokrynol Pol,2014, 65(4):298-305.
[22] Shokouhi S, Delpisheh A, Haghani K, et al. Association of rs7903146, rs12255372, and rs290487 polymorphisms in TCF7L2 gene with type 2 diabetes in an Iranian Kurdish ethnic group. Clin Lab,2014, 60(8):1269-1276.
[23] Korinek V, Barker N, Moerer P, et al. Depletion of epithelial stem-cell compartments in the small intestine of mice lacking Tcf-4. Nat Genet,1998, 19(4):379-383.
[24] Yi F, Brubaker PL, Jin T. TCF-4 mediates cell type-specific regulation of proglucagon gene expression by beta-catenin and glycogen synthase kinase-3 beta. J Biol Chem,2005, 280(2): 1457-1464.
[25] Zahoor M, Cha PH, Choi KY. Indirubin -3’ -oxime, an activator of Wnt/β-catenin signaling, enhances osteogenic commitment of ST2 cells and restores bone loss in high-fat diet-induced obese male mice. Bone,2014, 65:60-68.
[26] Zhang T, Fang M, Fu ZM, et al. Expression of PI3-K, PKB and GSK-3 β in the skeletal muscle tissue of gestational diabetes mellitus. Asian Pac J Trop Med,2014, 7(4):309-312.
[27] Ye P, Hu Q, Liu H Glia, et al. Beta -catenin mediates insulin-like growth factor-I actions to promote cyclin D1 mRNA expression, cell proliferation and survival in oligodendroglial cultures. Glia,2010, 58(9):1031-1041.
[28] Wojtaszewski JF, Nielsen P, Kiens B, et al. Regulation of glycogen synthase kinase-3 in human skeletal muscle: effects of food intake and bicycle exercise. Diabetes,2001, 50(2):265-269.
[29] Markuns JF, Wojtaszewski JF, Goodyear LJ. Insulin and exercise decrease glycogen synthase kinase -3 activity by different mechanisms in rat skeletal muscle. J Biol Chem,1999, 274 (35):24896-24900.
[30] Leal ML, Lamas L, Aoki MS, et al. Effect of different resistance-training regimens on the WNT-signaling pathway.Eur J Appl Physiol,2011, 111(10):2535-2545.
[31] Baltgalvis KA, Berger FG, Pena MM, et al. Effect of exercise on biological pathways in ApcMin/+ mouse intestinal polyps.J Appl Physiol,2008, 104(4):1137-1143.
[32] Inoki K, Ouyang H, Zhu T, et al. TSC2 Integrates Wnt and Energy Signals via a Coordinated Phosphorylation by AMPK and GSK3 to Regulate Cell Growth. Cell,2006, 126 (5): 955-968.
[33] Ogasawara R, Sato K, Matsutani K, et al. The order of concurrent endurance and resistance exercise modifies mTOR signaling and protein synthesis in rat skeletal muscle. Am J Physiol Endocrinol Metab,2014, 306(10):E1155-1162 .
[34] Cunningham JT, Rodgers JT, Arlow DH. mTOR controls mitochondrial oxidative function through a YY1 -PGC -1α transcriptional complex. Nature,2007, 450(170):736-741.
[35] Passos MC, Goncalves MC. Regulation of insulin sensitivity by adiponectin and its receptors in response to physical exercise. Horm Metab Res,2014, 46(9):603-608.
[36] Li L, Li ZJ. Progress on relationship between exercise improving insulin resistance and AMP -activated protein kinase. Sheng Li Xue Bao,2014, 66(2):231-240.
[37] Hamilton DL, Philp A, MacKenzie MG, et al. A limited role for PI (3,4,5) P3 regulation in controlling skeletal muscle mass in response to resistance exercise. PLoS One,2010, 5(7):e11624. doi: 10.1371/journal.pone.0011624.
[38] Weeks KL, Gao X, Du XJ, et al. Regulator of exerciseinduced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circ Heart Fail,2012, 5(4):523-534.
