半月板碎片来源间充质干细胞样细胞的分离培养及多向分化潜能
2015-04-15付维力陈刚李棋唐新李箭
付维力 陈刚 李棋 唐新 李箭
四川大学华西医院骨科(成都610041)
半月板损伤后的治疗一直是骨科及运动医学基础研究和临床实践面临的难题。 目前临床针对半月板损伤的处理手段大体包括半月板切除、缝合修复、重建三个方面。 半月板部分或全部切除都将导致膝关节不稳,继而出现逐渐进展的关节退变[1]。临床上采用缝合修复的指征也相当有限, 仅适用于一些单一纵裂的新鲜损伤类型[2]。尽管同种异体半月板移植被认为是半月板缺损或切除后治疗的金标准, 但长期的随访及组织学结果显示仅有表浅部位少量的宿主细胞长入, 再者供体来源不足、组织处理及保存技术、半月板大小的匹配、手术固定技术以及半月板组织存活的细胞分子研究极大地限制其进一步的临床应用[3]。
有研究发现半月板组织尤其是有血供区的损伤存在一定的自我修复能力[4]。 因此,我们提出假说半月板碎片组织中存在间充质干细胞 (mesenchymal stem cells, MSC)样细胞,这些细胞参与半月板损伤的病理生理和损伤后的修复过程。 本研究采用胶原酶消化的方法分离半月板碎片组织的单核细胞, 并探索其多向分化潜能, 为半月板种子细胞的筛选及再生提供参考。
1 材料与方法
1.1 半月板碎片的取材
本研究通过四川大学华西医院伦理委员会批准。半月板碎片取自3例在关节镜下行半月板部分切除的确诊为半月板损伤的患者, 年龄分别为25岁、32岁、47岁。 通过患者的临床表现、MRI和关节镜下的阳性发现综合判断确诊为半月板损伤。 在关节镜下用髓核钳取出半月板碎片,置于含有双抗的PBS中。
1.2 半月板碎片来源MSC样细胞的分离培养
在显微镜下切除带血管的组织、 周围附着的滑膜和韧带,用含有双抗的PBS漂洗3次。用眼科剪将取材的半月板碎片剪成约1~5 mm3大小的组织碎块, 然后在0.2%I型和II型混合胶原酶中振荡消化4~6 h。 经显微镜观察,大部分细胞消化下来后用巴氏吸管吹打3min,加入细胞悬液等体积的含10%FBS的低糖DMEM新鲜培养基终止消化, 用200目筛网过滤消化后的细胞悬液,1200 rpm离心5 min,弃上清,PBS洗涤3次,显微镜下细胞计数后细胞按1×106/瓶(25 cm2培养瓶)重悬于完全培养基(低糖DMEM,10% FBS,3.7 g/L NaHCO3,100 U/ml青霉素,100μg/ ml链霉素,25 ng/ml两性霉素B,2 mM L-谷氨酰胺)中,置于37℃含5%CO2和95%湿度的培养箱中孵育。 隔日倒置相差显微镜下观察细胞形态变化和生长情况。 2~3天后弃去非贴壁细胞和细胞碎片,更换新的完全培养基。此后每3天换液1次。细胞达到80%~90%融合,用0.25%胰酶/0.1%EDTA按1:2或1:3的比例消化传代。 收集第3代细胞用于后面的实验。
1.3 半月板碎片来源MSC样细胞的多向分化潜能
通过成骨、 成脂和成软骨三系分化来评价半月板碎片来源MSC样细胞的多向分化潜能。
成骨分化:取生长良好的第3代半月板碎片来源的MSC样细胞,以3×103/cm2的密度接种于6孔板中,24 h后弃去培养基, 加入2 ml成骨诱导液 (高糖DMEM,10%FBS,0.1 μM地塞米松,10 mMβ-甘油磷酸钠,50 μM抗坏血酸,2 mM L-谷氨酰胺,1%双抗)。 每3天换液1次,诱导2周。 采用茜素红染色和ALP染色评估成骨矿化和早期特异成骨基质的分泌情况。
成脂分化:取生长良好的第3代半月板碎片来源的MSC样细胞,以3×103/cm2的密度接种于6孔板中,24 h后弃去培养基, 加入2 ml成脂诱导液 (高糖DMEM,10%FBS,1 μM地塞米松,0.5 mMIBMX,10 g/ml胰岛素,100 mM吲哚美辛,2 mM L-谷氨酰胺,1%双抗),3天后换成成脂维持液 (高糖DMEM,10%FBS,10 g/ml胰岛素,2 mM L-谷氨酰胺,1%双抗),24 h后再换成成脂诱导液,如此循环,直到2周。采用油红O染色评估细胞质内脂滴形成情况。
成软骨分化: 采用三维细胞微团和无血清培养体系评价半月板碎片来源的MSC样细胞的成软骨能力。收集1×106生长良好的第3代半月板碎片来源的MSC样细胞, 在15 ml的聚丙烯锥形离心管中悬于1 ml成软骨诱导液[100×ITS(6.25 μg/ml胰岛素,6.25 μg/ml转铁蛋白,5.35 μg/ml亚麻酸, 6.25 ng/ml牛血清白蛋白,6.25 μg/ml亚硒酸),1mmol/L丙酮酸钠,0.17mmol/L抗坏血酸,0.1 μM 地 塞 米 松,0.35mmol/L 脯 氨 酸,10ng/ml TGFβ3] 中,1500 rpm/min离心10 min, 置于37℃含5%CO2的培养箱中培养,每3天换液1次,直到3周。 行HE、甲苯胺蓝、II型胶原免疫组化染色评估微球大体及软骨特异细胞外基质的分泌情况。
2 结果
2.1 半月板碎片来源MSC样细胞的分离培养
采用混合胶原酶消化的方法分离半月板碎片组织的单核细胞,2~3天后少量原代接种的细胞开始贴壁,由圆形伸展为梭形。原代接种4~6天后分离获得的细胞呈典型的长梭形的成纤维细胞样形态(图1A)。 随着培养时间的延长,细胞迅速生长,显微镜下观察呈一定方向性的漩涡状生长。 10~14天后培养的细胞达到80%~90%融合(图1B), 用0.25%胰酶/0.1%EDTA按1:2或1:3的比例消化传代。 直至第3代细胞形态较为均一(图1C)。
2.2 半月板碎片来源MSC样细胞的多向分化潜能
成骨分化: 分离的半月板碎片来源的细胞在体外成骨诱导条件下,3~7天后细胞生长缓慢、变得稀疏,细胞形态从长梭形变为多边形,可见结节出现。 1~2周结节逐渐变大,并分散均一。 通过ALP染色和茜素红染色评估早期特异成骨基质和矿化钙结节的形成。 体外诱导14天后,ALP和茜素红染色均为阳性(图2),结果显示分离的半月板碎片来源的细胞具备成骨分化潜能。

图1 分离的半月板碎片来源细胞的形态特征(×100)
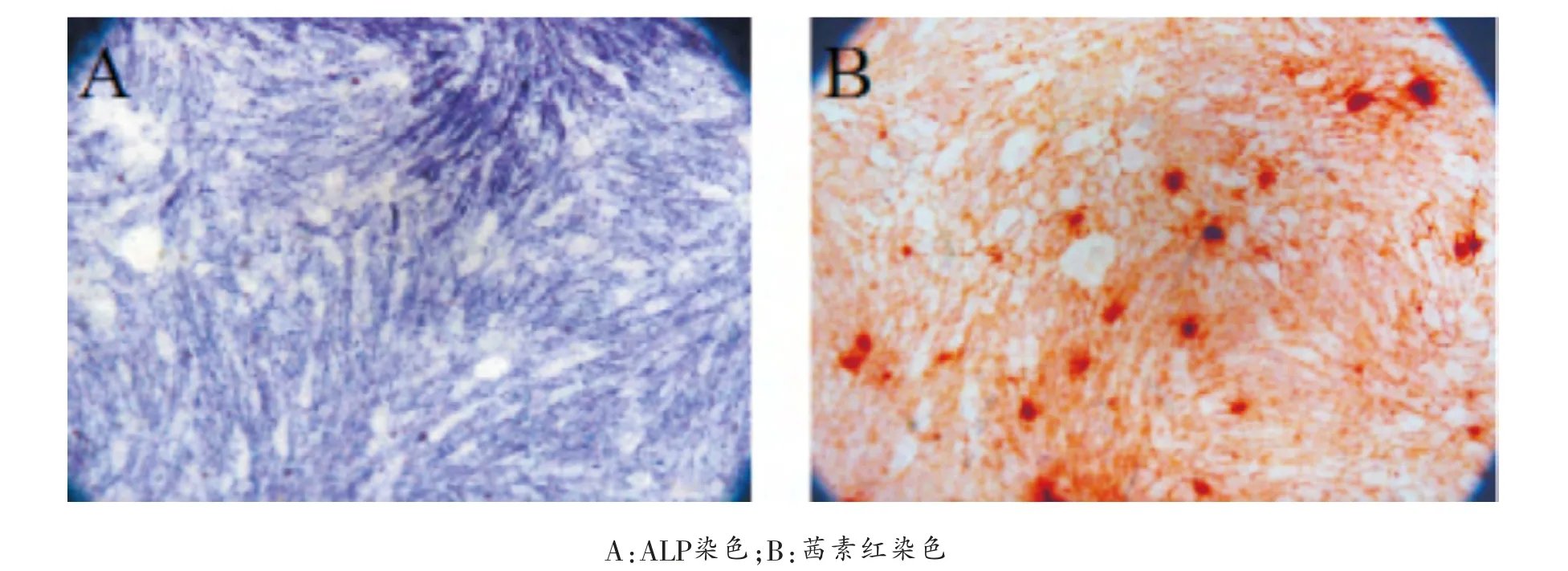
图2 分离的半月板碎片来源细胞的体外成骨分化(×40)
成脂分化: 分离的半月板碎片来源的细胞在体外成脂诱导条件下,5~7天后细胞体积和细胞核逐渐增大,光镜下可见细胞质内透亮的脂滴。 1~2周脂滴逐渐增大增多。 通过油红O染色评估细胞质内脂滴形成情况。 体外诱导14天后,油红O染色为阳性(图3),结果显示分离的半月板碎片来源的细胞具备成脂分化潜能。

图3 分离的半月板碎片来源细胞的体外成脂分化(油红O染色,×400)
成软骨分化: 采用三维细胞微团和无血清培养体系评价半月板碎片来源的MSC样细胞的成软骨能力。在体外成软骨诱导条件下,3天后细胞团块逐渐变为球形, 体外诱导21天后,HE染色显示细胞呈圆形位于三维微团里面,类似软骨组织软骨细胞位于陷窝内。通过甲苯胺蓝和II型胶原免疫组化染色分别显示微团软骨特异性基质蛋白多糖和II型胶原的表达, 染色均为阳性, 结果表明分离的半月板碎片来源的细胞具备成软骨分化潜能(图4)。
3 讨论
本研究中我们采用混合胶原酶消化的方法分离获得的半月板碎片来源的细胞呈典型的长梭形的MSC样细胞形态,在体外适当的诱导条件下具有分化成骨、成脂、成软骨的潜能。有学者研究表明损伤的半月板组织中即使在无血供区域都存在一定的自发的愈合能力[5],这也提示在细胞水平上, 半月板碎片组织可能存在一些干/祖细胞。 我们的研究证实了半月板碎片组织中存在MSC样细胞, 这些细胞可能参与半月板损伤的病理生理和损伤后的修复过程。 半月板碎片组织中MSC样细胞可能来源于周围的滑液或滑膜, 半月板损伤后滑液中的MSC较正常组显著增加[6]。 再者,半月板自身组织可能存在MSC,在损伤或其他病理条件下,这些细胞被激活募集到病变区域参与组织的修复重建过程[7]。另外,半月板钙化也提示MSC存在于半月板组织中。 半月板组织中MSC的来源目前尚不清楚, 其确切的来源和去路还需要进一步研究。
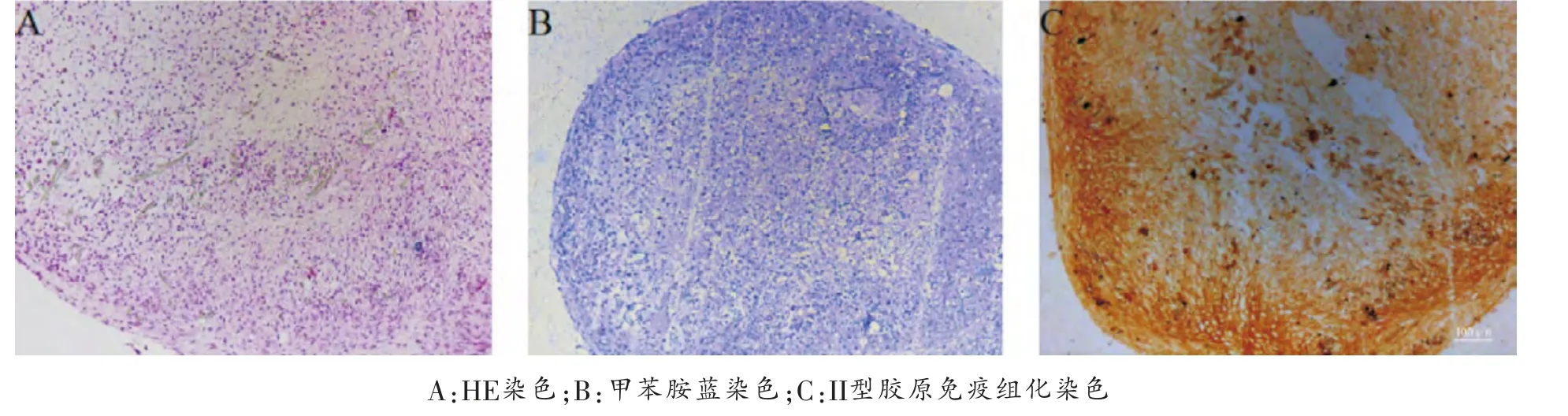
图4 分离的半月板碎片来源细胞的体外成软骨分化(×100)
以种子细胞为基础的组织工程及再生医学策略为半月板的生物学再生带来新的希望[8]。目前用于半月板再生的种子细胞主要分为分化成熟的半月板细胞和MSC[9]。 终末分化成熟的自体半月板细胞来源于损伤的半月板组织, 其来源于自体及确切的半月板细胞表型特征,一直被认为是半月板再生最理想的种子细胞;但是其作为种子细胞也存在一些问题:需要两次手术、病变组织来源的半月板细胞数量非常有限、 且缺乏增殖能力和正常半月板细胞的生物活性等[10]。 中胚层来源的成体MSC因其来源广泛、优良的自我更新、多向分化潜能、免疫调节、定向归巢以及无伦理道德方面争议等优点被广泛用于半月板再生医学领域[11]。 在体内外适当的条件下,MSC能分化为中胚层、甚至内外胚层的组织细胞。 但是,另一方面,MSC在体外培养扩增过程中可能出现转化、衰老或凋亡现象,常伴随细胞增殖能力和分化潜能的下降,逐渐失去其“干性”特点[12]。 再者,间充质干细胞最传统最经典的来源是骨髓, 但其含量非常低(仅占有核细胞的0.01%~0.001%),且存在供区并发症等缺点。 因此开发其他来源的MSC用于半月板的修复重建非常有意义。 尽管目前有很多其他组织如脂肪或滑膜组织等来源MSC用于半月板再生的种子细胞的报道, 但是这些组织来源MSC最大的缺点是其分化为半月板细胞的不确切性,导致修复效果不佳[13]。 半月板碎片来源的组织特异MSC综合半月板细胞的稳定表型和MSC“干性”特征两者的优点,其分化确切,生物活性优良, 是未来半月板再生及其转化医学研究中较为理想的一种种子细胞来源。 激活半月板碎片来源的组织特异MSC参与半月板损伤的修复重建及加速其向临床的转化也是开发半月板碎片原位MSC的意义所在。
本研究中我们采用混合胶原酶消化的方法分离获得的半月板碎片来源的细胞贴壁生长, 呈典型的长梭形的MSC样细胞形态, 在体外适当的诱导条件下具有分化成骨、成脂、成软骨的潜能。
[1] Salata MJ, Gibbs AE, Sekiya JK. A systematic review of clinical outcomes in patients undergoing meniscectomy. Am J Sports Med, 2010, 38(9):1907-16.
[2] Paxton ES, Stock MV, Brophy RH. Meniscal repair versus partial meniscectomy: a systematic review comparing reoperation rates and clinical outcomes. Arthroscopy, 2011, 27(9):1275-88.
[3] Marcacci M, Zaffagnini S, Marcheggiani Muccioli GM, et al.Meniscal allograft transplantation without bone plugs: a 3-year minimum follow-up study. Am J Sports Med, 2012, 40(2):395-403.
[4] Mauck RL, Martinez-Diaz GJ, Yuan X, et al. Regional multilineage differentiation potential of meniscal fibrochondrocytes:implications for meniscus repair. Anat Rec (Hoboken), 2007,290(1):48-58.
[5] Adams Jr SB, Peretti GM, Weinand C, et al. Meniscal repair:current strategies and the future of tissue engineering. Ortho J Harvard Med Sch, 2003, 5:138-41.
[6] Matsukura Y, Muneta T, Tsuji K, et al. Mesenchymal stem cells in synovial fluid increase after meniscus injury. Clin Orthop Relat Res, 2014, 472(3):1049.
[7] Morito T, Muneta T, Hara K, et al. Synovial fluid-derived mesenchymal stem cells increase after intra-articular ligament injury in humans. Rheumatology (Oxford), 2008, 47(8):1137-43.
[8] Hasan J, Fisher J, Ingham E. Current strategies in meniscal regeneration..J Biomed Mater Res B Appl Biomater, 2014,102(3):619-34.
[9] Liu C, Toma IC, Mastrogiacomo M, et al. Meniscus reconstruction: today's achievements and premises for the future.Arch Orthop Trauma Surg, 2013, 133(1):95-109.
[10] Tan GK, Dinnes DLM, Myers PT, et al. Effects of biomimetic surfaces and oxygen tension on redifferentiation of passaged human fibrochondrocytes in 2D and 3D cultures. Biomaterials, 2011, 32(24): 5600-14.
[11] Zellner J, Hierl K, Mueller M, et al. Stem cell-based tissueengineering for treatment of meniscal tears in the avascular zone. J Biomed Mater Res B Appl Biomater, 2013, 101(7):1133-42.
[12] Wang Y, Zhang Z, Chi Y, et al. Long-term cultured mesenchymal stem cells frequently develop genomic mutations but do not undergo malignant transformation. Cell Death Dis,2013, 4:e950.
[13] Scotti C, Hirschmann MT, Antinolfi P, et al. Meniscus Repair and Regeneration: Review on Current Methods and Research Potential. Eur Cells Mater, 2013, 26:150-70.
