骨骼肌微损伤自体修复中超微结构变化与蛋白质组学研究
2015-04-15李可峰王玉站王赵静吕晨曦郑淑倩刘洋葛新发潘卫东李姗姗董贵俊
李可峰 王玉站 王赵静 吕晨曦 郑淑倩 刘洋 葛新发 潘卫东 李姗姗 董贵俊
1 山东体育学院(山东济南250063)
2 中国科学院电工研究所生物医学工程部
3 泰山护理职业学院公共教学部 4 潍坊护理职业学院基础部
离心运动诱发的骨骼肌损伤是骨骼肌微损伤中的常见类型,通常伴有骨骼肌肌力下降、酸痛、收缩范围减小,是影响运动员大强度训练的关键因素之一[1]。 骨骼肌微损伤的症状可以自行缓解并消除, 通常称为自体修复[2]。大强度离心运动导致肌节重塑过程中,自体修复速率与肌细胞细胞器重塑存在一定相关性[3,4],且线粒体的恢复速度先于肌节重建[5,6],并伴随着蛋白质代谢过程、 肌细胞外的炎症过程和工作肌的疼痛过程。 其中,蛋白质代谢在自体修复中起关键作用,降解Z带撕裂产生损伤蛋白,以防止蛋白质合成受到抑制,而其合成过程并未被充分阐明[7]。 重建蛋白质表达时间、种类及强度等需要进一步研究, 以确定骨骼肌微损伤重建修复过程中蛋白质重建过程[8]。在离心运动肌肉收缩过程中,肌细胞能量代谢紊乱,特别是线粒体损伤造成的能量供给减少,是造成骨骼肌微损伤的重要原因[9]。 因此, 探讨微损伤修复过程中损伤组织超微结构变化与蛋白质代谢过程, 对于深入了解微损伤修复机制具有重要意义。本研究采用Wistar大鼠进行一次大强度离心运动, 观察运动后1周内骨骼肌损伤后自体修复过程,通过股四头肌超微结构及蛋白质组代谢动力学变化同步研究, 分析在骨骼肌微损伤修复的不同阶段参与微损伤自体修复的蛋白质类型、表达强度和时间特异性,探讨骨骼肌微损伤自体修复中蛋白质组变异的机制,从而进一步了解微损伤修复过程中蛋白质代谢的差异。
1 材料与方法
1.1 实验分组、运动方案
5 周 龄 雄 性Wistar 大 鼠 [许 可 证 号:SCXK (鲁)20090001],由山东大学实验动物中心提供,在山东体育学院运动人体科学重点实验室动物房饲养, 随机分为安静对照组(D组)、运动后即刻组(0 h组)、运动后24 h组(24 h组)、运动后48 h组(48 h组)、运动后72 h组(72 h组)及运动后168 h组(168 h组),每组6只,共计36只。 D组不进行针对性大强度离心运动, 其余组大鼠一次大强度离心运动方案参照葛新发方法进行[10],跑台下坡跑,坡度-16度,速度18 m/min,运动持续60 min。0 h组、24 h组、48 h组、72 h组、168 h组分别在运动后即刻以及相应时间断头处死,D组与0 h组同时处死。。
1.2 电镜标本制备
取处死大鼠股四头肌并切为直径1 mm左右块状样品, 于3.5%戊二醛中固定过夜, 用0.1 M磷酸缓冲液(pH=7.2)间隔20 min冲洗,共冲洗5次,随后经1%锇酸固定4 h, 再次重复上述冲洗步骤, 乙醇脱水。 采用Epon812树脂对样品进行浸透、包埋、聚合并切片(LKB超薄切片机),3%醋酸铀-柠檬酸铅对样本进行染色。JEM—1200EX透射电子显微镜及成像系统(JEOL,Japan)观察并拍照片,分析不同组别骨骼肌的超微结构[11]。
1.3 蛋白样品制备、电泳
取股四头肌样品200 mg,经蛋白质提取、真空干燥后用Bradford法定量[12],分装,并于-80℃冰箱保存。测定时,样品水化12 h后,在Bio-RAD蛋白质分离系统进行蛋白质电泳分离,胶条为非线性ph4-7胶条,上样量为4 mg蛋白质。 等电聚焦电泳程序步骤:300 V 1 h,600 V 2 h,1000 V 1 h,8000 V 1 h(梯度),8000 V,4 h,500 V,20 h,累计51900 Vh。 SDS-PAGE程序设置:U = 800 V,I = 25 mA per gel,P = 200 W,T = 4:00。 固定40 min,考马斯亮蓝染色50 min,脱色1.5 h。
1.4 双向电泳蛋白质图像分析
采用GS-710光密度仪256色灰度和600 DPI分辨率对考马斯亮蓝染色后的电泳凝胶进行透射扫描。 扫描后利用Imagemaster2D platinumV5.0软件对蛋白质表达谱进行点检测、背景消减,建立平均凝胶后进行匹配、量化获取斑点的相关信息处理。 以D组电泳图谱作参考, 进行特异蛋白质表达量分析并对表达受到激活或者抑制的蛋白质进行进一步质谱鉴定。
1.5 特异蛋白质质谱鉴定及生物信息学分析
利用基质辅助激光解吸电离飞行时间质谱技术对表达量具有显著性差异的蛋白质进行分析, 通过Mascot搜索引擎进行查询相关质谱数据与已有蛋白质匹配情况, 蛋白质信息经NCBI Protein数据库进行查询。 查询参数主要包括:物种来源鼠;胰蛋白质酶水解;酶解片段不完全选择为1;肽片段相对分子质量最大允许误差控制在±0.1Da。
1.6 统计学分析
用ImageMaster 2D Platinum V5.0分析软件检验差异蛋白点相对含量的差别是否有统计学意义。
2 研究结果
2.1 骨骼肌微损伤修复过程中超微结构变化
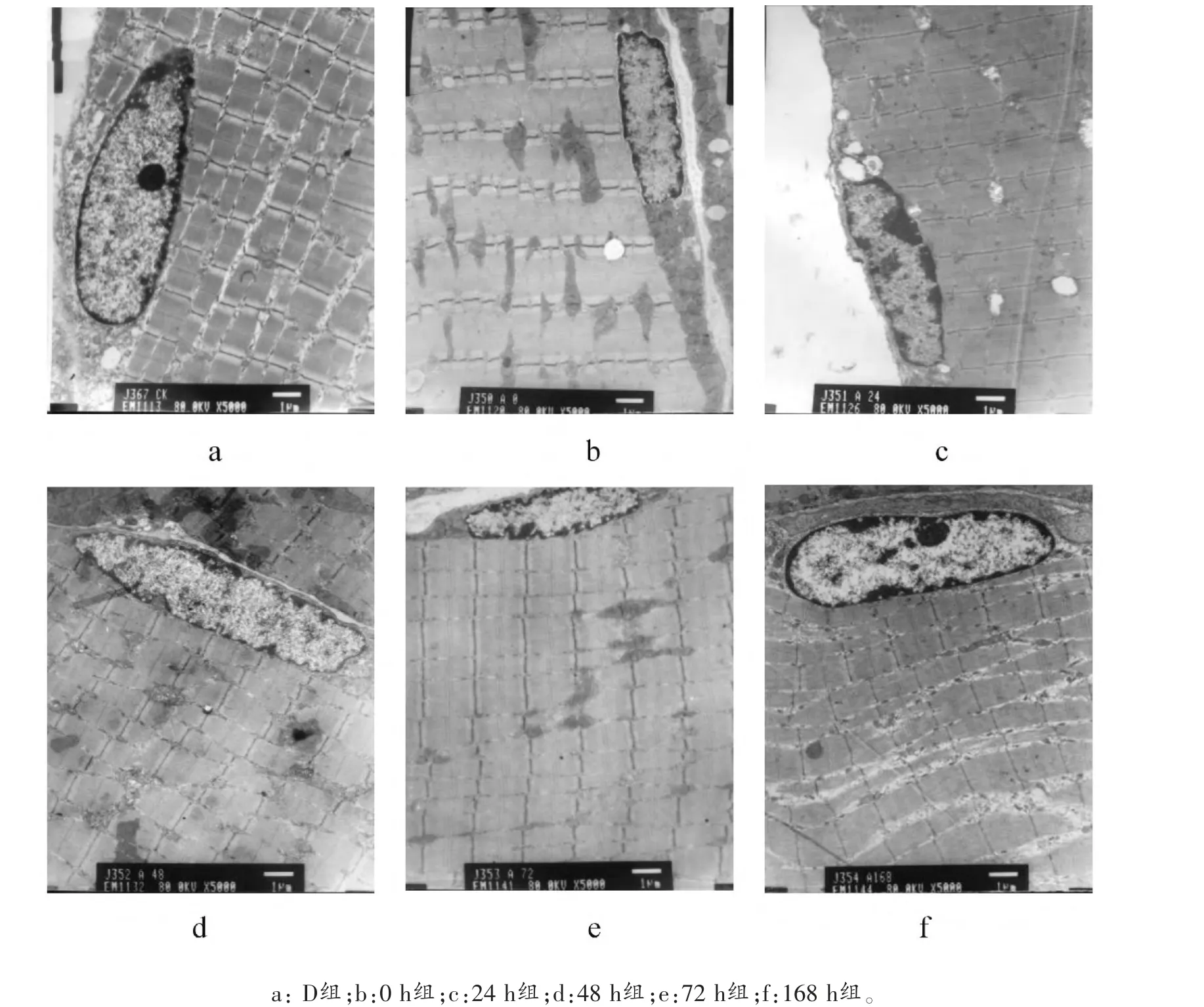
图1 微损伤后大鼠股四头肌超微结构变化(×5000)
对照组在无运动刺激情况下,肌细胞核、肌节、肌纤维、线粒体、内质网清晰(见图1a)。 运动后即刻,大鼠股四头肌肌细胞核及肌节清晰可见, 无明显变化,Z线清晰,基本未发现肌丝溶解;线粒体基本正常,未发现明显肿胀(见图1b)。 运动后24 h,部分肌节紊乱甚至消失,Z线断裂,肌丝溶解;线粒体遭到严重破坏,出现高度水肿,嵴开始溶解,出现空泡化现象,外膜不完整;内质网模糊;细胞膜出现局部溶解现象(见图1c)。 运动后48 h,肌节明显萎缩;线粒体有受损迹象,但其结构逐渐清晰,外膜和嵴已显现(见图1d)。 运动后72 h,I带出现过度收缩现象,肌节清晰,Z线逐渐清晰;线粒体数量基本恢复,但外膜未完全修复(见图1e)。 运动后168 h,细胞核恢复,Z线清晰可见,明暗带分明,肌节清晰;线粒体数量进一步恢复, 线粒体空泡化基本消失 (见图1f)。
2.2 一次大强度离心运动后蛋白质组差异情况
2.2.1 一次大强度离心运动后0 h组蛋白质组差异情况

图2 0 h组大鼠股四头肌双向凝胶电泳图谱
经分析发现一次大强度离心运动后即刻, 大鼠股四头肌蛋白质组表达谱中49种蛋白质出现显著性差异(图2)。 其中,44种蛋白质表达量上调,表观等电点为pH 4.3~6.2,表观分子量为25~64kDa;5种蛋白质表达量下调,表观等电点为pH 4.9~6.0,表观分子量为23~66 kDa。
经质谱鉴定得到22种特异蛋白质信息中 (表1),I类蛋白质4种,其中血色素结合蛋白(hemopexin)、3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase) 及6-磷酸葡糖酸内酯酶 (6-phosphogluconolactonase)3种蛋白质表达上调2.9~24.7倍;3-羟基异丁酸脱氢酶(3-hydroxyisobutyrate dehydrogenase)表达量下调至对照组的0.53倍。 II类蛋白质13种(占特异蛋白质总数的58.3%), 其中维生素D结合蛋白(vitamin Dbinding protein)、膜联蛋白A5(Annexin A5)、α1抗胰蛋白 酶 前 体 (alpha-1-antitrypsin precursor)、DJ-1 蛋 白(Protein DJ-1)、 热 休 克 蛋 白β1 (heat shock protein beta-1)、 着丝粒关联蛋白E (Centromere-associatedprotein E)、α2-HS-糖蛋白(alpha-2-HS-glycoprotein)、乙酰水解酶 (Platelet-activating factor acetylhydrolase IB)及免疫球蛋白λ轻链蛋白质(immunoglobulin lambda light chain) 表达量上调2.0~12.0倍之间;III类蛋白质6种,其中,膜联蛋白A5和Trim 72蛋白(Tripartite motifcontaining protein 72)表达量分别上调2.6倍和4.1倍,核糖体蛋白(39S ribosomal protein)表达量下调至0.32倍;IV类蛋白质2种,包括角蛋白9(keratin 9)。

表1 0 h组与D组特异表达蛋白质信息比较
2.2.2 一次大强度离心运动后24 h组蛋白质组差异情况
一次大强度离心运动后24 h, 大鼠股四头肌蛋白质组表达谱中64种蛋白质出现显著性差异(图3)。其中,39种蛋白质表达量上调, 表观等电点在pH 4.2~6.5,表观分子量在25~110 kDa;25种蛋白质表达量下调,表观等电点在pH4.1~6.8,表观分子量在21~86 kDa。

图3 24 h组大鼠股四头肌双向凝胶电泳图谱

表2 24 h组与D组特异表达蛋白质信息比较
经质谱鉴定得到25种特异蛋白质信息中(表2),I类蛋白质11种,其中辅酶Q9(Coq9 protein)、烟酰胺腺嘌呤二核苷酸脱氢酶(NADH dehydrogenase)、乙酰基转移酶 (acetyltransferase)、 异柠檬酸脱氢酶(isocitrate dehydrogenase)、 磷 酸 甘 油-3 脱 氢 酶 (glycerol-3-phosphate dehydrogenase [NAD(+)])、血色素结合蛋白表达上调2.3~3.9倍, 磷酸丙糖异构酶(Triosephosphate isomerase)、 腺 苷 酸 激 酶 同 工 酶1 (Adenylate kinase isoenzyme 1)、Tpi1蛋白(Tpi1 protein,partial)、磷酸乙醇酸磷酸酶(phosphoglycolate phosphatase)表达量下调至对照组0.32~0.56倍;II类蛋白质10种, 其中蛋白酶体(26S proteasome non-ATPase regulatory subunit 6)、免疫球蛋白λ 轻链、 胞内氯离子通道蛋白1(Chloride intracellular channel protein 1)、 葡 萄 糖 调 节 蛋 白(glucose-regulated protein) 及 磷 酸 酶2C 蛋 白(Ppm2c protein)表达量上调1.9~4.7倍,过氧化物酶体双功能酶(peroxisomal bifunctional enzyme)、 磷酸乙醇酸磷酸酶和乙基丙二酸脑病蛋白 (protein ETHE1)3种蛋白质表达量下调至0.30~0.56倍;III类蛋白质5种,其中,胞内氯离子通道蛋白1表达量上调1.9倍,核糖体蛋白和过氧化物酶体双功能酶表达量下调分别至0.37和0.30倍;IV类蛋白质4种,包括蛋白FAM195B。
2.2.3 一次大强度离心运动后48 h组蛋白质组差异情况

图4 48 h组大鼠股四头肌双向凝胶电泳图谱
一次大强度离心运动后48 h, 大鼠股四头肌蛋白质组表达谱中41种蛋白质出现显著性差异(图4)。其中,33种蛋白质表达量上调,表观等电点在pH4.6~6.8,表观分子量在22~69 kDa;8种蛋白质表达量下调,表观等电点在pH4.9~6.8,表观分子量在20.1~55 kDa。
经质谱鉴定得到16种特异蛋白质信息中(表3),I类蛋白质6种,其中异柠檬酸脱氢酶、血色素结合蛋白、烟酰胺腺嘌呤二核苷酸脱氢酶、 葡萄糖调节蛋白及乙酰基转移酶共5种蛋白质表达上调2.1~3.4倍,腺苷酸激酶同工酶1表达量下调至对照组0.26倍;II类蛋白质7种,其中蛋白酶体β6、 已异戊二烯二羟安息香酸甲基转移酶 (hexaprenyldihydroxybenzoate methyltransferase)、维生素D结合蛋白、 磷酸酶2C蛋白及结合珠蛋白前体(haptoglobin precursor)共5种蛋白质表达量上调2.0~4.9倍,热休克蛋白β-2(heat shock protein beta-2)和热休克蛋白β-1共2种蛋白质表达量下调至0.56倍和0.37倍;III类蛋白质4种,Trim72蛋白(Tripartite motif-containing protein 72)、Ⅱ型细胞骨架1角蛋白(Keratin)、维生素D结合蛋白表达量上调3.4~5.6倍, 核糖体蛋白表达量下降至0.63倍。
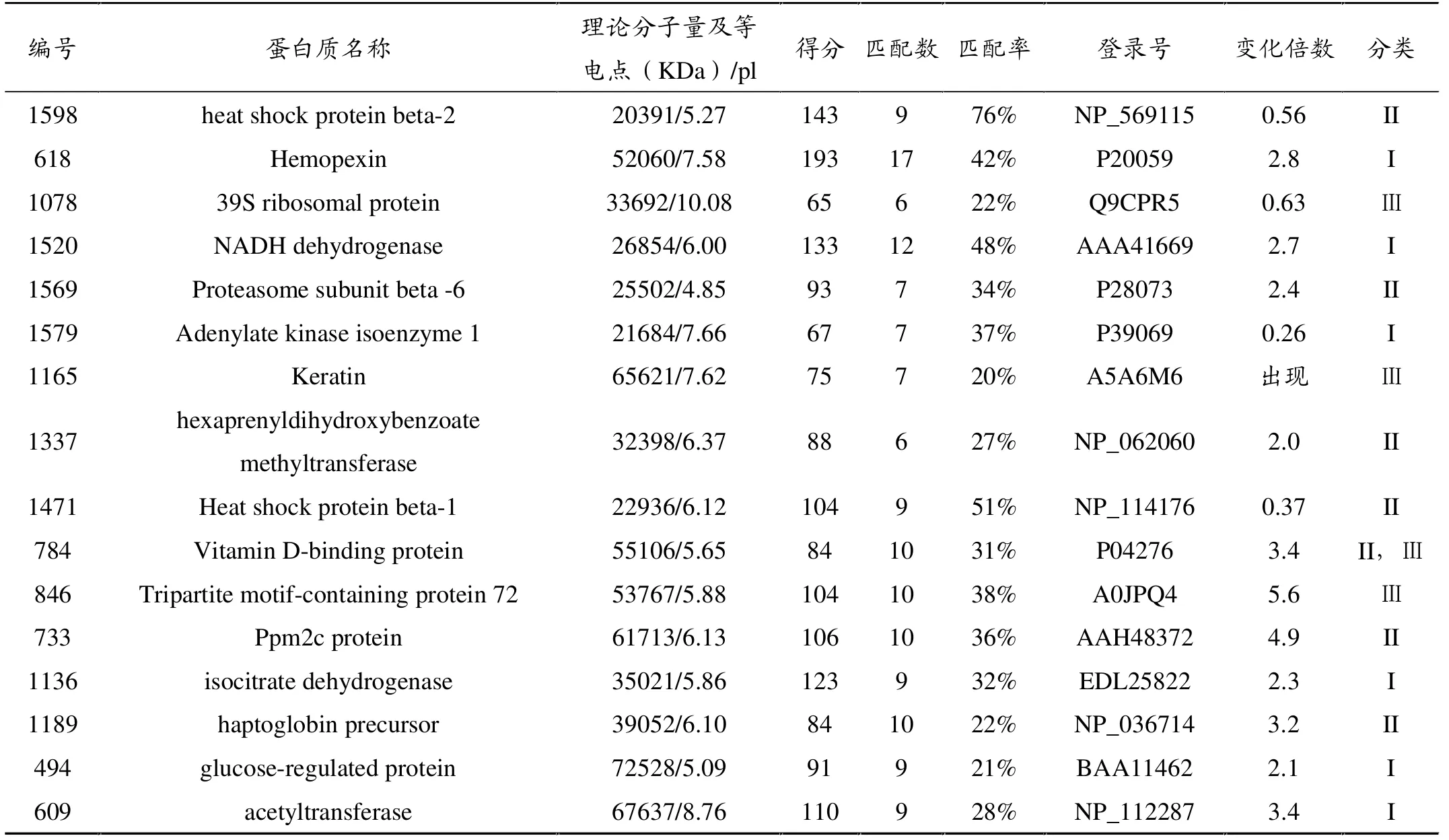
表3 48 h组与D组特异表达蛋白质信息比较
2.2.4 一次大强度离心运动后72 h组蛋白质组差异情况
一次大强度离心运动后72 h, 大鼠股四头肌蛋白质组表达谱中36种蛋白质出现显著性差异(图5)。其中,32种蛋白质表达量上调, 表观等电点在pH 4.3~6.2,表观分子量在27~59 kDa;4种蛋白质表达量下调,表观等电点在pH4.6~6.2,表观分子量在20.1~29 kDa。

图5 72 h组大鼠股四头肌双向凝胶电泳图谱
经质谱鉴定得到18种特异蛋白质信息中(表4),I类蛋白质6种,其中异柠檬酸脱氢酶、乙酰基转移酶、血色素结合蛋白、 辅酶Q9和烟酰胺腺嘌呤二核苷酸脱氢酶共5种蛋白质表达上调2.4~4.0倍,磷酸丙糖异构酶表达量下调至对照组的0.30倍;II类蛋白质5种,其中维生素D结合蛋白、3-巯基丙酮酸硫基转移酶、磷酸酶2C蛋白及鸟嘌呤脱氨酶(guanine deaminase)表达量上调2.8~6.9倍;III类蛋白质7种,胎球蛋白A、核糖体蛋白、维生素D结合蛋白、肌球蛋白1/3轻链(myosin light chain)、载 脂 蛋 白A -I 前 蛋 白 原 (apolipoprotein A -I preproprotein)、 鸟嘌呤脱氨酶及内质网驻地蛋白29(endoplasmic reticulum resident protein 29)表达量上调1.8~4.1倍。

表4 72 h组与D组特异表达蛋白质信息比较
2.2.5 一次大强度离心运动后168 h组蛋白质组差异情况
一次大强度离心运动后168 h,大鼠股四头肌蛋白质组表达谱中16种蛋白质出现显著性差异(图6)。其中,11种蛋白质表达量上调, 表观等电点在pH 4.1~6.5,表观分子量在25~57 kDa;5种蛋白质表达量下调,表观等电点在pH 4.6~6.2,表观分子量在22~38 kDa。
经质谱鉴定得到7种特异蛋白质信息中(表5),I类蛋白质中异柠檬酸脱氢酶和辅酶Q9蛋白质表达分别上调2.3和3.3倍, 腺苷酸激酶同工酶1表达量下调至对照组0.33倍;II类蛋白质3种, 其中肌钙腔蛋白、3-巯基丙酮酸硫基转移酶及鸟嘌呤脱氨酶表达量上调2.5~3.8倍;III类蛋白质和IV类蛋白质中分别有鸟嘌呤脱氨酶和14-3-3ε蛋白表达量分别上调3.8倍和2.3倍。

图6 168 h组大鼠股四头肌双向凝胶电泳图谱

表5 168 h组与D组特异表达蛋白质信息比较
2.2.6 一次大强度离心运动后特异蛋白质表达情况汇总
一次大强度离心运动后即刻至1周之内,蛋白质表达主要以上调为主,蛋白质表达下调主要在运动后24~48 h之间(图7)。 从蛋白质表达种类分析,I类蛋白质差异性表达上调次数为25次,下调表达次数8次,特别是运动后24~48 h之间上调表达次数为13次,占上调表达次数的56.5%;II类蛋白质在运动后即刻表达上调为主,表达上调蛋白数量为14种,未出现下调表达的蛋白质,随后上调表达蛋白数量逐渐下降,而在24 h时出现4个下调蛋白;III类蛋白质表达主要体现在48 h组和72 h组,上调蛋白质数量分别为4种和7种,下调表达蛋白质数量分别为1种和0种。

图7 一次大强度离心运动后大鼠股四头肌特异蛋白质分类表达情况
对特异表达蛋白质变化频次分析发现 (表6), I类蛋白质中分别有异柠檬酸脱氢酶、血色素结合蛋白、辅酶Q9、烟酰胺腺嘌呤二核苷酸脱氢酶、乙酰基转移酶在微损伤后24~72 h之间表达活跃并以表达量上调为主,腺苷酸激酶同工酶1表达以下调为主;II类蛋白质中磷酸酶2C蛋白、热休克蛋白β-1、免疫球蛋白λ轻链、结合珠蛋白前体、维生素D结合蛋白、鸟嘌呤脱氨酶表达频次较高,其中热休克蛋白β-1在0 h表达量上调,至48 h表达量下降至正常水平的0.37倍,其余蛋白表达量在0h时均有显著上升,在24~72 h之间各蛋白表达规律不尽相同,主要以表达上调为主;III类蛋白质中核糖体蛋白在0~48 h之间表达量出现显著下降,在72 h时表达量上调至对照组的2.8倍。

表6 特异性蛋白质表达频次及表达时间对应表
3 讨论
大强度下坡跑可诱导蛋白质表达水平变化, 这种变化与骨骼肌损伤修复过程中炎症消除、 肌纤维重建过程密切关联, 说明机体对大强度离心运动造成的微损伤能通过机体自身调节进行补偿[7,8,13]。 离心运动造成微损伤修复过程中,骨骼肌中钙蛋白酶(Calpain)和泛素蛋白(Ubiquitin)的动态变化几乎与骨骼肌超微结构的动态变化相一致, 揭示着蛋白质代谢水平的变化可能与结构恢复存在关联[14]。 本研究借助蛋白质组学手段, 对一次大强度离心运动引发的骨骼肌微损伤后自体修复过程中蛋白质组变异进行研究, 通过对特异表达蛋白质进行功能划分, 结合微损伤恢复过程中骨骼肌超微结构的变化, 试图发现骨骼肌微损伤自体修复过程中结构修复和不同类型蛋白质的关联性, 揭示骨骼肌微损伤自体修复过程中不同功能蛋白质组的动力学变化。
大鼠骨骼肌超微结构在运动后即刻组中未见有明显变化,说明运动后即刻微损伤尚未完全显现[15]。 但在运动后即刻,参与细胞损伤修复的蛋白质(II类)占特异蛋白质总数的58.3%,其中膜联蛋白A5、维生素D结合蛋白、α1抗胰蛋白酶前体、DJ-1蛋白、乙酰水解酶、免疫球蛋白λ轻链、磷酸酶2C蛋白、热休克蛋白β-1、着丝粒关联蛋白E、锌指蛋白、α2-HS-糖蛋白、结合珠蛋白前体表达量上调。 膜联蛋白A5参与调控炎性反应及细胞分化过程、调节细胞骨架蛋白间相互作用;维生素D结合蛋白可增强中性粒细胞的趋化活性, 并且激活巨噬细胞;DJ-1蛋白由PARK7基因编码, 属肽酶C56的蛋白质家族,功能目前尚不完全清楚,可作为一个积极的雄激素受体介导的转录调节因子, 也可用作氧化还原敏感的分子伴侣,氧化应激传感器,保护神经元免于氧化应激和细胞死亡; 乙酰水解酶通过降解血小板活化因子(PAF)从而避免PAF与靶细胞膜上的PAF受体结合引起的血小板聚集,中性粒细胞聚集和释放,产生大量活性氧。 本实验中发现运动后24 h,II类特异蛋白质表达数量较0 h组出现下降, 而24 h组超微结构变化较对照组出现显著变化, 表现为部分肌节紊乱甚至消失,Z线断裂,肌丝溶解,线粒体遭到严重破坏,出现高度水肿,嵴开始溶解,出现空泡化现象,外膜不完整;内质网模糊,细胞膜出现局部溶解现象,说明II类蛋白质表达与超微结构变化不完全同步,II类蛋白质表达先于超微结构变化。
运动后24~72 h, 骨骼肌中线粒体遭到严重破坏,出现高度水肿,嵴开始溶解,出现空泡化现象,外膜不完整现象逐渐恢复至线粒体嵴逐渐清晰, 外膜基本完整, 说明这个阶段是损伤骨骼肌亚细胞恢复的主要时期[16]。 与此同时,损伤修复过程中能量代谢相关蛋白质(I类)表达在此阶段较为活跃。 特别是24 h时,I类蛋白质表达量显著上调的蛋白质主要属于有氧代谢系统的主要酶类,如辅酶Q9、烟酰胺腺嘌呤二核苷酸脱氢酶、乙酰基转移酶、异柠檬酸脱氢酶、磷酸甘油-3脱氢酶。其中,辅酶Q在体内呼吸链中质子移位及电子传递中起重要作用,是细胞呼吸和代谢的激活剂,也是重要的抗氧化剂和非特异性免疫增强剂; 血色素结合蛋白存在于人血清中的高丰度β1糖蛋白,对血红素有高亲和力,因此对人体利用氧的能力起关键作用; 烟酰胺腺嘌呤二核苷酸脱氢酶通过对NADH 作用进行脱氢生成NAD+,从而在呼吸链中使黄素、醌、细胞色素逐步被还原,最后氧被还原成水;乙酰基转移酶是丙酮酸脱氢酶多酶复合体的主要酶,PDC催化丙酮酸生成乙酰辅酶A的反应是线粒体代谢与生长的调控枢纽; 异柠檬酸脱氢酶在胞液中以NADP+为辅酶, 在线粒体内膜中以NAD+为辅酶;磷酸甘油-3脱氢酶主要参与脂肪有氧氧化。 相反,在运动后24 h,磷酸原供能系统酶和参与糖酵解的酶系中,腺苷酸激酶同工酶1、磷酸丙糖异构酶及磷酸乙醇酸磷酸酶表达受到显著抑制。 在运动后48 h和72 h,异柠檬酸脱氢酶有氧代谢系统酶类表达仍表现出显著上调, 无氧代谢系统酶系统中腺苷酸激酶同工酶1表达仍受到显著抑制。 由此可见, 在运动后24~72 h之内(特别是运动后24 h)有氧代谢酶系统表达受到显著激活,线粒体超微结构在此期间也逐渐恢复,说明有氧代谢酶系统功能恢复可能促进了线粒体自身修复进而加快肌纤维再生速度[17]。
与对照组比较,III类蛋白质的表达主要集中在运动后48 h和72 h组内。 其中,Trim 72蛋白、Ⅱ型细胞骨架1角蛋白、维生素D结合蛋白、胎球蛋白A、核糖体蛋白、肌球蛋白、载脂蛋白A-I前蛋白原、鸟嘌呤脱氨酶及内质网驻地蛋白29在48~72 h之间表达均出现显著上升。Trim 72作为一个氧化传感器在骨骼肌中特定表达,在细胞膜修复中的作用很重要; 肌球蛋白是肌原纤维粗丝的组成单位,在肌肉运动中起重要作用;载脂蛋白是构成血浆脂蛋白的蛋白质组分, 运载脂类物质及稳定脂蛋白的结构。 从结构变化来看,运动48 h后肌节仍出现明显萎缩, 线粒体结构逐渐清晰, 外膜和嵴已显现;运动72 h后切片发现I带出现过度收缩现象,肌节已经清晰,Z线逐渐恢复,线粒体数量基本恢复[18]。 因此,III类蛋白质表达与超微结构恢复具有一定的相关性,与金其贯[14]研究结果类似。
综上所述, 一次大强度离心运动后的自体修复过程中, 大鼠骨骼肌蛋白质组和超微结构均出现显著变化, 蛋白质组及其功能对应的超微结构的变化规律依据蛋白质功能不同而呈现不同的同步性规律。 细胞损伤修复蛋白质(II类)在运动后0~48 h之内受到激活,而超微结构变化主要发生在48~168 h之间。 线粒体酶系统及能量代谢相关蛋白质(I类)在运动后0~24 h内受到显著激活,而此时线粒体超微结构的修复尚未发现;至48~72 h之间,I类蛋白表达仍然活跃,线粒体外膜、线粒体嵴基本恢复, 说明有氧代谢酶系统功能恢复可能促进了线粒体自身修复,进而加快肌纤维再生速度。骨骼肌结构蛋白质(III类)在运动后24~48 h之内表达活跃,同时超微结构恢复速率较快, 说明结构蛋白的表达有助于超微结构的恢复。
[1] Cheung K,Hume P,Maxwell L. Delayed onset muscle soreness:treatment strategies and performance factors [J]. Sports Med,2003,33(2):145-164.
[2] Chen TC. Variability in muscle damage after eccentric exercise and the repeated bout effect [J]. Res Q Exerc Sport,2006,77(3):362-371.
[3] 于新凯,晁唯伟,左群. 运动性骨骼肌损伤超微结构变化的研究进展[J]. 解剖科学进展,2013,19 (3):298-302.
[4] 张翔,张学林,许寿生. 运动与骨骼肌超微结构变化[J]. 中国运动医学杂志,2010,29(1):109-113.
[5] McPhee JS,Williams AG,Perez-Schindler J,et al. Variability in the magnitude of response of metabolic enzymes reveals patterns of co -ordinated expression following endurance training in women[J]. Exp Physiol,2011,96 (7):699-707.
[6] van den Broek NM,Ciapaite J,Nicolay K,et al. Comparison of in vivo postexercise phosphocreatine recovery and resting ATP synthesis flux for the assessment of skeletal muscle mitochondrial function[J]. Am J physiol cell physiol,2010,299:C1136-C1143.
[7] 魏源,王革,卓莉. 运动性骨骼肌微损伤机制的研究进展[J].上海体育学院学报,2007,31(2):67-73.
[8] 朱荣,马延超,王瑞元. 一次大强度运动对大鼠骨骼肌泛素蛋白酶体途径基因表达及蛋白质降解的影响[J]. 中国运动医学杂志,2012,31(5):414-419.
[9] 白巍,张海平. 离心运动对大鼠骨骼肌线粒体ATP酶活性及desmin表达影响的研究 [J]. 沈阳体育学院学报,2013,32(2):86-88.
[10] 葛新发,董贵俊,王玉站,等. 重复大强度运动对骨骼肌蛋白质组变异研究[J]. 体育科学,2013,33(5):41-49.
[11] 董贵俊,吕晨曦,葛新发,等. 一次和重复大强度离心运动前后大鼠骨骼肌超微结构变化 [J]. 中国运动医学杂志,2013,32(2):167-173.
[12] Bradford MM. A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein dye binding[J]. Anal Biochem,1976,72:248-254.
[13] 田野,马鹏鹏,郭时杰,等. 连续运动后延迟性肌肉损伤的适应性研究[J]. 中国运动医学杂志,2003,22(2):138-142.
[14] 金其贯,刘霞,李淑艳,等. 反复离心运动对大鼠骨骼肌损伤和蛋白质降解机制的影响[J]. 体育科学,2010,6:76-80.
[15] Panchangam A,Claflin DR,Palmer ML,et al. Magnitude of sarcomere extension correlates with initial sarcomere length during lengthening of activated single fibers from soleus muscle of rats[J]. Biophys J,2008,95(4):1890-1901.
[16] Morgan DL,Proske U. Popping sarcomere hypothesis explains stretch-induced muscle damage[J]. Clin Exp Pharmacol Physiol,2004,31(8):541-545.
[17] Butterfield TA,Herzog W. Magnitude of muscle straindoes not influence serial sarcomere number adaptations following eccentric exercise[J]. Pflugers Arch,2006,451(5):688-700.
[18] Yu JG,Carlsson L,Thornell LE. Evidence for myofibril remodeling as opposed to myofibril damage in human muscles with DOMS:An ultrastructural and immunoelectron microscopic study[J]. Histochem Cell Biol,2004,121(3):219-227.
