超重及肥胖青少年骨密度、骨矿含量与脂肪和去脂软组织质量关系的研究
2015-04-15高欢冯连世张漓高炳宏徐建方路瑛丽马福海樊蓉芸陈文鹤
高欢 冯连世 张漓 高炳宏 徐建方 路瑛丽 马福海 樊蓉芸 陈文鹤
1 上海体育科学研究所(上海200030)
2 国家体育总局体育科学研究所
3 青海省体育科学研究所 4 上海体育学院
人体各组成成分间关系密切,骨、脂肪与骨骼肌三者之间相互联系,互相影响[1]。 青少年时期是生长发育的高峰期, 大多数骨和肌肉的生长都出现在这一时期[2]。 在达到峰值骨量后,骨密度随着年龄的增长有下降的趋势,对骨起决定性影响的因素也会发生改变[3,4]。研究显示, 青少年时期脂肪堆积部位及肥胖程度对骨密度 (bone mineral density, BMD) 和 骨 矿 含 量(bone mineral content,BMC)有显著影响[5-7]。 厘清超重及肥胖青少年身体成分与BMD、BMC间的关系、何种身体成分起决定性作用,有助于针对性地提出相应干预策略,对于改善超重及肥胖青少年骨健康水平有重要意义。
1 对象与方法
1.1 研究对象

图1 全身各区域切线示意图
超重或肥胖青少年50人, 其中男性22人、 女性28人,身体健康,无心血管系统疾病,无抽烟酗酒等不良嗜好,无系统锻炼史。 身高、年龄及体重等基本信息如表1所示。 根据卫生部疾病控制司编制的《中国成人超重和肥胖症预防控制指南》定义:年龄在18岁以上的青年体重指数 (BMI)24~27.9 kg/m2属于超重,BMI≥28 kg/m2属于肥胖;根据《中国学龄儿童青少年超重、肥胖筛查体重指数分类标准》,年龄小于18岁超重和肥胖标准均低于成人标准, 故本研究选择受试者时统一要求BMI不小于24 kg/m2。 所有参与研究的受试者均被详细告知研究背景、目的、意义和方法,并签署知情同意书。
1.2 测试指标与仪器
采用全身扫描模式, 以双能X射线吸收法(dual energy X-ray absorptiometry, DXA) 测量全身及各区域骨密度、骨矿含量、脂肪质量(fat mass,FM)和去脂软组织质量 (lean soft tissue mass,LTM), 测试仪器为GE Lunar Prodigy,软件版本:12.2。 测试前1小时进行仪器的预热和校准。采用全身扫描模式,计算机自动识别各区域。 测试仪器及扫描区域分布如图1所示:
全身切线分布如图1所示,具体说明如下(引自GE Lunar Prodigy, enCORETMOperator’s Manual):1) 头部切线: 头部切线位于下颚的正下方;2) 左臂和右臂切线:两臂的切线穿过腋窝,并且尽可能靠近身体,确保切线可将手和臂与身体隔离;3)左前臂和右前臂切线:两前臂的切线都尽可能靠近身体, 并且将肘和前臂与身体隔离;4)左脊柱和右脊柱切线:两边脊柱的切线都较靠近身体,并且不包括肋骨支架;5)左骨盆和右骨盆切线: 两边骨盆的切线都通过股骨颈, 并且不碰触骨盆;6)骨盆顶部切线:骨盆顶部切线位于骨盆顶部的正下方;7)左腿和右腿切线:两腿的切线可将手、前臂与腿隔离;8)腿中切线:腿中切线可隔离右腿和左腿。
测量前需注意以下问题:1)衣物:受试者不得穿戴可以削弱X射线光束的物件, 例如: 具有金属拉练、锁扣、带金属纽扣的衣物。要求受试者穿着运动装前来测试。2)放射性元素和不透射线药剂:要求受试者在过去的3~5 天内不要服用或注射放射性核素和不透射线药剂。如果受试者曾经进行使用此类药剂的测试,将测量延后,直到受试者体内不再存有该元素的痕迹。 3)受试者脊椎位于中线,双手和双脚自然分开,头部、手臂边缘和脚不能超过仪器边缘。
1.3 数据统计
全身及不同区域骨密度与体重、BMI、 体脂百分比等指标间的关系以Pearson相关检验统计, 显著性水平为P < 0.05,极显著性水平为P < 0.01。以多元逐步线性回归 (multiple stepwise linear regression) 分析体重、BMI、体脂百分比、全身脂肪质量和全身去脂软组织质量对全身及各区域BMD、BMC的贡献率, 剔除标准为P≥0.1,引入标准为P < 0.05。 各指标数值以± s 表示,统计软件为Spss17.0。
2 研究结果
研究对象各指标描述性结果见表1。
表2显示,体重、全身去脂软组织质量与全身骨密度和骨盆骨密度间呈中等相关性(0.4 < r < 0.6,P < 0.01),与腿部骨密度呈强相关性 (0.6 < r < 0.8,P < 0.001);BMI与全身骨密度和骨盆骨密度间呈弱相关(0.2 < r <0.4,P < 0.05),与腿部骨密度呈中等相关性(0.4 < r <0.6,P < 0.01);体脂百分比与全身、腿部和骨盆骨密度均呈显著负相关,其中与腿部骨密度呈中等负相关;全身脂肪质量与全身、 腿部和骨盆骨密度均无显著相关性。
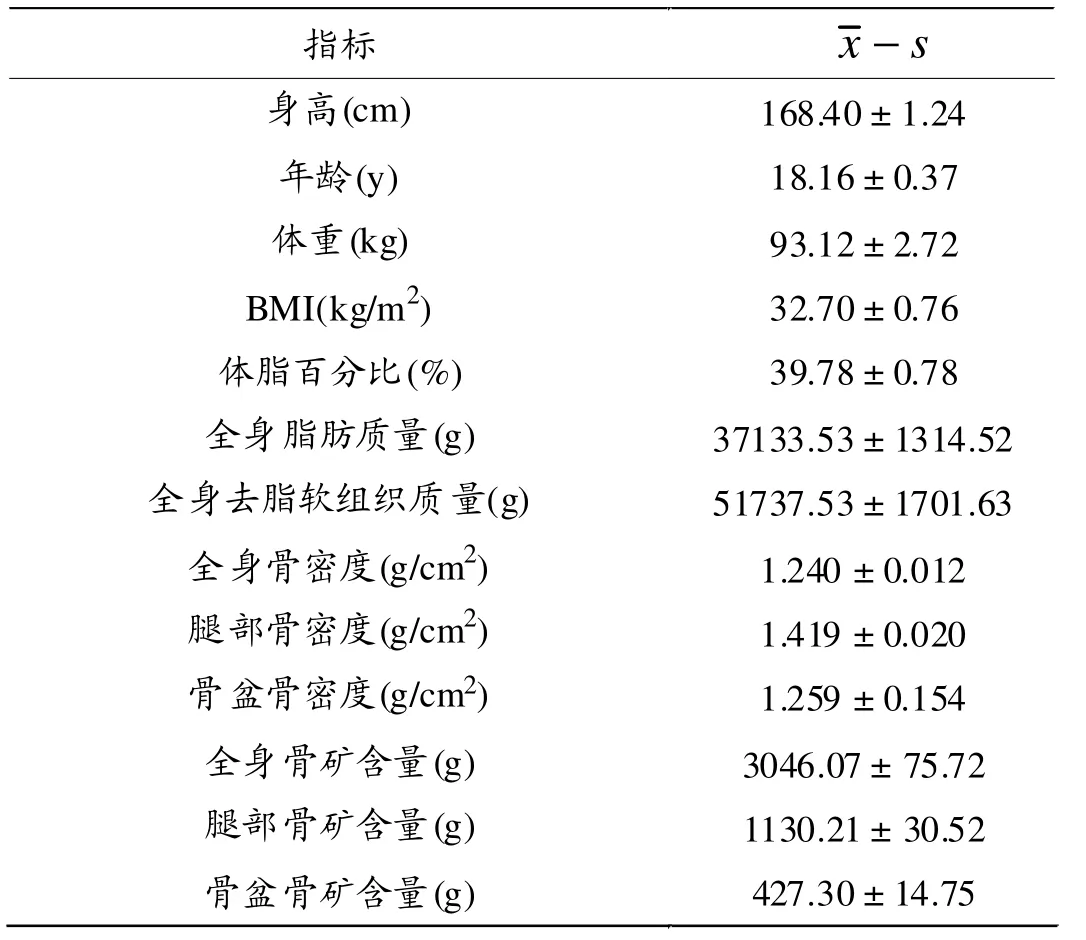
表1 各指标描述性统计一览表

表2 体重、BMI、全身脂肪质量及全身去脂软组织质量等指标与骨密度相关性
表3显示,超重及肥胖青少年全身、腿部和骨盆骨矿含量与体重、BMI、体脂百分比、全身脂肪质量、全身去脂软组织质量呈显著正相关(P < 0.05);其中,体重与全身和腿部骨矿含量呈强相关性 (0.6 < r < 0.8,P <0.001),与骨盆骨矿含量呈中等相关性(0.4 < r < 0.6,P< 0.001);全身去脂软组织质量与全身和骨盆骨矿含量呈强相关性,与腿部骨矿含量呈极强相关性(0.8 < r <1.0,P < 0.001);BMI与全身和骨盆骨矿含量呈弱相关性(0.2 < r <0.4,P < 0.05),与腿部骨矿含量呈中等相关(P < 0.001);全身脂肪质量与全身、腿部和骨盆骨矿含量均呈现出弱相关性 (0.2 < r < 0.4,P < 0.05);全身、 腿部和骨盆骨矿含量与体脂百分比呈显著负相关(P < 0.05),其中全身和腿部骨矿含量与体脂百分比呈中等相关,骨盆骨矿含量与之呈弱相关。其中,腿部骨密度的52.6%、腿部骨矿含量的73.1%由全身去脂软组织质量决定;全身去脂软组织质量和BMI的综合作用可解释全身骨矿含量的57.6%、腿部骨矿含量的75.4%。全身去脂软组织质量对骨矿含量和骨密度有着决定性影响。 见表4。

表3 体重、BMI、全身脂肪质量及全身去脂软组织质量等指标与骨矿含量相关性

表4 全身、腿部及骨盆BMD和BMC与全身去脂软组织质量和脂肪质量等指标多元逐步回归分析结果
3 分析与讨论
直接测量人体脂肪含量的方法有核磁共振法(MRI)、 计算机断层摄影法 (CT)、 双能X射线吸收法(DXA)、生物电阻抗法等。 MRI和CT被认为是身体成分测量的金标准,但测试费用高、测试过程耗时较长、具有较强的放射性。 相比较而言,DXA测试费用低、耗时短(10~20 min)、放射性较小。 研究证实DXA测量得到的身体成分与用MRI或CT测得的身体成分数据有较强的相关性[8,9]。双能X射线吸收法采用的是人体三组分模型,身体质量(body mass, BM)由三种组分的质量构成:骨矿含量(bone mineral content, BMC)、脂肪质量(fat mass, FM) 和去脂软组织质量 (lean soft tissue mass,LTM); 去脂软组织质量是除脂肪和矿物质以外的软组织质量,主要成分为水和有机物质,与骨骼肌质量具有极强的相关性(R2=0.96,P<0.001)[10,11]。去脂身体质量或去脂体重(fat-free mass,FFM)等于去脂软组织质量与骨矿含量之和(FFM=BMC+LTM),与去脂软组织质量并非同一概念,因此,身体质量可表示为:BM=BMC+FM+LTM或FM+FFM[11]。
本研究发现超重及肥胖青少年体重、BMI和LTM与全身、腿部和骨盆BMD、BMC均呈现出显著正相关,FM与BMD未见显著相关性,仅与BMC呈弱正相关,而体脂百分比与BMD、BMC均呈现出显著负相关。多元回归分析表明,LTM是决定超重和肥胖青少年BMD、BMC的关键因子。
体重与骨健康的关系很早就引起了学者们的注意。 研究发现,由于重力作用,体重增加导致骨承受的机械负荷增加, 而机械负荷增加有益于成骨细胞的分化和增殖[12]。 因此,传统观点认为肥胖对骨无不良影响,甚至是有益的。多项研究也证实体重与BMD呈显著正相关[13-15],体重可解释BMD差异的30%[16]。但越来越多的研究表明,FM和LTM可能是影响BMD、BMC的两个独立因素。 一项针对青少年(10~19岁)的调查显示,体脂百分比与腰椎和股骨颈BMD均呈显著负相关; 女生BMD和BMC与LTM和FM呈显著正相关,而男生BMD和BMC仅与LTM呈显著正相关[5]。Wang等调查发现年轻女性(20~25岁)FM、LTM与BMC都呈显著正相关,但LTM对BMC贡献率显著大于FM[17]。 Lu等[18]研究发现青年女性(30~40岁)FFM、FM与髋部BMD均呈显著正相关,其中FFM是预测脊椎和髋部BMD最为有效的一个因子。近期,韩国一项大规模针对成年人口的调查显示,不论是何性别、 年龄人群, 四肢骨骼肌质量是影响BMC和BMD的一个独立因子[19]。 Madeira等[20]调查肥胖青年人(27~41岁) 后发现桡骨和胫骨远端骨小梁体积密度与LM呈显著相关性,多元线性回归分析显示仅LM是影响桡骨和胫骨远端骨小梁体积骨密度的独立因素。Bredella等[21]报道亦表明绝经前肥胖女性肌肉质量和腰椎骨小梁BMD呈显著正相关。 上述针对青年人的调查表明,不论是正常体重者还是肥胖者,去脂软组织质量或去脂体重对BMD、BMC有决定性影响。本研究结果与之基本一致, 进一步证实去脂软组织质量对超重和肥胖青少年BMC和BMD都有着决定性影响。
由于去脂软组织质量与骨骼肌质量呈高度正相关,在一定程度上可代表骨骼肌质量。 骨骼肌越多,肌肉收缩时作用于骨的有效负荷就越大, 从而启动骨细胞机械刺激感受器,使成骨作用加强[22]。 联系骨骼与肌肉的不仅仅只是机械负荷刺激, 骨骼肌的内分泌功能与骨亦关系密切。 目前已鉴定出的骨骼肌分泌的细胞因子有筒箭毒碱、胰岛素样生长因子、白介素-6、白介素-7等多种[23],它们不仅可以像激素一样经循环血运输至靶器官发挥生理作用, 还可以自分泌或旁分泌的形式作用于骨骼肌本身或邻近组织、器官。这些由骨骼肌分泌的细胞因子在骨代谢的调控中也发挥着极为重要的作用[24]。 而研究也发现由骨细胞所分泌的一种细胞因子——硬骨素(sclerostin)也可经血液循环或旁分泌的形式作用于骨骼肌[25]。 由此可见二者关系之密切。
脂肪对骨的影响既有有益的一面, 亦有有害的一面,它对骨的影响是两方面因素动态平衡的结果。一方面,在重力作用下,体重随脂肪质量增加而增加后,骨的机械负荷增大[14];另外,脂肪组织可产生少量雌激素[26],二者的综合作用使成骨作用加强, 有益于骨矿物质的沉积。然而,另一方面,当脂肪堆积到一定程度时,过多的脂肪组织分泌的多种细胞因子, 及其并发的慢性炎症反应[27,28],可通过不同信号途径或直接或间接地干扰骨矿物质的沉积[29,30]。 多项研究对此也有所报道。 一项针对8~13岁女孩的为期2年的调查显示, 过多的脂肪,尤其是腰腹部区域脂肪的过多堆积, 可能抑制了承重骨(股骨颈和胫骨)皮质骨矿物质的沉积[6]。针对肥胖成年人的调查表明,内脏脂肪含量越高,腰椎骨小梁BMD越低[21]。 另外,有研究表明肥胖程度或是否患有代谢综合征可能对青少年骨有着重要影响。 调查发现,与体重正常的男生(15~19岁) 相比较, 超重男生具有较高的BMD[7]。但是患代谢综合征的超重青少年(10~16岁)BMD却显著低于未患代谢综合征的超重青少年,且腰围与BMD呈高度负相关[31]。 极度肥胖青少年BMD和BMC也都显著低于一般肥胖者[5]。 上述研究提示,青少年时期过多的脂肪堆积对于骨健康是极为不利的, 脂肪组织对骨的影响可能与机体脂肪组织的堆积量和堆积部位有关系;一定范围内的脂肪质量增加可能有益于骨的健康,过多则有害; 腰腹部脂肪的过多堆积可能是另一个影响骨健康水平的独立因素。本研究结果表明,超重和肥胖青少年全身脂肪质量与各部位BMD、BMC呈显著正相关,另一方面,体脂百分比则与全身及各部位BMD、BMC呈显著负相关, 或从另一个角度间接地证明了这一点。
缺乏体力活动是发生肥胖的重要原因。 调查表明舞蹈专业的女生(15~17岁)全身及腿部BMC、BMD显著高于普通学生组[32]。 跳跃和舞蹈练习使青春前期女生的BMD显著提高[33]。 日常体力活动量越大的女孩BMD越高[34],并且骨皮质面积和单位体积密度的增加与体力活动量呈现出剂量依赖效应[35]。 年轻时常进行体育锻炼的人群,进入老年后骨量、骨面积较高,并且骨折风险也较低[36]。 若规律的有氧运动结合一定量的抗阻训练,不仅能够帮助肥胖者降体重减脂肪,增加去脂体重,还有助于增加BMC、提高BMD[37,38]。 因而,超重和肥胖青少年进行适当的体育锻炼对于保持骨健康十分必要。
4 结论
超重及肥胖青少年体重、BMI和全身去脂软组织质量与骨密度、骨矿含量呈显著正相关,体脂百分比与骨密度、骨矿含量均呈显著负相关。 其中,全身去脂软组织质量是影响骨密度、骨矿含量的决定性因素。
[1] Blank RD. Bone and muscle pleiotropy: the genetics of associated traits. Clinic Rev Bone Mineral Metab, 2014,12(2):61-65.
[2] Boot AM, de Ridder MA, van der Sluis IM, et al. Peak bone mineral density, lean body mass and fractures. Bone, 2010,46(2):336-341.
[3] 杜艳萍, 朱汉民,朱晓颖,等. 上海地区男性髋部骨几何结构与人体成分相关影响因素分析. 中华内分泌代谢杂志,2014, 30(8): 643-649.
[4] 陈蓉,林守清,林霞,等. 年龄对北京地区健康妇女身体成分的影响. 中华妇产科杂志, 2008, 43(1):36-40.
[5] Mosca LN, Goldberg TB, da Silva VN, et al. Excess body fat negatively affect bone mass in adolescents. Nutrition, 2014,30(7-8): 847-852.
[6] Laddu DR, Farr JN, Laudermilk MJ, et al. Longitudinal relationships between whole body and central adiposity on weight-bearing bone geometry, density, and bone strength: a pQCT study in young girls. Arch Osteoporos, 2013, 8 (1-2):156.
[7] El Hage R, El Hage Z, Jacob C, et al. Bone mineral content and density in overweight and control adolescent boys. J Clin Densitom, 2011, 14(2):122-128.
[8] Kim J, Wang Z, Heymsfield SB, et al. Total-body skeletal muscle mass: estimation by a new dual -energy X -ray absorptiometry method. Am J Clin Nutr, 2002, 76 (2):378-383.
[9] Kim J, Shen W, Gallagher D, et al. Total-body skeletal muscle mass: estimation by dual energy X-ray absorptiometry in children and adolescents. Am J Clin Nutr, 2006, 84(5):1014-1020.
[10] Mazess RB, Barden HS, Bisek JP, et al. Dual-energy x-ray absorptiometry for total-body and regional bone-mineral and soft-tissue composition. Am J Clin Nutr, 1990, 51 (6):1106-1112.
[11] 王自勉, 吴至行. 人体组成学. 北京: 高等教育出版社,2008:137-143.
[12] Ehrlich PJ, Lanyon LE. Mechanical strain and bone cell function: a review. Osteoporos Int,2002,13(9):688-700.
[13] Frost HM. Obesity, and bone strength and “mass” : a tutorial based on insights from a new paradigm. Bone, 1997, 21(3):211-214.
[14] Reid IR. Relationships among body mass, its components,and bone. Bone, 2002, 31(5): 547-555.
[15] Skerry TM, Suva LJ. Investigation of regulation of bone mass by mechanical loading: from quantitative cytochemistry to gene array. Cell Biochem Funct, 2002, 21(3): 223-229.
[16] Hannan MT, Felson DT, Anderson JJ. Bone mineral density in elderly men and women: results from the Framingham osteoporosis study. J Bone Miner Res, 1992,7(5):547-553.
[17] Wang MC, Bachrach LK, Van Loan M, et al. The relative contributions of lean tissue mass and fat mass to bone density in young women. Bone, 2005, 37:474-481.
[18] Lu LJ, Nayeem F, Anderson KE, et al. Lean body mass, not estrogen or progesterone, predicts peak bone mineral density in premenopausal women. J Nutr, 2009, 139:250-256.
[19] Moon SS. Relationship of lean body mass with bone mass and bone mineral density in the general Korean population.Endocrine, 2014, 47(1):234-243.
[20] Madeira E, Mafort TT, Madeira M, et al. Lean mass as a predictor of bone density and microarchitecture in adult obese individuals with metabolic syndrome.Bone,2014,59:89-92.
[21] Bredella MA, Torriani M, Ghomi RH, et al. Determinants of bone mineral density in obese premenopausal women. Bone,2011, 48(4):748-754.
[22] Frost HM. Bone’s mechanostat: a 2003 update. Anat Rec A Discov Mol Cell Evol Biol, 2003, 275(2): 1081-1101.
[23] Pedersen BK,Febbraio MA. Muscles,exercise and obesity:skeletal muscle as a secretory organ. Nat Rev Endocrinol,2012, 8(8):457-465.
[24] Hamrick MW. The skeletal muscle secretome: an emerging player in muscle-bone crosstalk. Bonekey Rep,2012,1:60.
[25] Forbes SC, Little JP, Candow DG. Exercise and nutritional interventions for improving aging muscle health. Endocrine,2012, 42(1):29-38.
[26] Simpson ER. Sources of estrogen and their importance. J Steroid Biochem Mol Biol, 2003, 86(3-5):225-230.
[27] Johnsor AR, Milner JJ, Makowski L. The inflammation highway: metabolism accelerates inflammatory traffic in obesity. Immunol Rev, 2012, 249(1):218-238.
[28] Bastard JP, Maachi M, Lagathu C, et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw, 2006, 17(1):4-12.
[29] Aguirre L, Napoli N, Waters D, et al. Increasing adiposity is associated with higher adipokine levels and lower bone mineral density in obese older adults. J Clin Endocrinol Metab, 2014 99(9):3290-3297.
[30] Mohiti-Ardekani J, Soleymani-Salehabadi H, Owlia MB, et al. Relationships between serum adipocyte hormones(adiponectin, leptin, resistin), bone mineral density and bone metabolic markers in osteoporosis patients. J Bone Miner Metab, 2014,32(4):400-404.
[31] Nóbrega da Silva V, Goldberg TB, Mosca LN, et al.Metabolic syndrome reduces bone mineral density in overweight adolescent. Bone, 2014, 66: 1-7.
[32] Yang LC, Lan Y, Hu J, et al. Relatively High bone mineral density in Chinese adolescent dancers despite lower energy intake and menstrual disorder. Biomed and Environ Sci,2010, 23(2):130-136.
[33] Nogueira RC, Weeks BK, Beck B. An in-school exercise intervention to enhance bone and reduce fat in girls: the CAPO Kids trial. Bone, 2014, 68C:92-99.
[34] Stager M, Harvey R, Secic M, et al. Self-reported physical activity and bone mineral density in urban adolescent. J Pediatr Adolesc Gynecol, 2006, 19(1):17-22.
[35] Michalopoulou M, Kambas A, Leontsini D, et al. Physical activity is associated with bone geometry of premenarcheal girls in a dose-dependent manner. Metabolism, 2013, 62(12):1811-1818.
[36] Tveit M, Rosengren BE, Nilsson JA, et al. Exercise in youth: High bone mass, large bone size, and low fracture risk in old age. Scand J Med Sci Sports, 2014 Aug 11. doi:10.1111/sms.12305. [Epub ahead of print]
[37] Shea KL, Gozansky WS, Sherk VD, et al. Loss of bone strength in response to exercise-induced weight loss in obese postmenopausal women: results from a pilot study. J Musculoskelet Neuronal Interact, 2014, 14(2):229-238.
[38] Hinton PS, Rector RS, Thomas TR. Weight-bearing, aerobic exercise increases markers of bone formation during shortterm weight loss in overweight and obese men and women.Metabolism, 2006, 55(12):1616-1618.
