高压抗原修复液的pH值对淋巴组织免疫组化染色的影响
2015-04-14郭爱桃李亚卓
陈 薇,郭爱桃,李亚卓,孙 璐
(中国人民解放军总医院海南分院病理科,海南 三亚 572013)
高压抗原修复液的pH值对淋巴组织免疫组化染色的影响
陈 薇,郭爱桃,李亚卓,孙 璐
(中国人民解放军总医院海南分院病理科,海南 三亚 572013)
目的 研究高压抗原修复液的pH值对淋巴组织免疫组化染色的影响。方法运用高压的抗原修复方式,按修复液pH值的不同分为pH 6.0枸橼酸抗原修复组和pH8.0EDTA抗原修复组,对76例淋巴组织进行免疫组化染色,每例分别标记抗体CD3、CD20和CD5。结果pH 6.0枸橼酸抗原修复组有9例阳性标记不明确,其中5例出现了细胞膜破损,67例符合诊断标准;pH8.0EDTA抗原修复组有60例阳性标记不明确,其中59例出现了细胞膜破损,仅有16例组织染色符合诊断标准,两组间比较差异有统计学意义(P<0.05)。结论免疫组化染色中,使用pH 8.0 EDTA抗原修复液对淋巴组织进行高压修复,致使淋巴细胞胞膜破损,使用pH 6.0枸橼酸高压修复有助于避免这一现象。
淋巴组织;免疫组化染色;抗原修复液;EDTA;枸橼酸
免疫组织化学(Immunohistochemistry,IHC;以下简称免疫组化)染色技术是在组织化学方法上结合免疫学的理论发展起来的一门技术,近年来随着染色技术的不断改进和提高,免疫组化已经被越来越广泛地应用于病理常规工作中,成为病理诊断不可或缺的检测技术和手段,为辅助疾病诊断、判断预后,以及检测肿瘤组织的相关抗原,指导临床治疗提供了重要依据[1]。但是免疫组化染色是一种多步骤、多因素决定的实验方法,存在很多干扰因素,标本的固定、脱水、实验室操作条件以及操作人员素质等的不同都可导致结果的差异,甚至有时会因为不同地区的温度、湿度以及水质的差异而影响染色结果,出现不理想的染色,从而影响医生的病理诊断,严重者可能会造成误判和误诊。在众多影响因素中,抗原修复方式是影响免疫组化染色结果的最主要因素之一[2]。中国人民解放军总医院海南分院(以下简称海南分院)开诊近两年来,在免疫组化染色中出现了一些异常现象,其中比较集中的问题体现在淋巴细胞出现难以解释的胞浆肿胀和胞膜弥散现象,从而导致阳性标记不明确,染色效果不理想,给病理医生判断免疫组化结果带来了很大困难,经调整高压修复时间和3%H2O2的孵育时间,效果均不明显。本文针对这一问题通过调整高压修复液的pH值进行对比研究,探讨高压修复液的pH值与免疫组化染色切片中淋巴细胞胞浆肿胀和细胞膜弥散现象之间的关系,为以后的免疫组化染色工作以及病理医生对于免疫组化切片的观察和结果判读提供可靠的理论指导依据。
1 材料与方法
1.1 一般资料 复查中国人民解放军总医院海南分院病理科2012年7月至2014年7月期间所有曾进行免疫组化染色的病例,选择其中富于淋巴细胞且为非穿刺活检组织者作为研究对象,共76例。
1.2 试验设计及分组 采用配对实验,分为EDTA(乙二胺四乙酸二钠)(pH 8.0)缓冲液抗原修复组和枸橼酸(pH 6.0)缓冲液液抗原修复组两组。
1.3抗体及试剂 标记抗体有CD3、CD5和CD20,所用一抗均使用安必平公司即用型工作液,二抗使用安必平LBP-VBrightI通用型二抗聚合物检测试剂盒。
1.4 方法 挑选的组织块均行3 μm连续切片,每例6张,EDTA(pH 8.0)缓冲液抗原修复组和枸橼酸(pH 6.0)缓冲液抗原修复组各3张,分别在切片上进行修复液和标记抗体的标识。所有切片均统一进行70℃烤片机烤片1 h,常规脱蜡及水化。水化后EDTA(pH 8.0)抗原修复组切片放入EDTA(pH 8.0)抗原修复液高压修复1.5 min;枸橼酸(pH 6.0)抗原修复组切片放入枸橼酸(pH 6.0)抗原修复液中高压修复2.5 min。两组切片均同时进行免疫组化标记,DAB显色,苏木素返蓝,以细胞膜的棕黄色着色为阳性反应。
1.5 统计学方法 应用SPSS16.0统计软件进行统计分析,采用χ2检验对两组的免疫组化染色结果进行统计学处理,以P<0.05为差异具有统计学意义。
2 结果
76例经EDTA(pH 8.0)抗原修复液进行高压修复的切片中有60例染色效果欠佳,阳性标记不明确,影响了医生对结果的判读,其中59例均出现了细胞浆肿胀和细胞膜弥散现象,仅有16例组织符合诊断标准;而枸橼酸(pH 6.0)抗原修复液修复组中有9例阳性标记不明确,其中5例出现了细胞浆肿胀和细胞膜弥散现象(图1~图6),67例符合诊断标准。统计学分析发现无论在阳性标记明确与否的比例上,还是细胞浆肿胀和细胞膜弥散现象的发生率上,两组间差异均具有统计学意义,见表1。
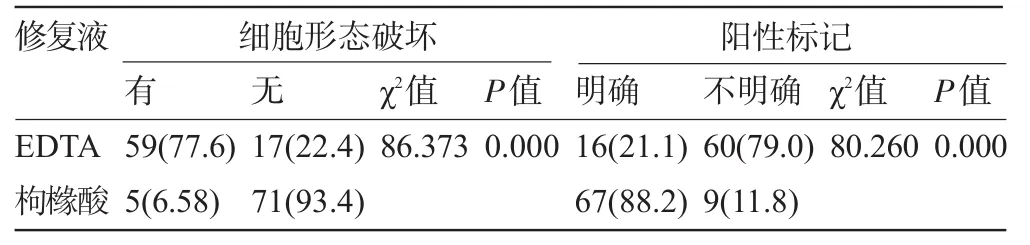
表1两种pH值的抗原修复液修复后的免疫组化染色切片比较[例(%)]
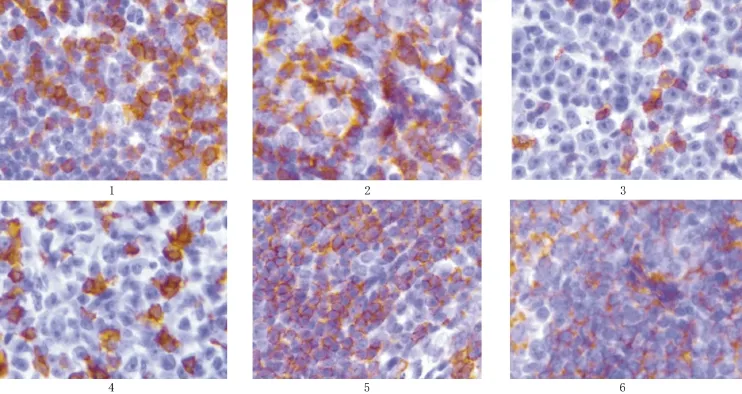
图1 CD3抗体标记,枸橼酸(pH 6.0)高压修复,细胞膜阳性;图2 CD3抗体标记,EDTA(pH 8.0)高压修复,细胞膜阳性弥散;图3 CD5抗体标记,枸橼酸(pH 6.0)高压修复,细胞膜阳性;图4 CD5抗体标记,EDTA(pH 8.0)高压修复,细胞膜阳性弥散;图5 CD20抗体标记,枸橼酸(pH 6.0)高压修复,细胞膜阳性;图6 CD20抗体标记,EDTA(pH 8.0)高压修复,细胞膜阳性弥散。
3 讨 论
在临床病理诊断中,免疫组化染色已经成为一种不可或缺的检测手段,尤其对肿瘤组织的起源、分类和鉴别都发挥了重要的作用。免疫组化染色切片的质量直接影响着病理医生对于染色结果的判读,因此良好的免疫组化染色是正确判断染色结果的基础和前提。然而免疫组化染色过程中的每一个操作环节都有可能对染色结果产生影响,如:组织取材、固定、切片;抗原修复方式、修复温度、修复时间以及修复液的pH值;还包括各种液体的配制、DAB显色等等;有时甚至会因为不同地区的温度、湿度以及水质不同而产生染色差异,因此摸索出适合自己实验室的最佳实验条件,对于稳定免疫组化染色的质量至关重要。
组织标本因为在使用福尔马林固定后蛋白质分子发生交联,造成抗原被遮蔽,因此需要通过抗原修复打开醛基,使抗原决定簇暴露,从而使特异性抗体与之结合[3]。在多种影响免疫组化染色结果的因素中抗原修复被认为是最重要的影响因素之一。不同的抗原修复对于裂解醛-氨基之间交联或蛋白质之间的交联的能力不同,从而使抗原决定簇暴露的程度不同;此外不同抗原对于不同抗原修复方式的敏感性不同,也造成了标记效果不同;甚至相同的抗体不同克隆号在不同的抗原修复方式下与抗原的结合能力也有所不同。因此,一种抗原修复方法不可能同时适用于所有抗原的修复,选用最佳的抗原修复方法尤为重要。最佳的抗原修复方式应在暴露抗原决定簇的效果达到最好的情况下,同时还不会对原有的细胞形态造成影响,在对原有的细胞形态造成影响的情况下,即使是被公认为最好的抗原修复方式在实际工作中应用价值也不大。
目前使用较多的抗原修复液有EDTA修复液和枸橼酸修复液。枸橼酸修复液pH值为6.0,适合于中性福尔马林固定、石蜡包埋组织切片的抗原修复,在高压条件下,其修复效果优于微波修复法和直接煮沸修复法,结果较为稳定,但与EDTA(pH 8.0)抗原修复液相比,对于某些抗体其修复效果相对较弱。早在1995年Shi等[4]就报道了不同pH值抗原修复对免疫组化的影响,并且认为高pH值的高温抗原修复对于大多数的核抗体和胞浆抗体都能取得不错的效果,因此,高pH值高压修复方式,以其时间短、抗原修复效果好和结果稳定等优点,目前被广泛应用于大多数抗原的修复当中。但有文献报道EDTA对组织形态及完整性有一定的破坏作用,加之高压的修复方式,组织形态破坏较为明显[5-6],一直未引起同行的重视。
在海南分院病理科免疫组化实验室条件下,参照所购抗体说明并进行对比实验后,发现大多数抗原使用EDTA(pH 8.0)高压热修复后,可以取得良好的染色效果。但对于富于淋巴细胞的组织,使用EDTA (pH 8.0)抗原修复液进行高压热修复后出现了细胞膜破损情况,主要表现为细胞浆肿胀和细胞膜弥散,细胞界限模糊不清,使阳性标记效果不明确,结果判断困难。经反复多次并多梯队调整高压修复时间和3% H2O2的孵育时间后效果均不明显。本实验采用配对实验,在其他试验条件均相同的情况下对EDTA(pH 8.0)缓冲液和枸橼酸(pH 6.0)缓冲液两种不同pH值的抗原修复液进行高压修复后染色效果的比较,结果发现两组间无论在阳性标记明确与否的比例上,还是细胞浆肿胀和细胞膜弥散现象的发生率上,差异均具有统计学意义(均P=0.000),采用枸橼酸(pH 6.0)抗原修复液进行高压修复后染色,此种现象基本消失,因此我们认为EDTA对于淋巴细胞的形态具有一定程度的破坏性,导致细胞浆肿胀、细胞膜弥散,影响了抗原抗体的结合反应,同时影响了病理医生对于免疫组化切片中组织形态的观察。
有文献指出在EDTA修复液中加入EDTA-2Na可降低EDTA的电离度,达到减轻对组织破坏的作用[5],但操作较为繁琐;另有文献建议使用高pH值水煮的修复方式代替高压修复,但此法相对耗时较长,常规工作中的应用受到了一定程度的限制。因此,在科室工作量、工作模式和免疫组化实验室不变的条件下,对富于淋巴细胞的组织进行免疫组化染色时,为保护细胞形态的完整性,避免影响染色效果,除了对修复条件有特殊要求的抗体外,在采用高温高压抗原修复方式时,建议使用枸橼酸(pH 6.0)修复液来替代EDTA(pH 8.0)修复液[7]。
[1]周小鸽.免疫组织化学染色的干扰因素及其处理[J].临床与实验病理学杂志,2006,22(4):389-392.
[2]骆新兰,林兴滔,罗东兰,等.pH 9.0不同成分的抗原修复液对免疫组织化学染色结果的影响[J].中华病理学杂志,2012,41(3):192-194.
[3]郭 丽,祁 荣,吴 鹏.不同的抗原修复方法在免疫组化染色中的应用[J].沈阳医学院学报,2012,14(3):152-153.
[4]Shi SR,Imam SA,Young L,et al.Antigen retrieval immunohistochem istry under the influence of pH using monoclonal antibodies [J].J Histochem Cytochem,1995,43(2):193-201.
[5]成 娘,刘卫平,李甘地.用EDTA缓冲液做抗原修复增进ER、PR免疫组化染色[J].临床与实验病理学杂志,2001,17(3):274.
[6]范 慧,张 紧,杜德利,等.抗原修复液pH对免疫组化的影响[J].山东医药,2001,12:72-73.
[7]丁 伟,王德田.简明病理学技术[M].杭州:浙江科学技术出版社,2014,1:143-149.
Effects of different pH values of high-pressure antigen retrieval buffers on immunohistochemical staining of lymphoid tissue.
CHEN Wei,GUO Ai-tao,LI Ya-zhuo,SUN Lu.Department of Pathology,Hainan Branch of Chinese PLA General Hospital,Sanya 572013,Hainan,CHINA
ObjectiveTo evaluate the influence of pH values of high-pressure antigen retrieval buffers on immunohistochemical staining of lymphoid tissue.MethodsSeventy-six cases of lymphoid tissue were divided into two groups,which were treated with pH 6.0 citrate buffer(pH 6.0 citrate buffer group)and pH 8.0 EDTA buffer(pH 8.0 EDTA group)by high-pressure repairing.Each cases was stained by antibody CD3,CD5,CD20.ResultsIn the pH 6.0 citrate buffer group,9 cases showed unclear positive markers(including 5 cases of lymphotye injury),and 67 cases reached the diagnostic criteria.Of the pH 8.0 EDTA group,60 cases showed unclear positive marker(including 59 cases of lymphocyte injury),and 16 cases reached the diagnostic criteria.The difference between the two groups was statistically significant(P<0.05).ConclusionUsing pH 8.0 EDTA buffer for high-pressure repairing in immunohistochemical staining often leads to lymphoctye injury,but pH 6.0 citrate buffer could avoid this problem.
Lymphoid tissue;Immunohistochemical staining;Antigen retrieval buffer;EDTA;Citrate
R446.6
A
1003—6350(2015)09—1370—03
10.3969/j.issn.1003-6350.2015.09.0492
2014-11-24)
陈 薇。E-mail:chenweiw12@126.com