电纺壳聚糖与聚乙烯醇纤维膜的生物相容性研究
2015-04-14杨静王永叶川张俊标杨龙孙博刘琴马敏先
杨静,王永,叶川,张俊标,杨龙,孙博,刘琴,马敏先
(1.贵阳医学院,贵州贵阳550004;2.贵阳医学院附属口腔医院,贵州贵阳550004;3.贵阳医学院附属医院骨科,贵州贵阳550004)
电纺壳聚糖与聚乙烯醇纤维膜的生物相容性研究
杨静1,王永2,叶川3,张俊标1,杨龙1,孙博1,刘琴1,马敏先2
(1.贵阳医学院,贵州贵阳550004;2.贵阳医学院附属口腔医院,贵州贵阳550004;3.贵阳医学院附属医院骨科,贵州贵阳550004)
目的制备壳聚糖与聚乙烯醇纤维膜并研究其体外的生物相容性,为应用于临床提供一定的理论依据。方法利用静电纺丝技术制备壳聚糖与聚乙烯醇纤维膜,通过扫描电子显微镜对其超微结构进行表征,采用溶血实验和细胞毒性实验评价其体外生物相容性。结果通过电纺制备的壳聚糖与聚乙烯醇纤维膜,质地均匀,伴有少量的珠状结构,纤维直径在60~300 nm之间,溶血实验显示溶血率为2.80%,无溶血作用,细胞毒性实验中,纤维膜的细胞增殖度为89.96%,细胞毒性为1级,评分合格,无细胞毒性。结论通过静电纺丝法可成功制备壳聚糖与聚乙烯醇纤维膜,生物相容性较好,有望应用于口腔临床中。
静电纺丝;壳聚糖;聚乙烯醇;生物相容性
壳聚糖常存在于虾、蟹的甲壳中,是甲壳素的一种衍生物,也是自然界仅有的带正电荷的天然多糖,其生物相容性好,可降解吸收,具有特别的生物学活性[1],广泛应用于皮肤的敷料、止血材料、药物缓释和组织工程支架等领域[2]。
聚乙烯醇是一种无毒、可降解、有生物亲和性的水溶性高分子,具有成膜性好、无刺激性等优点,是一种很好的生物医用高分子材料,单纯的壳聚糖不能单独纺丝,但是与聚乙烯醇共混以后,可以通过分子间相互的作用,削弱氨基的作用,改善壳聚糖的纺丝性能,从而可以制备较好的纤维。
静电纺丝(以下叫电纺)技术是新发展的一项技术,其制作出的纤维,直径可以达到纳米的级别,具有较高的孔隙率,极大的比表面积,与天然的细胞外基质结构相仿,能够满足细胞的生长、粘附等要求,Dai等[3]认为纳米纤维更有利于细胞的生长。
近年来,种植牙技术发展迅速,在种植术中,骨量充足成为种植牙成功的关键,引导骨组织再生技术(GBR)可以促进骨的修复与形成,其中膜是引导骨组织再生技术中关键的因素,GBR膜的研究为骨组织再生提供了新的技术,已被实验及临床证实可以解决骨量不足的问题[3],GBR膜分为可吸收与不可吸收膜,不可吸收膜具有很好的机械性能,但容易暴露导致感染,可吸收膜易塌陷。本课题采用电纺技术,以钛网作为接收装置,制备壳聚糖与聚乙烯醇复合双层纤维膜,结合可吸收膜与不可吸收膜的优点,解决可吸收膜易塌陷及不可吸收膜易暴露的缺点,本实验为前期阶段,探讨所制备的壳聚糖与聚乙烯醇纤维膜的体外生物相容性。
1 材料与方法
1.1 主要材料与设备静电纺丝机(清华大学提供),MTS试剂(Promega公司);扫描电子显微镜;酶标仪。
1.2 方法
1.2.1 壳聚糖与聚乙烯醇纤维膜的制备将壳聚糖溶液与聚乙烯醇溶液混合,静置过夜,常温保存待用,将装有两种混合液的注射器放入注射泵中,调节电压至14 kV,推注速度为0.1 ml/min,接收距离设置为20 cm,用锡箔纸来接收纤维膜。
1.2.2 壳聚糖与聚乙烯醇纤维膜的扫描电子显微镜扫描电子显微镜下观察其纤维形态,用ImageJ软件测量电镜图中的纤维直径,每个样品的电镜图随机取40根纤维计算其平均的直径。
1.2.3 纤维膜的溶血实验抽取10 ml新鲜兔血,立即加入含有2%草酸钾抗凝剂的试管中,从中抽取4 ml抗凝兔血,加入5 ml生理盐水稀释,制备成稀释的抗凝兔血。将实验分为三组:(1)实验组:各取5个样本膜,分别放入5个分别装有10 ml的生理盐水的离心管中完全浸泡;(2)阴性对照组:在5个离心管内分别加入10 ml生理盐水;(3)阳性对照组:在5个离心管内分别加入10 ml蒸馏水。将上述三组离心管置于温度为(37±1)℃的恒温水浴中保温30 min,然后在每个离心管内分别各加入0.2 ml已制备好的稀释抗凝兔血,混合均匀,继续在(37±1)℃恒温水浴中保温60 min。取出所有离心管,离心后吸取上清液3 ml,置于分光光度计比色皿中,用分光光度计测定波长为545 nm时的吸光度值,并记录结果,5个平行样吸光度值的平均值为其吸光度值(阳性对照组吸光度值应为(0.8±0.3),阴性对照组吸光度应<0.03),溶血率=(实验组吸光度值-阴性对照组吸光度值)/(阳性对照组吸光度值-阴性对照组吸光度值)×100%,阴性对照组的吸光值应为(0.8±0.3),阳性对照组的吸光值应<0.03,若材料的溶血率<5%,证明材料无溶血作用,符合材料的溶血要求。若材料的溶血率>5%,则提示材料有溶血作用。
1.2.4 细胞毒性实验根据6 cm2表面积加1 ml细胞培养液的标准制取材料浸出液,37℃提取48 h,4℃保存待用。提取第三代人骨髓间充质干细胞,用胰酶消化为细胞悬液,将细胞密度调整为1×104/ml,接种于96孔板中,接种1 d后待细胞贴壁后去上清液,于每孔加入材料提取液100 μl,阴性对照组每孔加入100 μl细胞培养液;空白对照组不接种细胞,加入100 μl细胞培养液,以校正OD值。于第2天向每孔加入20 μl MTS溶液,继续放入37℃培养箱4 h后,用酶标仪读取490 nm处的吸光度值,计算出细胞相对增殖度(RGR),RGR=实验组平均OD值/阴性对照组平均OD值×100%,算出的RGR,按表1美国药典对材料细胞毒性的评分标准评价材料的细胞毒性。

表1 RGR评分标准
1.3 统计学方法实验数据采用SPSS17.0进行统计学分析,多组之间计量资料采用单因素方差分析,组间两两比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 壳聚糖与聚乙烯醇纤维膜大体观如图1所示,通过电纺法制得的壳聚糖与聚乙烯醇纤维膜不透明,各处厚度比较均匀,约为0.3 mm,有一定的强度和韧性,拉伸不易断裂,有一定的弹性形变。

图1 电纺壳聚糖与聚乙烯醇纤维膜
2.2 壳聚糖与聚乙烯醇纤维膜的扫描电镜电镜下可见膜表面较平整,纤维直径粗细不一,软件分析后可知纤维直径60~300 nm,平均为140 nm,为纳米级结构。
2.3 溶血实验各组试验吸光度值和根据公式计算的溶血率如表2所示,纤维膜的溶血率为2.80%,符合《医疗器械生物学评价标准GB/T16886》中规定的5%。

图2 电镜观察电纺壳聚糖/聚乙烯醇纤维膜(a:×10 000,b:×8 000)

表2 溶血实验结果(n=5)
2.4 细胞毒性实验实验结果显示细胞保持正常形态、贴壁、增殖良好,根据毒性分级,RGR为89.86%,为1级,评分为合格,证明电纺壳聚糖与聚乙烯醇纤维膜无明显细胞毒性,见表3。
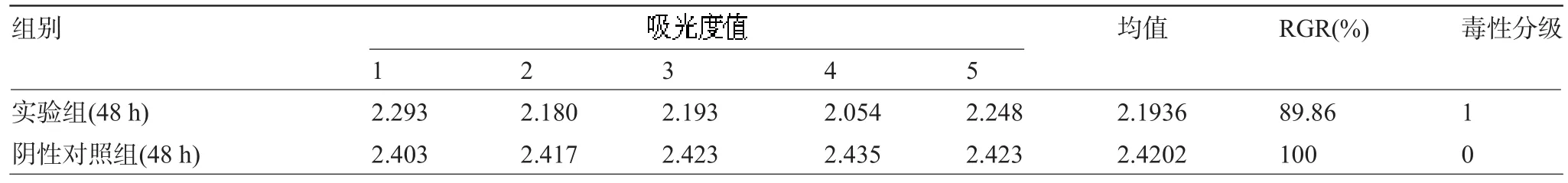
表3 MTS实验结果
3 讨论
电纺是一种比较新的制备纳米纤维的技术,指的是通过高压电场使聚合物溶液带电,当液体表面产生的电场力大于其表面张力时形成射流,溶剂挥发后在接收装置上形成连续纤维的一种方法[5]。电纺制备的纤维和传统的方法比较,具有较大的比表面积和高孔隙率,更接近细胞外基质,广泛应用于组织工程领域[6]。壳聚糖是一种已经广泛应用于医学领域的原料料,纯的壳聚糖难以单独纺丝,复合聚乙烯醇以后分子之间形成了氢键,减弱了壳聚糖中氨基的作用,可以成功纺出丝来,而且加入了聚乙烯醇还可以增加纤维膜的力学性能。
通过电纺制备出的壳聚糖/聚乙烯醇纤维膜,直径范围在60~300 nm,纳米级别的纤维膜更能促进细胞的粘附和生长。
材料的血液相容性评价是材料生物学评价的重要组成部分,理想的生物膜材料必须满足无毒且具有良好的生物相容性,溶血实验主要用于材料的体外急性溶血性能评价。其原理为:材料与血液接触后其溶血成分可以导致红细胞中的血红蛋白释放出来,游离血浆血红蛋白增加,从而对机体产生不利的作用,通过这种方法,可以检测材料的可溶性或者释放性成分的溶血性能及材料表面的溶血性能。壳聚糖与聚乙烯醇已经广泛用于医学领域,生物相容性很好,但在电纺的过程中纤维膜是否有溶剂的残留导致溶血,需要进一步检测。因此本实验根据有关牙科材料的要求,对壳聚糖与聚乙烯醇纤维膜进行了溶血实验,制备的纤维膜溶血率为2.80%,远小于国家标准中的5%,该纤维膜无急性溶血作用,符合生物材料学要求。
生物材料生物相容性评价中MTS细胞毒性试验是检测材料毒性比较敏感的指标,可以用材料浸提液与细胞共同培养研究材料的毒性,此方法更直接和敏感[7]。MTS实验结果表明用材料提取液培养细胞,细胞可以正常的增殖,细胞增殖度评分为1级,说明该纤维膜无明显细胞毒性,符合ISO10993中对体内植入材料的要求。
目前,生物医学材料安全性评价主要是采用医疗器械生物学的评价体系,也就是国家标准(GB/T) 16886系列标准,本实验选择了溶血作用、细胞毒性实验来评价该膜的体外生物相容性。
本实验结果显示,通过电纺可以成功制备壳聚糖/聚乙烯醇纤维膜,该膜无急性溶血作用,无明显细胞毒性,有一定的应用前景,但本研究属于基础的研究,还需要后续体内实验进行更深的探索和研究。
[1]车小琼,孙庆申,赵凯.甲壳素和壳聚糖作为天然生物高分子材料的研究进展[J].高分子通报,2008,2∶45-49.
[2]You Y,Youk JH,Lee SW,et al.Preparation of porous ultrafine PGA fibers via selective dissolution of electrospun PGA/PLA blend fibers[J].Mater Letters,2006,60∶757-760.
[3]Dai TY,Chen K,Qing XT,et al.Sequential polymer precipitation of core/shell microstructured composites with giant permittivity[J]. Macromolecular Rapid Communications,2010,31(5)∶484-489.
[4]Urban IA.Vertical ridge augmentation using guided bone regeneration(GBR)in three clinical scenarios prior to implant placement∶A retrospective study of 35 patients 12 to 72 months after loading[J]. Int J Oral Maxillofac Implants,2009,24(3)∶502-510.
[5]Li D,Xia YN.Electrospinning of nanofibers∶Reinventing the wheel [J].Adv Mater,2004,16(14)∶1151-1170.
[6]Yoshimoto H,Shin YM,Terai H,et al.A biodegradable nanoifber scaffold by electrospinning and its potential for bone tissue engineering[J].Biomaterials,2003,24(12)∶2077-2082.
[7]李玉宝.生物医学材料[M].北京∶化学工业出版社,2003∶20-25.
Study on the biocompatibility of electrospun chitosan/poly(vinyl alcohol)fiber membrane.
YANG Jing1,WANG Yong2,YE Chuan3,ZHANG Jun-biao1,YANG Long1,SUN Bo1,LIU Qin1,MA Min-xian2.1.Guiyang Medical College, Guiyang 550004,Guizhou,CHINA;2.Stomatological Hospital Affiliated to Guiyang Medical College,Guiyang 550004, Guizhou,CHINA;3.Department of Orthopedics,the Affiliated Hospital of Guiyang Medical College,Guiyang 550004, Guizhou,CHINA
ObjectiveTo prepare of chitosan/poly(vinyl alcohol)fiber membrane and to explore the biocompatibility in vitro,in order to provide certain theoretical basis for clinical application.MethodsThe chitosan/poly(vinyl alcohol)fiber membrane was prepared by electrospinning technique.Its ultrastructure was characterized by scanning electron microscope(SEM),and its in vitro biocompatibility was studied with hemolysis test and cytotoxicity test.ResultsThe chitosan/poly(vinyl alcohol)fiber membrane prepared was found to have a good appearance and homogenous fibers,with a little beads and the diameter of 60~300 nm in average.The hemolysis rate was 2.8%,which means no hemolysis.The cell relative growth rate of the fiber membrane was 89.86%,with the cytotoxicity of gradeⅠ,which indicated no cytotoxicity.ConclusionThe chitosan/poly(vinyl alcohol)fiber membrane can be prepared by the electrospinning technique successfully,with good biocompatibility,which is expected to be applied in oral clinical practice.
Electrospinning;Chitosan;Poly(vinyl alcohol);Biocompatibility
R318
A
1003—6350(2015)12—1719—03
2015-01-12)
贵州省科技厅联合基金(编号:M2012-22)
马敏先。E-mail:mahe2005919@hotmail.com
