伴微浸润的乳腺导管内癌术后不同辅助化疗方案对患者预后的影响
2015-04-14王玲,王勇
王 玲,王 勇
(1.襄阳市中心医院普外一科,湖北 襄阳 441021;2.宜城市人民医院普外科,湖北 襄阳 441400)
伴微浸润的乳腺导管内癌术后不同辅助化疗方案对患者预后的影响
王 玲1,王 勇2
(1.襄阳市中心医院普外一科,湖北 襄阳 441021;2.宜城市人民医院普外科,湖北 襄阳 441400)
目的 探讨伴微浸润的乳腺导管内癌术后辅助化疗对患者预后的影响。方法将我院肿瘤科2003年12月至2008年12月收治的50例乳腺导管内癌术后患者根据化疗方案分为CEF组(28例,采用CEF方案)和FPC组(22例,采用FPC方案),FPC方案为5-氟尿嘧啶+吡喃阿霉素+环磷酰胺,CEF方案为环磷酰胺+表柔比星+5-氟尿嘧啶+多西他赛,比较两组患者化疗期间的毒副反应及5年生存情况差异。结果CEF组与FPC组仅血液系统毒性、皮肤黏膜系统损伤、心脏毒性发生率比较差异具有统计学意义(P<0.05),CEF组的上述不良反应发生率显著低于FPC组;消化系统毒性、神经系统毒性、生殖系统毒性发生率在两组中比较差异均无统计学意义(P>0.05)。CEF组的无病生存中位期为41个月,FPC组为36个月,两组患者的无病生存中位期比较差异无统计学意义(P>0.05);CEF组的生存中位时间为51个月,FPC组为46个月,两组患者的中位生存时间比较差异无统计学意义(P>0.05)。结论伴微浸润的乳腺导管内癌术后患者采用CEF方案进行辅助化疗较FPC方案的毒副反应发生率低,但是对患者的无病生存时间及总的生存时间不会显著延长。
乳腺导管内癌;辅助化疗;预后
乳腺癌作为我国女性中发病率第一的恶性肿瘤,其发病率正呈逐年上升趋势[1],而伴微浸润的乳腺导管内癌虽病情较轻,但仍属于浸润性乳腺癌中最常见而且预后较差的病理类型,因此,其术后辅助治疗及预后受到了越来越多的关注。而CEF及FPC作为乳腺辅助治疗中应用较广泛的治疗方案,其疗效较为肯定,并成为乳腺辅助治疗的标准治疗方案[2]。为寻找乳腺癌术后辅助治疗的更有效的方案,笔者使用表柔比星和多西他赛代替吡喃阿霉素组成CEF方案应用于乳腺导管内癌手术后的辅助化疗方案,对其远期疗效以及预后进行观察,并与FPC方案进行对比,现将结果总结报道如下:
1 资料与方法
1.1 一般资料 本研究选取我院肿瘤科2003年12月至2008年12月收治的50例乳腺导管内癌术后患者。纳入标准:①患者确诊均经过临床医生检查及术前术后的病理检查确诊;②均接受乳腺癌手术治疗;③均为初治乳腺癌患者,之前未接受化疗治疗;④病理分型均为侵润性导管癌或小叶癌,Karnofsky评分均在90分以上。预计生存时间>3个月。排除标准:生存时间小于3个月的患者,肝肾功能严重障碍的患者,对本次研究的化疗方案严重不耐受的患者。本次研究共纳入50例研究对象,CEF组28例,年龄29~64岁,平均(56.7±8.2)岁,乳腺癌根治手术21例,其他7例。FPC组22例,年龄27~66岁,平均(54.2±9.8)岁,乳腺癌根治手术17例,其他5例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 化疗方法 两组患者于化疗前尽可能留置中心静脉导管,并静脉滴注盐酸格拉司琼3 mg进行镇吐治疗。FPC方案组术后给予FPC方案进行术后辅助化疗:吡喃阿霉素40 mg/m2静脉推注,每日1次;5-氟尿嘧啶500 mg/m2静脉滴注,每日1次;环磷酰胺500 mg/m2静脉注射,每日1次。CEF方案组术后给予CEF方案进行术后辅助化疗:环磷酰胺500 mg/m2静脉滴注,每日1次;表柔比星60 mg/m2静脉滴注,每日1次;5-氟尿嘧啶500 mg/m2静脉滴注,每日1次;多西他赛75 mg/m2静脉滴注,每日1次。两种方案的治疗周期均为3~4周,共4~6个周期。化疗期间对两组患者的消化系统毒性、血液系统毒性、皮肤黏膜系统损伤、神经系统毒性、心脏毒性、生殖系统毒性等毒副反应进行观察与对比,并比较两组患者5年生存情况差异。化疗药物的毒副反应评价参照WHO抗癌药物急性毒性以及亚急性毒性分级标准[3]。
1.3 随访 随访起始时间为患者入院经过病理学明确诊断后,随访方式主要通过上门体检、信件、电话等方式。随访观察内容主要是了解患者化疗期间的不良反应发生情况,不良反应主要根据WHO评定标准分为0~IV级。观察记录两组患者的5年无病生存期及总生存率;无病生存期定义为化疗结束至首次复发的时间,总生存率定义为化疗结束至死亡时间,死亡原因与乳腺癌疾病有关。
1.4 统计学方法 所有收集数据录入Excel 2003,在SPSS10.0中进行统计分析。计量资料以均数±标准差(±s)表示,采用两独立样本t检验、计数资料采用χ2检验,生存分析采用K-M法,组间比较采用log-Rank检验,检验水准取α=0.05。
2 结果
2.1 两组患者的不良反应比较 CEF化疗方案的消化系统毒性、血液系统毒性、皮肤黏膜系统损伤、神经系统毒性、心脏毒性、生殖系统毒性发生率均低于FPC化疗方案组,但是CEF化疗方案与FPC化疗方案仅血液系统毒性、皮肤黏膜系统损伤、心脏毒性发生率比较差异具有统计学意义(P<0.05);消化系统毒性、神经系统毒性、生殖系统毒性发生率在两组化疗方案见比较差异均不具有统计学意义(P>0.05),见表1。
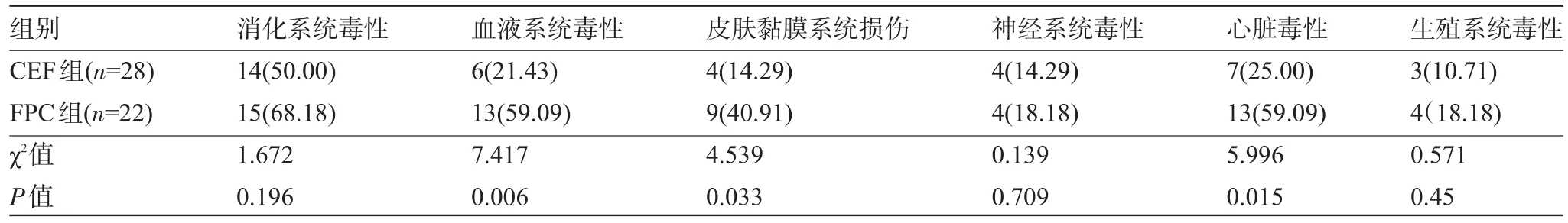
表1 两种化疗方案的不良反应比较[例(%)]
2.2 两种化疗方案的五年无病生存期及总生存率比较 CEF组的无病生存中位期为41个月,FPC组的无病生存中位期为36个月,两组患者的无病生存中位期比较差异无统计学意义(χ2=0.415,P=0.510>0.05);无病生存函数图详见图1。CEF组的中位期为51个月,FPC组的中位期为46个月,两组患者的中位生存期比较差异不具有统计学意义(χ2=0.848,P= 0.357>0.05);中位生存期函数图见图2。
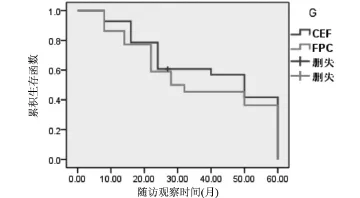
图1 两组患者无病生存中位期函数图
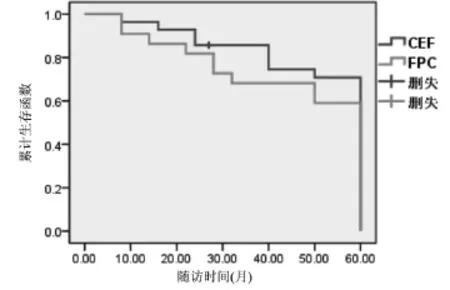
图2 两组患者的中位生存时间函数图
3 讨论
乳腺癌病理诊断中的“微浸润”,WHO将伴有微浸润性癌定义为一种非特化的小叶间质中存在一处或者多处的离散型小病灶浸润并以非浸润性癌为主的肿瘤[4]。作为一种发病率较高的全身性疾病,伴微浸润的乳腺导管内癌目前主要采用手术治疗,并辅以相应的放、化疗,内分泌治疗以及生物靶向治疗等[5]。而CEF作为乳腺辅助治疗中应用较广泛的治疗方案,其疗效较为肯定,并成为乳腺辅助治疗的标准治疗方案。乳腺癌化疗中最常用到的蒽环类药物在早期乳腺癌手术前、后辅助治疗以及复发转移解救治疗中都起到了非常大的作用[6]。本研究中CEF方案内用到的表柔比星较FPC方案中的阿霉素相比毒性更低,对于能够耐受化疗但却患有心脏基础疾病的患者,我们应该尽量选用CEF方案以减少蒽环类药物对患者心脏造成的损伤[7]。而FPC方案在晚期乳腺癌的治疗中显示出了较好的疗效以及安全性,其治疗有效率通过随机对照试验证实要优于同样治疗乳腺癌的FAC化疗方案[8]。表柔比星作为治疗乳腺癌的一线治疗药物,其治疗效果与剂量呈明显的相关性,故在临床治疗时剂量范围波动较大[9]。调查结果表明,CEF较FPC的优势在于,60 mg/m2的表柔比星与420 mg/m2的表柔比星产生的血液毒性是相同的,而适当增加CEF方案中的表柔比星含量(50~100 mg/m2)可以使疗效显著提高,而相同比例增加吡喃阿霉素的含量,除了个别患者出现耐受性外,并不能使治疗效果得到改善[10]。
本研究通过对50例乳腺导管内癌术后患者应用CEF以及FPC辅助化疗方案进行治疗与分析,并对伴微浸润的乳腺导管内癌术后辅助化疗对患者预后的影响进行探讨。结果显示,CEF化疗方案的消化系统毒性、血液系统毒性、皮肤黏膜系统损伤、神经系统毒性、心脏毒性、生殖系统毒性发生率均低于FPC化疗方案组,但是仅血液系统毒性、皮肤黏膜系统损伤、心脏毒性发生率比较差异具有统计学意义,消化系统毒性、神经系统毒性、生殖系统毒性发生率在两组化疗方案见比较差异无统计学意义,证实伴微浸润的乳腺导管内癌术后患者采用CEF方案进行辅助化疗较FPC方案的的毒副反应发生率低。CEF及FPC化疗方案组的无病生存中位期分别为41.295个月、36.727个月,CEF及FPC化疗方案组总生存期的中位期为51.391个月、46.364个月,差异不具有统计学意义,这一结果和相关文献报道的数据相一致。因此,我们认为,对于伴微浸润的乳腺导管内癌术后患者的辅助治疗,CEF方案与FPC方案的无病生存时间及总的生存时间虽相近,但仍需考虑患者的毒副反应而尽量选用CEF方案,以降低患者的毒副反应发生率。但由于本研究是个小样本研究,且随访时间相对较短,实验结果可能具有一定的局限性,可在今后的工作和研究中通过加大样本量和延长随访时间得到改善,还可以在收集资料时,关注患者住院期间的费用情况,并通过药物经济学进行药物成本-效果分析,以最经济的方式选择更好的辅助治疗方案。
综上所述,伴微浸润的乳腺导管内癌术后患者采用CEF方案进行辅助化疗较FPC方案的的毒副反应发生率低,但是对患者的无病生存时间及总的生存时间不会显著延长,在今后的治疗过程中可以根据患者的具体情况选用具体的方案进行治疗。
[1]康 敏,赵 莹,黄 源,等.不同乳腺癌筛查方案在中国女性中的准确性评价和筛查直接医疗成本初步估计[J].中华肿瘤杂志, 2014,36(3):236-140.
[2]徐有富,唐 川.TEC与CEF方案在乳腺癌术前化疗中的疗效对比研究[J].中国普外基础与临床杂志,2011,24(4):50-51.
[3]肖 寒,申小苏,方乃青,等.吉非替尼联合XELOX方案化疗治疗转移性大肠癌的临床观察[J].现代肿瘤医学,2012,20(11): 2354-2357.
[4]秦春新,秦丽鑫,杨 敏.乳腺导管原位癌伴微浸润36例临床分析[J].泰山医学院学报,2012,33(12):845-848.
[5]汤永峰,冯晓敏,谢莉莉.浸润性乳腺癌PTEN、p53、EGFR与ER、PR及HER-2表达的关系[J].海南医学,2014,25(5):630-633.
[6]田南南,杨建新.miR-146a在乳腺浸润性导管癌中的表达及临床意义[J].海南医学,2013,24(24):3599-3601.
[7]Li JH,Tang XE,Huang CG,et al.Clinical comparison on the safety and efficacy of fluorouracil/pirarubicin/cyclophosphamide(FPC) with fluorouracil/epirubicin/cyclophosphamide(FEC)as postoperative adjuvant chemotherapy in breast cancer[J].Asian Pac J Cancer Prev,2011,12(7):1795-1798.
[8]乔 红,黄新恩,唐金海,等.FPC与FEC方案作为乳腺癌术后辅助化疗方案的临床比较分析[J].肿瘤基础与临床,2010,23(2): 132-134.
[9]Joerger M,Thunrlimann B,Savidan A,et al.A population-based on the implement-tation of treatment recommendations for chemotherapy in early breast cancer[J].Clinical Breast Cancer,2011,12(2): 102-109.
[10]阮寒光,熊 娟,邬 蒙,等.TAC与TP方案治疗三阴性乳腺癌的临床观察[J].临床肿瘤学杂志,2013,18(2):133-136.
R737.9
B
1003—6350(2015)10—1492—03
10.3969/j.issn.1003-6350.2015.10.0531
2014-10-23)
湖北省自然科学基金(编号:2010ABA115)
王 勇。E-mail:doufuowang@163.com
