误诊为分离转化障碍的胰岛素瘤一例
2015-04-14林嘉欣
林嘉欣,冯 烈
(暨南大学附属第一医院内分泌科,广东 广州 510632)
误诊为分离转化障碍的胰岛素瘤一例
林嘉欣,冯 烈
(暨南大学附属第一医院内分泌科,广东 广州 510632)
胰岛素瘤;功能性胰腺内分泌肿瘤;胰岛B细胞;精神症状
胰岛素瘤(Insulinoma)为最常见的功能性胰腺内分泌肿瘤,其来源于胰岛B细胞,是器质性低血糖症中最常见原因。由于胰岛素瘤所致低血糖可引起脑功能障碍,近年国内外对以精神症状为首发的胰岛素瘤的报道逐渐增多,常误诊为癫痫、癔症、精神病等。我科收入一例胰岛素瘤患者,现报道如下:
1 病例简介
患者陈某,43岁女性,因“眠差、言行异常一个月”于2014年4月1日入住我院精神心理科。患者1个月前无明显诱因下出现眠差,入睡后大汗,下午4~6时常有困感,并出现言行异常,曾出现跌倒,胡言乱语,一过性意识丧失,曾于外院诊断为“癔症”。患者为工人,平素容易焦虑。既往史、家族史无特殊。入院查体:神志清楚,时间、地点、人物及自我定向力完整。对答切题,思维连贯。未引出幻觉、妄想。情绪焦虑不安,无情感倒错及病理性激情。心肺腹无明显异常。入院诊断为“精神异常查因:分离转化障碍?”,予“利培酮”、“氯硝安定”等心境稳定剂和助眠药物治疗。4月10日患者出现发作性意识丧失,胡言乱语,测指尖血糖1.8 mmol/L,予口服补糖后意识恢复,复测血糖9.2 mmol/L。随即转入内分泌科,4月10日晚上再次出现上述症状,测静脉血糖:2.00 mmol/L,胰岛素:43.12 mU/L,胰岛素释放指数(IRI/BG)为1.2,补糖后症状迅速缓解。4月11日行OGTT示:胰岛素曲线明显抬高(图1)。形态学检查:腹部B超,近胰尾处可见一类圆形低回声光团,大小约1.4 cm×1.6 cm,边界尚清。经超声胃镜检查示:胰尾部低回声占位(图2)。胰腺动脉DSA造影示:胰体异常供血灶。结合上述检查,考虑胰岛素瘤可能性大,于4月25日行胰体尾切除术,术中触诊及超声提示肿物位于胰体部,其余未发现肿物。并多次术中查血糖、胰岛素及C肽(表1)。术后病理示:胰体部(1.5 cm×1.4 cm×1 cm)肿瘤,符合高分化内分泌肿瘤,良性行为(图3)。术后患者症状缓解,空腹血糖波动于5.8~7.1 mmol/L之间,随机血糖波动于6~9.3 mmol/L之间。
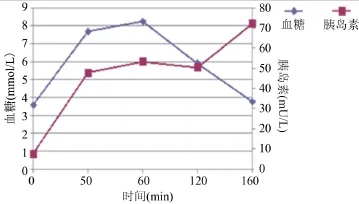
图1 口服葡萄糖耐量OGTT试验

图2 超声内镜示胰尾部低回声占位(交通)

图3 组织标本HE染色(×100)

表1 患者血糖、胰岛素、C肽及胰岛素释放指数
2 讨论
胰岛素瘤在普通人群的年发病率为1~4/100万,占所有胰腺肿瘤的1%~2%。已报道的胰岛素瘤90%为孤立性,大于90%位于胰腺腺体内,90%的胰岛素瘤直径小于2 cm[1]。胰岛素瘤的发病机制尚未明确,目前发现与MEN1基因、染色体的杂合缺失和基因异常、Rap1/B-Raf的过度表达、端粒酶活性增高等有关[2]。
胰岛素瘤临床主要表现为低血糖症:交感神经兴奋表现为出汗、心悸、乏力等;脑功能障碍表现为嗜睡、记忆力减退、行为异常等。研究表明,低血糖脑损害主要发生在葡萄糖再灌注时期,谷氨酸受体激活、超氧化物的产生、聚腺苷酸二磷酸核糖转移酶-1的过度激活、葡萄糖再灌注过程中一氧化氮和锌离子的释放可引起大脑神经元的死亡,从而出现不同程度的脑功能障碍表现[3]。由于胰岛素瘤患者长期出现发作性低血糖,神经系统症状较常见,易误诊为脑血管疾病、精神心理疾病。本例患者以言行异常、一过性意识丧失等神经、精神症状为首发表现,发作间歇未见异常,且存在心理因素的巧合,一开始误诊为“分离转化障碍”。故临床上出现发作性神经、精神症状,特别是精神、神经科治疗无效时,应注意监测血糖,警惕胰岛素瘤可能,避免漏诊、误诊。
定性诊断:(1)典型的Whipple三联征;(2)空腹血清胰岛素>25 mU/L;(3)胰岛素释放指数(IRI/G):血浆胰岛素(mU/L)与同步血糖(mg/dl)比值>0.3;(4)48~72 h饥饿试验:对于症状不典型的疑似患者,患者饥饿后出现低血糖症状并满足以下6条即可诊断:血糖≤2.22 mmol/L、胰岛素水平≥6 mU/L、C肽水平≥200 pmol/L、胰岛素原水平≥5 pmol/L、β-羟丁酸≤2.7 mmol/L、血/尿中无磺脲类药物的代谢产物[4]。(5)血清嗜铬粒蛋白(ChromograninA,CgA):升高提示预后较差。(6)需检查血胃泌素、血钙、血催乳素、甲状旁腺素等激素水平,以排除多发性内分泌肿瘤Ⅰ型(MEN-1)合并胰岛素瘤的情况。
胰岛素瘤的定位诊断方法可分为两类。无创性检查:腹部超声对胰岛素瘤敏感性较低,为25%~70%[5],可作为初筛手段。CT联合MRI的灵敏度可达75%~79%。超声内镜(EUS)术前定位有更高的灵敏度,有报道认为,螺旋CT联合EUS或联合超声内镜下的细针穿刺活检对胰岛素瘤诊断的敏感性可高达100%[6]。有创性检查手段包括选择性动脉血管造影、选择性动脉内刺激试验(ASVS)、经皮经肝门静脉分段采血测定激素水平(PTPC)等。但其检查方法复杂、难度大、患者耐受性差等,加上无创检查的敏感性高,目前在国内外已被逐渐淘汰。
胰岛素瘤最为有效的治疗方法为手术。值得注意的是,术中监测血糖、胰岛素可为判断肿瘤是否完整切除提供可靠依据,亦是排除多发性胰岛素瘤的重要参考指标。目前有报道示超声引导下行针刺注射无水酒精亦可作为治疗手段之一[7]。
胰岛素瘤有10%为恶性,5%为MEN-1合并胰岛素瘤,所以应该长期随访。中国胃肠胰神经内分泌肿瘤专家共识建议[4],患者在完全切除术后3~6个月开始随访,每6~12个月1次,至少需随访7年。随访内容至少应包括病史、体格检查、血清CgA、CT或MRI检查。
[1]Okabayashi T,Shima Y,Sumiyoshi T,et al.Diagnosis and management of insulinoma[J].World J Gastroenterol,2013,19(6): 829-837.
[2]成兰云,许世清,张文健,等.胰岛素瘤的研究进展[J].中国医药生物技术,2013,8(4):285-288.
[3]王喜云,赵玉武.低血糖脑损害机制的研究[J].脑与神经疾病杂志,2014,22(1):71-74.
[4]CSCO神经内分泌肿瘤专家委员会.中国胃肠胰神经内分泌肿瘤专家共识[J].临床肿瘤学杂志,2013,18(9):815-832.
[5]王春友.胰腺内分泌肿瘤分类及其诊治中若干问题[J].中国实用外科杂志,2010,30(9):736-739.
[6]Philips S,Shah SN,Vikram R,et al.Pancreatic endocrine neoplasms:a current update on genetics and imaging[J].Br J Radiol, 2012,85(1014):682-696.
[7]Levy MJ,Thompson GB,Topazian MD,et al.US-guided ethanol ablation of insulinomas:a new treatment option[J].Gastwintest Endosc,2012,75(1):200-206.
R736.7
D
1003—6350(2015)06—0926—02
10.3969/j.issn.1003-6350.2015.06.0332
2014-11-05)
冯 烈。E-mail:Dr_fengl@163.com
