伏立康唑雾化吸入对侵袭性肺曲霉病患者细胞因子及肺纤维化的影响
2015-04-14张贵宁危之屏叶明霞
张贵宁,危之屏,叶明霞
(1.深圳市眼科医院药剂科,广东 深圳 518040;2.北京大学深圳医院药剂科,广东 深圳 518036;3.北京大学深圳医院呼吸内科,广东 深圳 518036)
伏立康唑雾化吸入对侵袭性肺曲霉病患者细胞因子及肺纤维化的影响
张贵宁1,危之屏2,叶明霞3
(1.深圳市眼科医院药剂科,广东 深圳 518040;2.北京大学深圳医院药剂科,广东 深圳 518036;3.北京大学深圳医院呼吸内科,广东 深圳 518036)
目的 探讨伏立康唑雾化吸入对侵袭性肺曲霉病(IPA)患者细胞因子及肺纤维化的影响。方法选择2010年1月至2013年12月期间我院收治的68例IPA患者为研究对象,将其随机分为观察组和对照组。观察组36例患者给予伏立康唑雾化吸入,对照组32例患者给予伏立康唑静脉滴注治疗。比较两组患者的治疗效果,血清IL-6、IL-8、TNF-α水平以及肺总量(TCL)、一氧化碳弥散量(DLco)和血氧饱和度(SaO2)。结果观察组有效率为86.11%,优于对照组的65.63%,差异有统计学意义(P<0.05)。治疗后两组TCL、DLco、SaO2均较治疗前明显改善(P<0.05),但观察组TCL、DLco、SaO2改善幅度大于对照组(P<0.05)。观察组治疗后血清TNF-α水平明显较治疗前降低(P<0.05),也明显低于同期对照组(P<0.05)。观察组治疗后血清IL-8、IL-6水平明显较治疗前降低(P<0.05),也明显低于同期对照组(P<0.05)。对照组治疗后血清TNF-α、IL-8、IL-6水平低于治疗前(P<0.05)。观察组和对照组不良反应发生率分别为8.33%和6.25%,差异无统计学意义(P>0.05)。结论伏立康唑雾化吸入用于IPA的治疗,可有效改善患者肺纤维化程度,抑制炎症反应,临床疗效佳,且不良反应轻。
侵袭性肺曲霉病;伏立康唑;雾化吸入;肺纤维化;细胞因子

侵袭性肺曲霉病(IPA)可由曲霉病菌感染所致,随着近年来抗生素及免疫抑制剂的大量使用,其发病率有增高趋势[1]。目前IPA的治疗以抗真菌治疗为主,由于曲霉菌对常用抗真菌药物耐药,因此研发出新型抗真菌药物对于IPA的防治具有重要价值[2]。伏立康唑是一种新型三唑类抗真菌药,对耐药类曲霉菌群具有很强的抗菌活性[3-6]。本研究通过观察伏立康唑雾化吸入对IPA患者治疗前后细胞因子及肺纤维化的影响,旨在探讨伏立康唑雾化吸入治疗IPA的效果及临床价值。
1 资料与方法
1.1 一般资料 选择2010年1月至2013年12月在北京大学深圳医院住院治疗的68例IPA患者为研究对象,年龄22~85岁。将68例患者随机分为观察组和对照组。观察组36例中男性24例,女性12例,给予伏立康唑雾化吸入;对照组32例中男性22例,女性10例,给予伏立康唑静脉滴注治疗。68例患者肺部病灶均经组织活检检测出曲霉菌丝,且存在相关组织损害,最终确诊为IPA。两组患者的基本资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者的基本资料比较(例,±s)
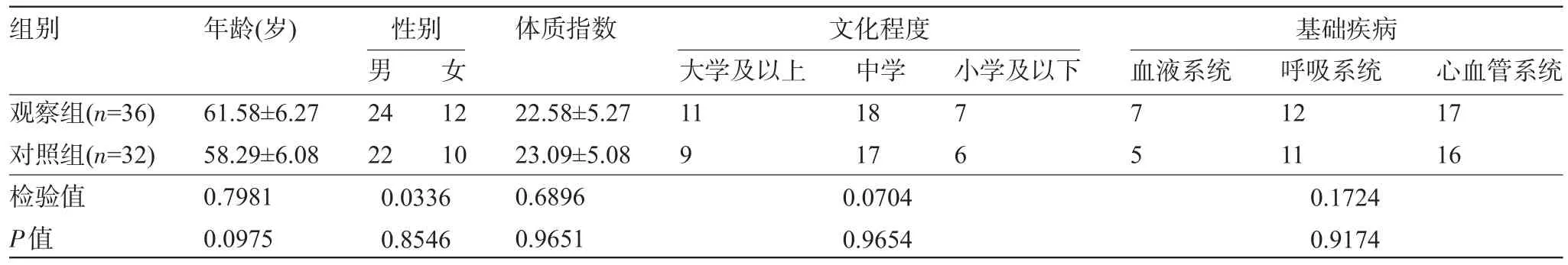
表1 两组患者的基本资料比较(例,±s)
组别年龄(岁)性别 文化程度 基础疾病体质指数男女小学及以下 血液系统观察组(n=36)对照组(n=32)检验值P值61.58±6.27 58.29±6.08 0.7981 0.0975 24 22 12 10大学及以上11 9中学18 17 76 75 22.58±5.27 23.09±5.08 0.6896 0.9651呼吸系统12 11心血管系统17 16 0.0336 0.8546 0.0704 0.9654 0.1724 0.9174
1.2 纳入标准
1.2.1 纳入标准 符合IPA的诊断标准;有曲霉感染病史;依从性佳;患者知情同意。
1.2.2 排除标准 细菌感染为主且感染控制不佳;病毒感染为主且感染控制不佳;有精神疾病者;严重肝肾疾病;抗真菌药治疗不规范;疗程少于1周者;未完成随访者。
1.3 方法
1.3.1 观察组 给予伏立康唑雾化吸入:400 mg伏立康唑(50 mg/支,生产厂家:珠海亿邦制药有限公司,批号:H20058964)溶于250 ml 0.9%氯化钠注射液中,每次取100~200 mg雾化吸入,氧流量8~10 L/min,持续15~20 min,每天两次,疗程30 d。
1.3.2 对照组 给予伏立康唑静脉滴注治疗:注射用伏立康唑(50 mg/支,生产厂家:珠海亿邦制药有限公司,批号:H20058964),2次/d,静脉滴注,首日剂量每次6 mg/kg,以后每次4 mg/kg,疗程30 d。
1.4 标本收集 于治疗前1 d和治疗结束后1个月清晨空腹状态下抽取受试者外周静脉血4 ml,3 500 r/min离心10 min,上清液-80℃保存待测。
1.5 观察指标与检测方法 观察受检者的疗效、血清IL-6、IL-8、TNF-α等细胞因子水平、肺总量(TCL)、一氧化碳弥散量(DLco)、血氧饱和度(SaO2)等指标。采用ELISA法检测血清IL-6、IL-8、TNF-α等细胞因子含量,试剂盒购自于上海华大基因,严格按照说明书进行操作。
1.6 疗效评价标准 痊愈:受试者症状基本消失,肺部阴影完全吸收;好转:受试者症状有明显减轻,肺部阴影部分吸收;无效:患者病情恶化或死亡[3]。
1.7 统计学方法 应用SPSS18.0软件进行数据统计分析,计数资料采用χ2检验,计量资料以均数±标准差(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的治疗效果比较 观察组患者治疗后的总有效率为86.11%,高于对照组的65.63%,差异有统计学意义(χ2=3.951 5,P<0.05),见表2。

表2 两组临床疗效比较[例(%)]
2.2 两组患者治疗前后的TCL、DLco、SaO2指标比较 治疗后两组患者的TCL、DLco、SaO2均较治疗前明显改善(P<0.05),但观察组TCL、DLco、SaO2改善幅度大于对照组(P<0.01),见表3。
表3 两组患者治疗前后的TCL、DLco、SaO2指标比较(±s)
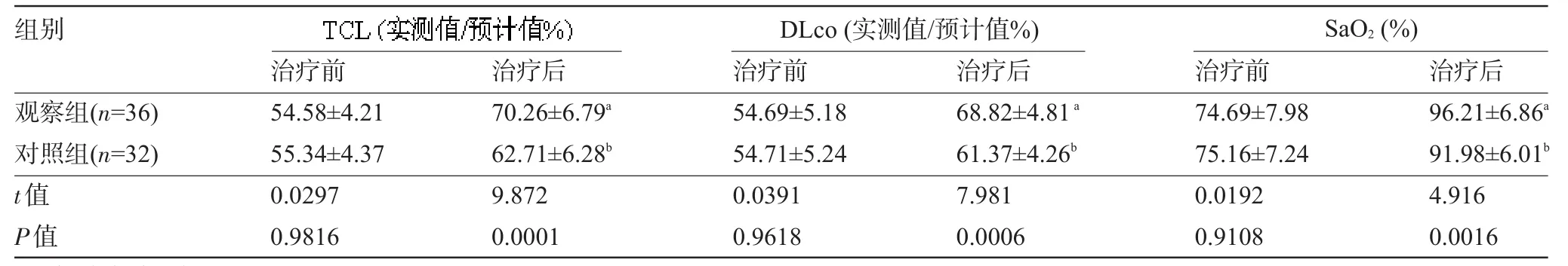
表3 两组患者治疗前后的TCL、DLco、SaO2指标比较(±s)
注:与治疗前比较,aP<0.01;bP<0.05。
观察组(n=36)对照组(n=32) t值P值54.58±4.21 55.34±4.37 0.0297 0.9816 70.26±6.79a62.71±6.28b9.872 0.0001 54.69±5.18 54.71±5.24 0.0391 0.9618 68.82±4.81a61.37±4.26b7.981 0.0006 74.69±7.98 75.16±7.24 0.0192 0.9108 96.21±6.86a91.98±6.01b4.916 0.0016
2.3 两组患者治疗前后的细胞因子水平比较 观察组患者治疗后的血清TNF-α水平明显较治疗前降低(P<0.01),也明显低于同期对照组(P<0.01)。观察组治疗后血清IL-8、IL-6水平明显较治疗前降低(P<0.01),也明显低于同期对照组(P<0.01)。对照组治疗后血清TNF-α、IL-8、IL-6水平低于治疗前(P<0.05),见表4。
表4 两组血清TNF-α、IL-8、IL-6水平比较(±s,ng/L)

表4 两组血清TNF-α、IL-8、IL-6水平比较(±s,ng/L)
注:与治疗前比较,aP<0.01;bP<0.05。
100.21±6.87a108.98±7.02b5.7296 0.0002观察组(n=36)对照组(n=32) t值P值48.58±8.21 48.34±8.18 0.1372 0.8916 40.26±6.79a44.71±7.28b2.9662 0.0032 48.69±5.18 48.71±5.24 0.0776 0.9381 38.82±4.87a44.37±4.21b2.8825 0.0056 114.69±10.98 112.94±10.24 0.0802 0.8929
2.4 不良反应 观察组和对照组分别有3例和2例患者出现不良反应,不良反应发生率分别为8.33%和6.25%,差异无统计学意义(χ2=0.107 9,P= 0.742 5)。两组主要不良反应为肝酶升高、胃肠道反应等,受试者可耐受,给予对症处理后大多缓解,未发生严重不良反应。
3 讨论
随着抗生素和糖皮质激素的广泛使用,IPA发病率呈上升趋势。IPA具有临床症状重、病死率高等特点,因此早期发现、早期治疗对减少IPA对机体的危害具有重要意义[7-12]。近年来曲霉菌感染开始得到重视,相关抗真菌药被大量使用,进而出现菌群对氟康唑、伊曲康唑等抗真菌药物耐药情况。临床为解决耐药难题,开始研发新的抗真菌药物。
伏立康唑为一种新型广谱类抗真菌药物,是目前治疗IPA的首选药物之一。Nasa等[1]研究发现,伏立康用于IPA治疗,患者均可以耐受药物不良反应,且疗效优于以往抗真菌药物。Calcagno等[2]报道,伏立康唑唑雾化吸入方法给药,有效率可高达85%以上,优于伏立康唑口服或静脉滴注效果。本研究显示,雾化吸入组患者有效率优于静脉滴注组(P<0.05),与文献报道基本一致。提示伏立康唑雾化吸入作为一种相对新型的给药方式,其有效率优于传统给药方式。伏立康唑主要通过抑制曲霉菌中14-甾醇去甲基化,从而抑制曲霉菌成分麦角甾醇的合成发挥作用,对耐氟康唑的烟曲霉及其他致病真菌均有抗菌活性。
多数曲霉菌感染者合并慢性基础疾病,如血液系统疾病、呼吸系统疾病等,因此机体免疫功能较健康人群低下,在一定程度上也增加了IPA发病风险。IPA患者抵抗力差,感染IPA可加重肺部感染症状,肺功能明显受影响。Shohab等[5]研究发现,IPA患者可存在不同程度的肺纤维化,对患者健康及日常生活可造成严重影响。Liu等[6]报道伏立康唑规范化治疗可以有效改善IPA患者肺纤维化症状。本研究显示,在接受伏立康唑治疗后,两组患者TCL、DLco、SaO2等肺功能指标均较治疗前明显改善(P<0.05),且伏立康唑雾化吸入组患者TCL、DLco、SaO2改善幅度优于静脉滴注组(P<0.01)。提示伏立康唑规范化治疗可以改善IPA患者肺纤维化症状,且雾化吸入给药方式对肺纤维化症状的改善效果更明显。
IPA机体免疫功能受损,体内炎症反应较重。Pérez-Sáez等[7]研究发现,IPA患者炎症程度较重,使用ELISA法检测相关细胞因子含量,检测结果显示,患者血清TNF-α、IL-8、IL-6等炎症因子水平明显高于健康人群。Broenen等[8]亦发现,IPA患者炎症水平明显高于健康人群,给予抗真菌药物治疗后患者TNF-α、IL-8等炎症因子水平可明显降低,机体炎症反应明显减轻。本研究显示,给予伏立康唑治疗后受试者血清TNF-α、IL-8、IL-6水平明显较治疗前下降(P<0.05),而给予雾化吸入的患者血浆TNF-α、IL-8、IL-6含量降低幅度优于对照组(P<0.01)。提示IPA患者炎症反应较重,而伏立康唑雾化吸入可能通过调节机体炎症因子水平,进而达到减轻炎症反应、提高疗效、改善患者临床症状的功效。
国外文献报道伏立康唑这一新型抗真菌药物用于治疗IPA,用药后产生的不良反应在患者可耐受的范围内[11]。本研究中,伏立康唑雾化吸入组和静脉滴注组患者均未发生严重不良反应,产生的药物毒副作用均可耐受。这说明伏立康唑雾化吸入用于IPA的治疗,不仅疗效佳,可有效改善临床症状,且副作用轻。
综上所述,伏立康唑雾化吸入用于IPA的治疗,可有效改善患者肺纤维化程度,抑制炎症反应,临床疗效佳,且不良反应轻。
[1]Nasa P,Yadav R,Nagrani SK,et al.Invasive pulmonary aspergillosis in an immunocompetent patient with severe dengue fever[J].Indian J Crit Care Med,2014,18(5):323-325.
[2]Calcagno A,Baietto L,Pagani N,et al.Voriconazole and atazanavir: a CYP2C19-dependent manageable drug-drug interaction[J].Pharmacogenomics,2014,15(10):1281-1286.
[3]冯秀娟,叶 慧,钟册俊,等.128例侵袭性肺曲霉病临床疗效分析[J].中国真菌学杂志,2014,9(3):159-162,169.
[4]张 明,孙文逵,施 毅,等.烟曲霉对唑类抗真菌药物的耐药性[J].中国感染与化疗杂志,2013,13(2):155-159.
[5]Shohab D,Hussain I,Khawaja A,et al.Primary renal aspergillosis and xanthogranulomatous pyelonephritis in an immuno-competent toddler[J].J Coll Physicians Surg Pak,2014,24(Suppl 2):S101-103.
[6]Liu Q,Lin R,Sun J,et al.Antifungal agents for secondary prophylaxis based on response to initial antifungal therapy in allogeneic hematopoietic stem cell transplant recipients with prior pulmonary aspergillosis[J].Biol Blood Marrow Transplant,2014,20(8): 1198-1203.
[7]Pérez-Sáez MJ,Mir M,Montero MM,et al.Invasive aspergillosis in kidney transplant recipients:a cohort study[J].Exp Clin Transplant,2014,12(2):101-105.
[8]Broenen E,Mavinkurve-Groothuis A,Kamphuis-van Ulzen K,et al. Screening of the central nervous system in children with invasive pulmonary aspergillosis[J].Med Mycol Case Rep,2014,4:8-11.
[9]胡晓艳,姜 梁.老年人血清TNF-α、IL-1β、IL-8、IL-6含量与患侵袭性肺曲霉病的相关性[J].中国老年学杂志,2013,33(4): 940-941.
[10]Jeurissen S,Vogelaers D,Sermijn E,et al.Invasive aspergillosis in patients with cirrhosis,a case report and review of the last 10 years [J].Acta Clin Belg,2013,68(5):368-375.
[11]Siopi M,Mavridou E,Mouton JW,et al.Susceptibility breakpoints and target values for therapeutic drug monitoring of voriconazole and Aspergillus fumigatus in an in vitro pharmacokinetic/pharmacodynamic model[J].JAntimicrob Chemother,2014,69(6):1611-1619.
[12]Koulenti D,Garnacho-Montero J,Blot S.Approach to invasive pulmonary aspergillosis in critically ill patients[J].Curr Opin Infect Dis,2014,27(2):174-183.
Influence of voriconazole atomization inhalation on pulmonary fibrosis and cytokines in patients with invasive pulmonary aspergillosis.
ZHANG Gui-ning1,WEI Zhi-ping2,YE Ming-xia3.
1.Department of Pharmacy,Shenzhen Eye Hospital,Shenzhen 518040,Guangdong,CHINA;2.Department of Pharmacy,Peking University Shenzhen Hospital, Shenzhen 518036,Guangdong,CHINA;3.Department of Respiratory Medicine,Peking University Shenzhen Hospital, Shenzhen 518036,Guangdong,CHINA
ObjectiveTo study the influence of voriconazole atomization inhalation on pulmonary fibrosis and cytokines in patients with invasive pulmonary aspergillosis(IPA).MethodsSixty-eight IPA patients in our hospital from Jan.2010 to Dec.2013 were selected as the research objects,which were randomly divided into observation group and control group.Patients in the observation group(n=36)were given voriconazole inhalation,while those in the control group(n=32)were given voriconazole by intravenous drip treatment.The curative effects,the serum IL-6, IL-8,TNF-α levels,total lung capacity(TCL),diffusing capacity for carbon monoxide(DLco),oxygen saturation (SaO2)of the two groups were recorded.ResultsThe efficient rate of observation group was significantly better than the control group(86.11%vs 65.63%,P<0.05).After treatment,TCL,DLco,SaO2in observation group and the control group were all significantly improved(P<0.05),but the improvement in the observation group were more significant(P<0.01).After treatment,the serum TNF-α levels were significantly lower than those before treatment(P<0.01)and were significantly lower than control group in the same period(P<0.01).Serum IL-8,IL-6 levels in the observation group after treatment were significantly lower than those before treatment(P<0.01)and were significantly lower than control group in the same period(P<0.01).Serum TNF-α,IL-8,IL-6 levels in the control group after treatment were significantly lower than those before treatment(P<0.05).The incidence of adverse reactions in the observation group and the control group were 8.33%and 6.25%,and there were no significant differences(P>0.05).ConclusionVoriconazole inhalation for the treatment of IPA can effectively improve the patients'pulmonary fibrosis,inhibit the inflammatory reaction,which has better clinical effect and less adverse reactions.
Invasivepulmonaryaspergillosis;Voriconazole;Atomizationinhalation;Pulmonaryfibrosis;Cytokine
R379.6
A
1003—6350(2015)06—0787—04

2014-09-25)
