不同自主神经干预对家犬交感神经系统的影响
2015-04-14周丽平余锂镭王松云萨仁高娃
周丽平,余锂镭,王 卓,黄 兵,王松云,廖 凯,萨仁高娃,江 洪
(武汉大学人民医院心内科,湖北 武汉 430060)
不同自主神经干预对家犬交感神经系统的影响
周丽平,余锂镭,王 卓,黄 兵,王松云,廖 凯,萨仁高娃,江 洪
(武汉大学人民医院心内科,湖北 武汉 430060)
目的 研究不同自主神经干预方法对家犬交感神经系统的影响。方法40只成年家犬随机分为肾交感神经消融(RSD)组(n=8)、低强度耳缘迷走神经刺激(LL-TS)组(n=8)、低强度颈动脉窦压力感受器刺激(LL-CBS)组(n=8)、低强度脊髓神经刺激(LL-SCS)组(n=8)和对照组(n=8)。分别在基础状态、干预1 h、2 h和3 h末测定同等电压强度高频电刺激左侧星状神经节(LSG)时的血压变化,并以血压变化最大值代表LSG功能。在基础状态和干预3 h末测定LSG神经活性和血浆去甲肾上腺素(NE)水平。结果基础状态时,对照组与RSD、LL-TS、LL-CBS和LL-SCS各干预组高频刺激LSG时诱导的血压变化最大值、LSG神经活性和血浆NE水平比较差异均无统计学意义(P>0.05)。干预3 h后,RSD、LL-TS、LL-CBS和LL-SCS各干预组LSG功能、神经活性和血浆NE水平均比对照组明显降低,差异均有统计学意义(P<0.05)。结论RSD、LL-TS、LL-CBS和LL-SCS这几种自主神经干预方法都可以显著抑制LSG的功能和活性以及系统交感神经活性。
自主神经系统;星状神经节;神经活性
近年来很多研究表明一些自主神经干预方法,如肾交感神经消融(RSD)[1]、低强度迷走神经刺激(LL-VNS)[2-3]、颈动脉窦压力感受器刺激(LL-CBS)[4]和脊髓神经刺激(LL-SCS)[5-6]对心律失常均有显著的保护作用。而既往研究已证实交感神经激活在心律失常的发生中起着重要作用。因此,我们推测这些自主神经干预方法可能具有抑制交感神经活性的作用。本实验通过测定左侧星状神经节(LSG)功能、神经活性和血浆去甲肾上腺素(NE)浓度来评估这些自主神经干预对交感神经系统的影响。
1 材料与方法
1.1 实验动物准备 本研究由武汉大学动物实验伦理委员会审核并批准,40只成年家犬(体重17~20 kg)由武汉大学人民医院动物中心提供。实验犬随机分为五组:RSD组(n=8)、LL-TS组(n=8)、LL-CBS组(n=8)、LL-SCS组(n=8)和对照组(n=8)。所有的犬以戊巴比妥钠30 mg/kg静脉麻醉,以2 mg·kg-1·h-1维持麻醉。静脉滴注生理盐水50~100 ml/h以补充液体损失量。气管插管正压呼吸机通气,调整氧流量为4~6 L/min。持续记录体表标准肢体导联心电图,股动脉置管监测动脉血压,信号接入32导电生理记录仪(LEAD2000)监测生命体征。
1.2 自主神经干预
1.2.1 肾交感神经消融(RSD) 对实验犬行双侧腹膜后侧位切开术,充分暴露左右肾动脉,在直视下将大探头(3.5 mm)导管(Biosense-Webster Inc. Diamond Bar,CA,USA)置于近端肾动脉外膜进行消融。在消融前5min以高频电刺激法(20 Hz,2 ms,15 mA,60 s)测定消融位点,高频电刺激时血压上升的位点确定为消融位点并给予射频电流(6~8 W,60 s),消融终点为消融后5 min再对该位点进行高频电刺激血压不再上升。双侧分别在肾动脉4个位点进行RSD。
1.2.2 低强度耳缘迷走神经刺激(LL-TS) 用连接于特制的刺激仪的耳夹以频率20 Hz、脉宽1 ms的耳屏刺激(耳缘迷走神经刺激)按照开启5 s再关闭5 s的循环发放至双侧外耳廓的耳屏。首先用递增的电压刺激耳缘迷走神经直至降低窦性心律,此时的电压定为刺激电压阈值,以80%的阈电压进行LL-TS 3 h。
1.2.3 低强度颈动脉窦压力感受器刺激(LL-CBS) 充分暴露并分离颈总动脉和颈内动脉交叉处,将自制的银-氯化银刺激电极环形植入于颈动脉窦周围,连接刺激仪。刺激电压从1 V开始CBS,并以每5 min 0.2 V(50 Hz,脉宽0.5 ms)递增直至出现血压下降,血压下降时的电压作为CBS的电压阈值。以80%阈电压(频率50 Hz,脉宽0.5 ms)进行LL-CBS 3 h。
1.2.4 低强度脊髓神经刺激(LL-SCS)X线透视指导下,T1~5脊髓节段硬膜外穿刺,接入刺激导线,导线进入到硬膜外T1~5脊髓节段水平,在前后位X线透视下将导线定位于脊髓正中稍偏左处。连接Grass-88刺激仪,设定可引起肌肉收缩的最低电压值为阈电压,以80%阈电压(频率50 Hz,脉宽0.02 ms)进行LL-SCS刺激3 h。
1.3 LSG活性测定 将三个钨丝微电极用微型固定器并列固定,调整微电极尖端距离2~3 mm,微电极尖端插入LSG记录神经活性。分别在基础状态和自主神经干预3 h末记录30 s的LSG神经活性。神经活性信号定义为高于噪音振幅3倍的记录信号。
1.4 LSG功能测定 经左侧第四肋间开胸,确定LSG部位,在LSG插入一根直径0.1 mm的银金属丝,连接刺激仪,以10 V的高频刺激(HFS:频率20 Hz,脉宽0.1 ms)寻找到刺激LSG时血压变化最大的位点,在该位点处固定银金属丝。分别在基础状态自主神经干预1 h、2 h和3 h末以10 V的高频电刺激LSG测定HFS引起的最大血压变化值,以血压变化最大值代表LSG功能。
1.5 血样采集和血浆NE水平测定 分别在基础状态和干预3 h末经股静脉采集血液样本,4℃,3 000 r/min离心15 min,分离血浆储存于-80℃的冰箱内待进一步分析。采用犬特异性的高敏感性ELISA设备(Nanjing Jiancheng Bioengineering Institute,Nanjing City,China)分析NE浓度。
1.6 统计学方法 应用SPSS17.0软件进行统计学分析。所有数据均采用Kolmogorov-Smirnov检验判断是否符合正态分布。符合正态分布的计量资料以均数±标准差(±s)表示,组间两两比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同自主神经干预方法对LSG功能的影响 各组不同状态下测得的血压变化最大值如图1所示。基础状态时,RSD、LL-TS、LL-CBS、LL-SCS各干预组高频刺激LSG时诱导的血压变化最大值与对照组相比差异均无统计学意义[对照组vs RSD组:(19±1)mmHg vs(20±2)mmHg,t=1.265(1 mmHg=0.133 kPa);对照组vs LL-TS组:(19±1)mmHg vs(21±3)mmHg,t=1.789;对照组vs LL-CBS组:(19±1)mmHg vs(20±3)mmHg,t=0.8944;对照组vs LL-SCS:(19±1)mmHg vs(18±2)mmHg,t=1.265;所有P>0.05];给予自主神经干预3 h后,RSD、LL-TS、LL-CBS和LL-SCS各干预组高频刺激LSG时血压变化最大值逐渐降低,与对照组相比均显著降低[对照组vs RSD组:(20±3)mmHg vs(11±1)mmHg,t=8.050;对照组vs LL-TS组:(20±3)mmHg vs(11±2)mmHg,t=7.060;对照组vs LL-CBS组:(20±3)mmHg vs(10±1)mmHg,t=8.944;对照组vs LL-SCS组:(20±3)mmHg vs (10±2)mmHg,t=7.845;所有P<0.05]。
2.2 不同自主神经干预方法对LSG神经活性的影响 各组基础状态和自主神经干预3 h末测定的LSG神经活性见表1。基础状态时,对照组和RSD、LL-TS、LL-CBS、LL-SCS各干预组LSG神经活性频率和振幅差异均无统计学意义[频率—对照组vs RSD组:(51±3)impulses/min vs(50±3)impulses/min,t=0.666 7;对照组vs LL-TS组:(51±3)impulses/min vs (53±2)impulses/min,t=1.569;对照组vs LL-CBS组:(51±3)impulses/min vs(49±2)impulses/min,t=1.569;对照组vs LL-SCS:(51±3)impulses/min vs (52±4)impulses/min,t=0.565 7;所有P>0.05;振幅—对照组vs RSD组:(0.50±0.04)mv vs(0.52±0.03)mv,t=1.131;对照组vs LL-TS组:(0.50±0.04)mv vs (0.48±0.02)mv,t=1.265;对照组vs LL-CBS组:(0.50±0.04)mv vs(0.47±0.02)mv,t=1.897;对照组vs LL-SCS:(0.50±0.04)mv vs(0.51±0.03)mv,t=0.565 7;所有P>0.05],RSD、LL-TS、LL-CBS和LL-SCS各干预组给予自主神经干预3 h后LSG神经活性频率和振幅逐渐减小(频率:对照组vs RSD组:(54±3)impulses/min vs(26±2)impulses/min,t=21.97;对照组vs LL-TS组:(54±3)impulses/min vs (28±2)impulses/min,t=20.40;对照组vs LL-CBS组:(54±3)impulses/min vs(27±3)impulses/min,t=18.00;对照组vs LL-SCS:(54±3)impulses/min vs (30±2)impulses/min,t=18.83;所有P>0.05;振幅:对照组vs RSD组:(0.52±0.03)mv vs(0.27±0.02)mv,t=19.61;对照组vs LL-TS组:(0.52±0.03)mv vs (0.23±0.03)mv,t=19.33;对照组vs LL-CBS组:(0.52±0.03)mv vs(0.26±0.02)mv,t=20.40;对照组vs LL-SCS:(0.52±0.03)mv vs(0.24±0.02)mv,t=21.97;所有P<0.05)。
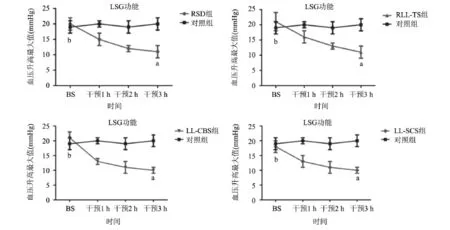
图1 不同自主神经干预方法对LSG功能的影响
表1 各组在基础状态和自主神经干预3 h后测定的LSG神经活性频率和振幅比较(±s)

表1 各组在基础状态和自主神经干预3 h后测定的LSG神经活性频率和振幅比较(±s)
注:与对照组比较,aP<0.05,bP>0.05。
组别振幅(mv) RSD组LL-TS组LL-CBS组LL-SCS组对照组频率(impulses/min)基础状态50±3a53±2a49±2a52±4a51±3干预3 h后26±2b28±2b27±3b30±2b54±3基础状态0.52±0.03a0.48±0.02a0.47±0.02a0.51±0.03a0.50±0.04干预3 h后0.27±0.02b0.23±0.03b0.26±0.02b0.24±0.02b0.52±0.03
2.3 不同自主神经干预方法对血浆NE水平的影响 各组分别在基础状态和自主神经干预3h末测定的血浆NE值见表2。基础状态时,对照组和RSD、LL-TS、LL-CBS、LL-SCS各干预组血浆NE水平差异无统计学意义[对照组vs RSD组:(158±5)pg/ml vs(156±6)pg/ml,t=0.7243;对照组vs LL-TS组:(158±5)pg/ml vs(155±4)pg/ml,t=1.325;对照组vs LL-CBS组:(158±5)pg/ml vs(157±5)pg/ml,t=0.4000;对照组vs LL-SCS:(158±5)pg/ml vs(153±6)pg/ml,t=1.811;所有P>0.05],3 h自主神经干预后,RSD、LL-TS、LL-CBS和LL-SCS各干预组血浆NE水平比对照组显著减少[对照组vs RSD组:(154±4)pg/ml vs(125±5)pg/ml,t=12.81;对照组vs LL-TS组:(154±4)pg/ml vs(121±3)pg/ml,t=18.67;对照组vs LL-CBS组:(154±4)pg/ml vs(119±3)pg/ml,t=19.80;对照组vs LL-SCS:(154±4)pg/ml vs(122±4)pg/ml,t=16.00;所有P<0.05]。
表2 各组在基础状态和自主神经干预3 h末测定的血浆NE值比较(pg/ml,±s)

表2 各组在基础状态和自主神经干预3 h末测定的血浆NE值比较(pg/ml,±s)
注:与对照组比较,aP<0.05,bP>0.05。
组别 基础状态 干预3 h后156±6a155±4a157±5a153±6a158±5 RSD组LL-TS组LL-CBS组LL-SCS组对照组125±5b121±3b119±3b122±4b154±4
3 讨论
本实验研究结果表明,肾交感神经消融、低强度耳缘迷走神经刺激、低强度颈动脉窦压力感受器刺激和低强度脊髓神经刺激这些自主神经干预方法可抑制LSG功能和活性,降低血浆NE水平,抑制心脏和系统交感神经活性。
心肌梗死后交感神经系统过度激活,梗死周边区发生交感神经重构,交感神经纤维过度不均一性再生[7-8]。动物实验证实其机制主要为心肌梗死后大量释放神经生长因子(NGF),NGF通过逆向轴突运动激活LSG,进而再反过来引起心脏梗死周边区的交感神经重构[9]。研究还发现电刺激或化学刺激LSG后,实验犬心肌梗死后自发性持续性室性心动过速(室速)和心室颤动(室颤)的发生率显著增加[10]。神经活性记录仪显示86.3%的室速和室颤发生前均有LSG活性的急剧增高,越临近室性心律失常的起始,LSG活性增高越显著[11]。这些研究表明交感神经过度激活在诱发和维持室性心律失常中发挥着重要作用。
迷走神经和交感神经是机体天然存在的自主神经拮抗系统,二者互相依存,互相拮抗,保持一定的动态平衡来维持机体的正常生理功能。心肌梗死后交感神经系统的过度激活,自主神经失衡[12]。降低交感神经活性或增强迷走神经活性的干预方法可能抑制交感神经的过度激活,以使其达到再平衡状态。肾交感神经对交感神经系统激活可发挥重要的作用,RSD降低系统交感神经活性的作用机制可能是使肾交感传入神经向中枢神经系统的反馈作用减弱,导致中枢交感神经活性降低,进而降低了心脏和系统交感神经活性。走行于耳屏处的迷走神经耳缘支是迷走神经在体表的唯一分支,LL-TS可增强迷走神经张力,从而抑制交感神经活性,使交感/迷走神经系统达到再平衡状态。颈动脉窦压力感受器是位于颈动脉窦的机械感受器,LL-CBS可激活压力感受器,降低交感神经活性,增强迷走神经活性。基础和临床研究发现CBS可对高血压和心衰发挥治疗作用[13-14],其作用机制可能是对自主神经系统发挥了调控作用。SCS在临床上主要用于治疗顽固性神经源性疼痛,其作用机制可能是抑制痛知觉。有研究证明脊髓神经刺激还可以调控自主神经与器官之间的传入和传出连接,研究者发现,在T1~2节段进行SCS可以增强副交感神经活性[5],因此LL-SCS可能通过增强迷走神经活性从而抑制交感神经活性。
综上所述,RSD、LL-TS、LL-CBS和LL-SCS这些自主神经干预方法都可以抑制LSG功能和神经活性,降低血浆NE水平,抑制心脏和系统交感神经活性。几种干预方法对交感神经系统的抑制作用相当。几种干预方法相比,低强度耳缘迷走神经刺激通过经皮刺激迷走神经耳缘支发挥调控作用,且刺激强度为刺激迷走神经耳缘支引起心率减慢的的最低刺激电压的80%,不会导致心率减慢,是一种无创、安全、有效的自主神经干预方法。并且已有研究证实无创耳缘迷走神经刺激可通过抗炎症因子释放,显著改善心肌梗死后心肌重塑、心肌纤维化以及心室功能,改善心肌梗死后的恶性室性心律失常基质[15-17]。以上结果均提示低强度耳缘迷走神经刺激可能成为无创、安全、有效的抑制心梗后交感神经过度激活、防治心梗后心律失常的新策略。
[1]Davies JE,Manisty CH,Petraco R,et al.First-in-man safety evaluation of renaldenervation for chronic systolic heart failure:primaryoutcome from REACH-Pilot study[J].Int J Cardiol,2003,162:189-192.
[2]Sheng X,Scherlag BJ,Yu L,et al.Prevention and reversal of atrial fibrillation inducibility and autonomic remodeling by low-level vagosympathetic nerve stimulation[J].J Am Coll Cardiol,2011,57 (5):563-571.
[3]Yu L,Scherlag BJ,Li S,et al.Low-level vagosympathetic nerve stimulation inhibits atrial fibrillation inducibility:direct evidence by neural recordings from intrinsic cardiac ganglia[J].J Cardiovasc Electrophysiol,2011,22(4):455-463.
[4]Liao K,Yu L,Yang K,et al.Low-level carotid baroreceptor stimulation suppresses ventricular arrhythmias during acute ischemia[J]. PLoS One,2014,9(10):e109313.
[5] Olgin JE,Takahashi T,Wilson E,et al.Effects of thoracic spinal cord stimulation on cardiac autonomic regulation of the sinus and atrioventricular nodes[J].J Cardiovasc Electrophysiol,2002,13(5): 475-481.
[6]Yu L,Huang B,He W,et al.Spinal cord stimulation suppresses focal rapid firing-induced atrial fibrillation by inhibiting atrial ganglionated plexus activity[J].J Cardiovasc Pharmacol,2014,64(6): 554-559.
[7]Jiang H,Hu X,Lu Z,et al.Effects of sympathetic nerve stimulation on ischemia-induced ventricular arrhythmias by modulating connexin43 in rats[J].Archives of Medical Research,2008,39:647-654.
[8]Jiang H,Lu Z,Yu Y,et al.Effects of metoprolol on sympathetic remodeling and electrical remodeling at infarcted border zone after myocardial infarction in rabbits[J].Cardiology,2007,108:176-182.
[9]Zhou S,Chen LS,Miyauchi Y,et al.Mechanisms of cardiac nerve sprouting after myocardial infarction in dogs[J].Circulation Research,2004,95:76-83.
[10]Swissa M,Zhou S,Gonzalez-Gomez I,et al.Long-term subthreshold electrical stimulation of the left stellate ganglion and a canine model of sudden cardiac death[J].Journal of the American College of Cardiology,2004,43:858-864.
[11]Zhou S,Jung BC,Tan AY,et al.Spontaneous stellate ganglion nerve activity and ventricular arrhythmia in a canine model of sudden death[J].Heart Rhythm,2008,5:131-139.
[12]Wen H,Jiang H,Lu Z,et al.Carvedilol ameliorates the decreases in connexin 43 and ventricular fibrillation threshold in rats with myocardial infarction[J].The Tohoku Journal of Experimental Medicine,2009,218:121-127.
[13]Scheffers IJ,Kroon AA,Schmidli J,et al.Novel baroreflex activation therapy in resistant hypertension:Resultsof a european multi-center feasibility study[J].JAm Coll Cardiol,2010,56:1254-1258.
[14]Sabbah HN,Gupta RC,Imai M,I et al.Chronic electrical stimulation of the carotid sinus baroreflex improves left ventricular function and promotes reversal of ventricular remodeling in dogs with advanced heart failure[J].Circ Heart Fail,2011,4:65-70.
[15]Yu L,Scherlag BJ,Li S,et al.Low-level transcutaneous electrical stimulation of the auricular branch of the vagus nerve:a noninvasive approach to treat the initial phase of atrial fibrillation[J].Heart Rhythm,2013,10(3):428-435.
[16]Wang Z,Yu L,Wang S,et al.Chronic intermittent low-level transcutaneous electrical stimulation of auricular branch of vagus nerve improves left ventricular remodeling in conscious dogs with healed myocardial infarction[J].Circulation Heart failure,2014,7(6): 1014-1021.
[17]Wang Z,Yu L,Chen M,et al.Transcutaneous electrical stimulation of auricular branch of vagus nerve:A noninvasive therapeutic approach for post-ischemic heart failure[J].Int J Cardiol,2014,177 (2):676-677.
Effects of different autonomic nervous intervention on the sympathetic nerve system in dogs.
ZHOU Li-ping,YU Li-lei,WANG Zhuo,HUANG Bing,WANG Song-yun,LIAO Kai,SAREN Gao-wa,JIANG Hong.Department of Cardiology,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo investigate the effects of different autonomic nervous intervention on the sympathetic nerve system in dogs.MethodsForty dogs were randomly divided into the renal sympathetic nerve denervation(RSD)group(n=8),the low-level tragus stimulation(LL-TS)group(n=8),the low-level carotid baroreceptor stimulation(LL-CBS)group(n=8),the low-level spinal cord stimulation(LL-SCS)group(n=8)and the control group(n=8).Blood pressure(BP)at baseline and 1 h,2 h,3 h after stimulation were recorded,and the maximum BP increasing value when high frequency stimulation(HFS)was delivered to left stellate ganglion were measured as the function of the left stellate ganglion.The nerve activity of LSG and the NE level of plasma were also measured.ResultsAt baseline state,there were no significant differences between the control group and RSD group,LL-TS groups,LL-CBS group, LL-SCS group in the maximum BP increasing value,the LSG activity and the NE level(P>0.05).After 3 hours of autonomic intervention,the maximum BP increasing value,the LSG activity and the NE level of RSD group,LL-TS group, LL-CBS group,LL-SCS group were significantly lower than those of the control group.ConclusionAutonomic intervention by RSD,LL-TS,LL-CBS and LL-SCS could significantly decrease the activity and function of left stellate ganglion and the activity of systematic sympathetic nerve.
Autonomic nervous system;Stellate ganglion;Nerve activity
R-332
A
1003—6350(2015)18—2657—05
10.3969/j.issn.1003-6350.2015.18.0968
2015-03-24)
国家自然科学基金(编号:81270339、81300182);中央高校基本科研业务费专项资金(编号:2042012kf1099、2042014kf0110);湖北省自然科学基金(编号:2013CFB302);武汉市科技攻关计划项目基金(编号:201306060201010271);武汉大学博士研究生自主科研项目(编号:2012302020206)
江 洪。E-mail:whujianghong@163.com
