四氧化三锰制备尖晶石锰酸锂及电化学性能研究
2015-04-14陈守彬吴显明陈上刘志雄丁其晨
陈守彬,吴显明,2,陈上,2,刘志雄,丁其晨
(1.吉首大学 化学化工学院,湖南 吉首 416000;2.湘西自治州矿产与新材料技术创新服务中心,湖南 吉首 416000)
目前,制备尖晶石LiMn2O4的锰源有MnO2、Mn2O3、Mn3O4、MnCO3等锰的化合物[1-3],工业化生产主要还是电解MnO2。Mn3O4由于纯度高、杂质含量少,具有尖晶石结构[4],合成尖晶LiMn2O4时不会发生剧烈的结构变化。因此,是合成尖晶石LiMn2O4的优质原料[5-8]。
本文分别以电解金属锰粉悬浮液氧化法[9]、焙烧法[10]、两步法[11]制备3 种Mn3O4,以高温固相法制备3 种尖晶石LiMn2O4,对LiMn2O4的物相、形貌、粒度、比表面积及电化学性能等方面进行了对比分析。
1 实验部分
1.1 材料与仪器
电解金属锰粉(≥99.9%),自制;氯化铵、硫酸锰、盐酸、乙醇、碳酸锂、N-甲基吡咯烷酮均为分析纯;乙炔黑、偏聚氯乙烯、金属锂片均为电池级;聚丙烯微孔膜(Celgard2400);1. 0 mol/L LiPF6的EC/DMC 溶液(体积比为1 ∶1),其中EC 为碳酸乙烯酯,DMC 为碳酸二甲酯。
101-1AB 型电热鼓风干燥箱;SKC-6-12 型管式电阻炉;D/max-γA 型X 射线衍射仪;S-3400N 型扫描电子显微镜;ZKX 型真空手套箱;BT-301 振实密度;CHI660B 电化学工作站;CT-3008W-5V5mA-S4高精度电池性能测试系统。
1.2 Mn3O4 的制备
1.2.1 电解金属锰粉悬浮液氧化法 量取250 mL蒸馏水于1 000 mL 三口烧瓶中,置于恒温水浴锅内,控制水温为80 ℃。加入1 g 氯化铵,3 mL 盐酸和5 mL 乙醇。称取10 g 金属锰粉(280 目),加适量蒸馏水搅拌成糊状,分数次加到反应烧瓶中,持续搅拌至反应完全。冷却、过滤、洗涤、烘干,得到Mn3O4,记作A-Mn3O4。
1.2.2 焙烧法 称取100 g 电解MnO2,按1 ∶4 固液比(g/mL)加入到1 mol /L 的HNO3溶液中,搅拌8 h,静置沉降。过滤,用蒸馏水清洗至滤液pH 为5~6,100 ℃干燥6 h,得到预处理MnO2。将MnO2于管式炉中550 ℃保温1 h,随后升温至1 050 ℃保温3 h,得到Mn3O4,记作B-Mn3O4。
1.2.3 硫酸锰两步法
1.2.3.1 MnSO4的水解沉淀 在1 000 mL 烧杯中加入硫酸锰59.16 g,蒸馏水700 mL,搅拌溶解,配制成0.5 mol/L 的硫酸锰溶液,在室温下加溶度为1%的稀氨水,控制反应终点pH 值为9.5,搅拌生成白色沉淀,过滤。
1.2.3.2 水解物氧化 将上述滤液转移到反应器中,按固液比4 ∶1(mL/g)加入水,浆化,悬浮液加热到60 ℃,通入空气过程中滴加氨水,用pH 计检测反应过程的pH 值,控制pH 在8. 5 ~8. 7,反应4.5 h。过滤,100 ℃烘干,得到Mn3O4,记作CMn3O4。
3 种不同制备方法得到的Mn3O4,其性质见表1。

表1 不同方法制备得到Mn3O4 的性能Table 1 Performance of Mn3O4 prepared by different methods
1.3 LiMn2O4 的制备
将Li2CO3分别与3 种Mn3O4按一定比例充分混合后置于管式炉中,以5 ℃/min 的升温速度升至650 ℃保温6 h。再以相同升温速率升至830 ℃,保温10 h。随炉冷却,得到尖晶石LiMn2O4粉末。
1.4 电池制备
采用CR2025 型纽扣电池进行电化学性能的测试。将活性物质、导电炭黑、粘结剂聚偏氟乙烯按质量比8 ∶1 ∶1 溶解在N-甲基吡咯烷酮溶剂中,均匀混合,形成浆料,浆料涂布铝箔上,120 ℃真空干燥12 h,裁成直径14 mm 的薄圆片。负极为0. 45 mm厚的金属锂片,以聚丙烯微孔膜作为电池的隔膜,1.0 mol/L LiPF6的EC/DMC 溶液为电解液,整个电池的组装是在充满氩气的手套箱中进行。
1.5 电化学性能测试
电池测试均以0.2 C 倍率恒流充放电循环测试,充放电终止电压为4.3 V 和3.0 V,交流阻抗测试频率为10-2~105Hz,采用电位阶跃法测定锂离子扩散系数,记录电池在电位阶跃过程中暂态电流I 随时间t 的变化,根据Cottrell 方程以及I-t-1/2曲线的斜率,即可计算锂离子扩散系数DLi+。
2 结果与讨论
2.1 TG 与DTA 分析
图1 为Li2CO3/Mn3O4混合物在空气气氛下,室温至1 000 ℃的TG-DTA 曲线。

图1 Li2CO3/Mn3O4 混合物的TG-DTA 曲线Fig.1 TG-DTA curves of Li2CO3/Mn3O4 mixture
由图1 可知,在室温至490.7 ℃区间,失重不明显,主要是混合物中吸附水、结晶水的脱除和微量杂质发生物理化学变化过程。对应的DTA 曲线上的42.5 ℃处的吸热峰很可能是Li2CO3暴露在空气中所吸附的水发生脱除,而在236.8 ℃处出现的微小的放热峰可能是Mn3O4中微量杂质发生的物理化学反应;490.7 ~628.7 ℃失重率急速增加,对应的是Li2CO3分解生成Li2O 和CO2的过程;628.7 ℃发生的是Li2O 与Mn3O4反应生成LiMn2O4过程;870 ℃左右,生成的LiMn2O4发生脱氧反应,TG 曲线上为失重率急速增加。
2.2 X 射线衍射分析
图2 是用3 种Mn3O4合成的尖晶石LiMn2O4粉末X 射线衍射图。
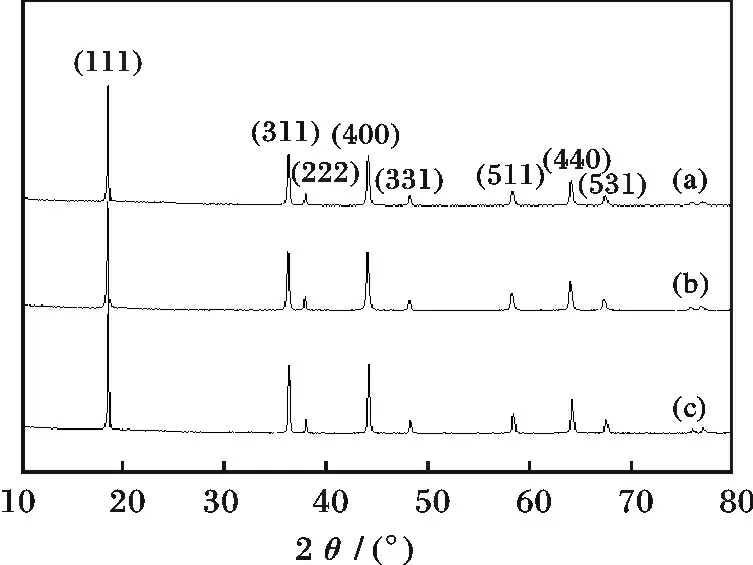
图2 Mn3O4 合成的尖晶石LiMn2O4 的XRD 图Fig.2 X-ray diffraction patterns of LiMn2O4 powders prepared from Mn3O4(a)A-Mn3O4;(b)B-Mn3O4;(c)C-Mn3O4
由图2 可知,3 个样品均无杂峰,呈单一尖晶石结构,峰形尖锐,峰值较强,表现出更好的结晶性。
2.3 形貌分析
图3 为3 种Mn3O4合成的尖晶石LiMn2O4粉末电镜照片。

图3 Mn3O4 合成的尖晶石LiMn2O4 的SEM 图Fig.3 Scanning electron micrographs of LiMn2O4 prepared from Mn3O4(a)A-Mn3O4;(b)B-Mn3O4;(c)C-Mn3O4
由图3 可知,由A-Mn3O4合成的尖晶石LiMn2O4颗粒棱角分明,形状规整,晶体生长较好,表面致密光滑,形貌清晰,且晶粒尺寸均一;由BMn3O4合成的尖晶石LiMn2O4颗粒较为细小,表面光滑;由C-Mn3O4制备得到的尖晶石LiMn2O4,其粉末颗粒大小不一,而且颗粒表面不光滑,大颗粒表面覆盖众多小颗粒。
2.4 电化学性能分析
图4 为3 种Mn3O4合成的尖晶石LiMn2O4组装成电池在室温条件下以0.2 C 倍率首次充放电曲线。
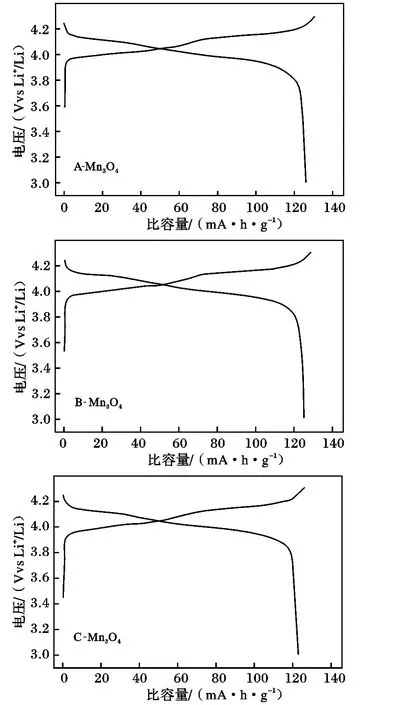
图4 Mn3O4 合成的尖晶石LiMn2O4 首次充放电曲线Fig.4 Charge and discharge curves for LiMn2O4 prepared from Mn3O4
由图4 可知,室温下以A-Mn3O4,B-Mn3O4,CMn3O4为锰源合成的尖晶石LiMn2O4首次放电比容量分别为127.6,125.4,121.6 mA·h/g,对应库伦效率为98.1%,97.5%,96.6%。可知悬浮液氧化法制备的A-Mn3O4合成尖晶石LiMn2O4首次充放电容量最高,MnSO4两步法制备的C-Mn3O4合成尖晶石LiMn2O4首次充放电容量最低。其可能原因是,MnSO4中含有一定的杂质,杂质含量的影响程度,有待实验室制备高纯MnSO4,进一步研究;而悬浮氧化法是用实验室制备的高纯锰粉,因此杂质对合成尖晶石LiMn2O4的影响可以忽略不计;焙烧法制备的B-Mn3O4合成尖晶石LiMn2O4具有较高的比容量是因为B-Mn3O4振实密度大,锰源的振实密度越大,其制备的尖晶石LiMn2O4电化学性能越好[12]。
图5 为3 种Mn3O4合成的尖晶石LiMn2O4在室温条件下以0.2 C 倍率循环30 次后的容量保持率。

图5 Mn3O4 合成的尖晶石LiMn2O4 在室温条件下的循环性能Fig.5 Charge and discharge curves for LiMn2O4 prepared from Mn3O4
由图5 可知,以A-Mn3O4为原料合成的尖晶石LiMn2O4,经 30 次循环后,放电比容量由130.0 mA·h/g 降为127. 6 mA·h/g,容量损 失1.9%;以B-Mn3O4为原料合成的尖晶石LiMn2O4,经30 次循环后,放电比容量由127.6 mA·h/g 下降到125.4 mA·h/g,容量损失2.5%;以C-Mn3O4为原料合成的尖晶石LiMn2O4经30 次循环后,放电比容量由125.9 mA·h/g 降为121.6 mA·h/g,容量损失3.4%。由此可知,以Mn3O4为原料合成尖晶石LiMn2O4在相同的倍率下,经多次循环后,容量损失都比较小;而以金属锰粉悬浮液氧化法制备的AMn3O4合成尖晶石LiMn2O4容量保持率最好。表明以Mn3O4为原料合成尖晶石LiMn2O4不仅比容量大,而且具有很好的电化学循环性能;而以不同方法制备得到的Mn3O4合成尖晶石LiMn2O4,其电化学性能存在一定差异,主要因为受前躯体Mn3O4的粒度分布、颗粒大小、振实密度、杂质含量等因素的影响[13]。
图6 为3 种Mn3O4合成的尖晶石LiMn2O4在室温条件下交流阻抗及等效电路图。

图6 Mn3O4 合成的尖晶石LiMn2O4 的交流阻抗及等效电路图Fig.6 Impedance spectrascopes of LiMn2O4 prepared from Mn3O4
由图6 可知,高频和中高频区出现了一个半圆,低频区出现一条斜线。高频和中高频区的半圆分别是由溶液阻抗Rs和电荷传递阻抗Rct共同形成,低频区斜线是由锂离子在材料内部扩散引起,在等效电路图中对应的是Warburg 阻抗。
由表2 可知,所有样品的溶液阻抗Rs都较小;但电荷传递阻抗Rct相差较大,而传递阻抗Rct越小表明材料具有电流密度越大,Li+脱/嵌能力更强;由此得知,不同原料合成的尖晶石LiMn2O4脱/嵌Li+能力:A-Mn3O4>B-Mn3O4>C-Mn3O4。
图7 是电位从4.10 V 跃迁到4.12 V 过程中I-t与I-t-1/2的关系。

表2 3 种Mn3O4 合成尖晶石LiMn2O4EIS 拟合等效电路参数值Table 2 Equivalent circuit parameters obtained from fitting results of LiMn2O4 synthesis for Mn3O4
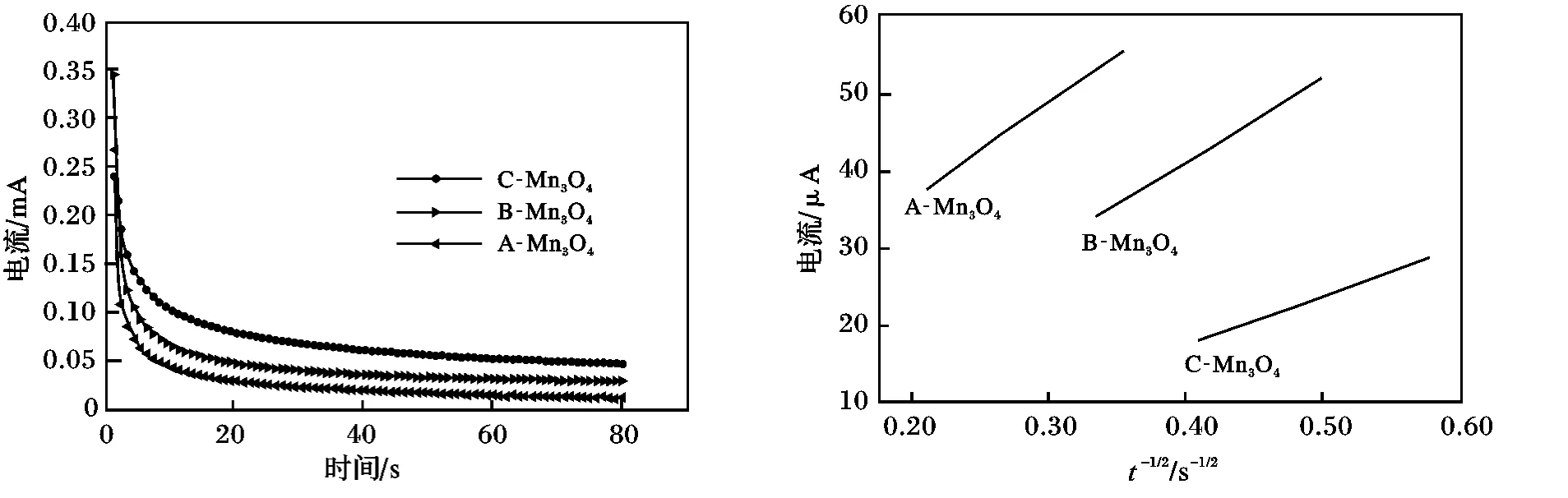
图7 3 种Mn3O4 合成尖晶石LiMn2O4 电极电流与时间的关系Fig.7 Relationship between current and time of LiMn2O4 electrode prepared from three different Mn3O4
根据Cottrell 方程计算锂离子扩散系数DLi+[14],结果见表3。

表3 不同Mn3O4 源合成的正极材料扩散系数DLi +Table 3 Diffusion lithium ion of LiMn2O4 electrode prepared from three different Mn3O4
由表3 可知,Li+在液相中的扩散系数的数量级为10-11,与文献报道的基本吻合,不同原料合成的尖晶石LiMn2O4材料扩散系数DLi+:A-Mn3O4>BMn3O4>C-Mn3O4,再次证实了脱/嵌Li+能力,即材料的充放电的难易程度。
3 结论
(1)采用3 种不同方法制备得到Mn3O4为锰源,用高温固相法都能合成具有较好晶型的尖晶石LiMn2O4,但形貌有所差异。
(2)以0.2 C 倍率充放电,经30 次循环,不同原料合成的尖晶石LiMn2O4首次充放电容量及保持率:A-Mn3O4>B-Mn3O4>C-Mn3O4。
(3)交流阻抗测试表明,不同原料合成的尖晶石LiMn2O4脱/嵌Li+能力:A-Mn3O4>B-Mn3O4>C-Mn3O4,采用PSCA 法测试计算得扩散系数DLi+同样证实了不同原料合成的尖晶石LiMn2O4脱/嵌Li+能力:A-Mn3O4>B-Mn3O4>C-Mn3O4。
[1] Komaba S,Ogata A,Shimizu T,et al.High temperature Xray diffractive study of spinel-type lithium manganese oxides[J].Solid State Ionics,2008,179:1783-1787.
[2] 张国昀,姜长印,万春荣,等. 以Mn3O4为前躯体的LiMn2O4及其电化学性能[J].无机材料学报,2001,16(4):667-671.
[3] Ogata A,Shimizu T,Komaba S.Crystallization of LiMn2O4observed with high temperature X-ray diffraction[J].Journal of Power Sources,2007,174:756-760.
[4] 潘其经.四氧化三锰的性质、用途及质量标准[J]. 中国锰业,1998,16(2):42-45.
[5] Lin H,Zheng J,Yang Y. The effects of quenching treatment and AlF3coating on LiNi0.5Mn0.5O2cathode materials for lithium-ion battery[J]. Materials Chemistry and Physics,2010,119:519-523.
[6] Patey T J,Buchel R,Nakayama M,et al.Electrochemistry of LiMn2O4nanoparticles made by flame spray pyrolysis[J].Phys Chem,2009,11:3756-3761.
[7] Jiang C H,Dou S X,Liu H K,et al. Synthes is of spinel LiMn2O4nanoparticles through one step hydrothermal reaction[J].J Power Sources,2007,17(1):410-415.
[8] 吴显明,李润秀,何则强,等. 采用溶液沉积及快速退火制备LiMn2O4薄膜的研究[J]. 人工晶体学报,2009,3(1):221-225.
[9] 汤晓壮,谭柱中,潘其经,等. 用金属锰粉湿法制取四氧化三锰的理论和实践[J]. 中国锰业,1997,15(1):42-45.
[10]王成刚,朱军,韩景智,等. 碳酸锰热解过程的动力学[J].中国有色金属学报,2000,10(1):113-115.
[11]薛娟琴,王成刚,刘小勇,等. 以硫酸锰为原料制备四氧化三锰的理论分析[J]. 西安建筑科技大学学报,2000,32(3):297-299.
[12]李华成,李肇佳,卢道焕,等. 提高锰酸锂产能及压实密度的实验研究[J].中国锰业,2012,30(3):13-16.
[13] Ohzuku T,Brodd R J. An overview of positive-electrode materials for advanced lithium-ion batteries[J]. J Power Sources,2007,174(2):449-456.
[14] Fu Z W,Qin Q Z. Electrochemical and electrochromic properties of niobium oxide thin films fabricated by pulsed laser deposition[J].J Electrochem Soc,1999,146(10):3914-3918.
