青蒿琥酯下调人喉癌细胞所致T细胞免疫抑制的体外实验研究
2015-04-12杨彦忠崔澂马有祥唐坚段乃超任秀敏
杨彦忠 崔澂 马有祥 唐坚 段乃超 任秀敏
作者单位: 050000石家庄市,河北医科大学第二医院耳鼻喉科(杨彦忠、段乃超、任秀敏) ;中国人民解放军白求恩医务士官学校医学技术系(崔澂、唐坚) ;首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(马有祥)
青蒿琥酯下调人喉癌细胞所致T细胞免疫抑制的体外实验研究
杨彦忠崔澂马有祥唐坚段乃超任秀敏
作者单位: 050000石家庄市,河北医科大学第二医院耳鼻喉科(杨彦忠、段乃超、任秀敏) ;中国人民解放军白求恩医务士官学校医学技术系(崔澂、唐坚) ;首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(马有祥)
【摘要】目的体外实验研究青蒿琥酯(ART)对人喉癌细胞所致T细胞免疫抑制的影响。方法制备经ART预处理的人喉癌Hep-2细胞培养上清(ART-S),收集连续2次再培养的上清(分别称为ART-S1、ART-S2),以不经ART作用的Hep-2及其上清作对照;分析对人外周血单个核细胞经光镜观察、噻唑蓝(MTT)法测定的植物血凝素(PHA)诱导淋巴细胞转化增殖反应,以及流式细胞计数(FCM)法检测的T淋巴细胞表面CD3ε+、CD3ε+ζ+、IL-2Rα+表达的影响。结果Hep-2对5项免疫指标的抑制率分别为(52.58±6.13) %、(50.34±7.26) %、(45.28±5.38) %、(39.74±5.27) %、(64.25±9.37) %。ART作用后,可显著下调Hep-2所致T细胞免疫抑制(P<0.01) ;第1次再培养后,对淋巴细胞转化、诱导增殖、IL-2Rα表达抑制的逆转均明显降低,与ART-S比较差异有统计学意义(P<0.01),对CD3ε+及CD3ε+ζ+表达抑制的逆转持续增强,与ART-S比较差异有统计学意义(P<0.05) ;第2次再培养后,对淋巴细胞转化、诱导增殖、IL-2Rα表达抑制的逆转继续保持,与ART-S1比较差异无统计学意义(P>0.05),对CD3ε+、CD3ε+ζ+表达抑制的逆转明显下降回复至ART-S水平,差异无统计学意义(P>0.05)。结论人喉癌Hep-2细胞可产生T细胞免疫抑制作用,ART可对其产生稳定的逆转作用。下调肿瘤免疫抑制是ART的重要抗瘤机制之一。
【关键词】青蒿琥酯;喉癌; Hep-2细胞; T淋巴细胞;免疫抑制;逆转
E-mail: cuicheng7777@ sina.com
喉癌是喉部最常见的恶性肿瘤,近年来发病率有明显增长的趋势[1]。传统手术及放化疗多加重恶性肿瘤所致免疫抑制,使其很难与各种免疫增强治疗协同发挥理想疗效[2,3]。因此,急需寻找具有免疫抑制逆转效应,且不对机体免疫功能造成进一步损伤的新型多靶点抗瘤药物。本研究旨在通过体外实验,研究青蒿琥酯(artesunate,ART)对人喉癌细胞所致T细胞免疫抑制的影响,以进一步验证其新型抗瘤机制,为拓宽其临床应用、解决喉癌治疗中的难题提供新思路。
1 材料与方法
1.1实验材料人喉癌Hep-2细胞,为中国人民解放军白求恩国际和平医院科研中心徐铮教授惠赠。外周血取自健康成年志愿者20名,男女各半,年龄27~32岁,平均年龄(29.6±2.5)岁。所有志愿者均已知情同意。
1.2主要试剂及仪器DMEM为北京海克隆生物化学制品有限公司产品,每升完全培养液(complete medium,CM)中含胎牛血清0.1 L、青霉素100 000 U、链霉素100 mg;标准胎牛血清为天津市灏洋生物制品科技责任有限公司产品;青霉素及链霉素为华北制药集团产品。胰蛋白酶、植物血凝素(phytohemagglutinin,PHA)、噻唑蓝[3-(45-dimethy1-2-thiazolyl) -2,5-diphenyl-2H-tetrazolium,MTT]均为美国Sigma公司产品;以0.01 mol/L pH值7.4的PBS将MTT配制成5 g/L。淋巴细胞分离液为上海恒信化学试剂有限公司产品[密度(1.077±0.002) g/ml]。注射用ART粉剂为桂林南药股份有限公司产品,国药准字H10930195,60 mg/瓶,以1 ml 5% NaHCO3溶解,实验前用CM稀释至所需浓度。异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的小鼠抗人CD3ε单抗(CD3-FITC)及CD4单抗(CD4-PE)、藻红蛋白(Phycoerythrin,PE)标记的小鼠抗人CD25 (IL-2Rα)单抗(CD25-PE)及CD247(CD3ζ链)单抗(CD247-PE)均为美国eBioscience公司产品。MK353型酶联免疫检测仪为芬兰Thermolabsystems公司产品,EPICS-XL4型流式细胞检测仪为美国Beckman Coulter公司产品。
1.3实验用ART浓度的确定取对数生长期Hep-2细胞加入96孔培养板,100 μl/孔,再分别加入系列稀释的不同浓度ART (100 μl/孔),使细胞终浓度为2× 108/L,ART的终浓度分别为200 mg/L、100 mg/L、50 mg/L、25 mg/L、12.50 mg/L、6.25 mg/L、3.125 mg/L;设立培养液空白对照孔,单纯Hep-2细胞对照孔(Control) ;一式三份,混匀后置37℃5% CO2饱和湿度中孵育24 h,MTT法检测492 nm波长的A 值(A492),选择对Hep-2细胞增殖无影响的ART最高浓度作为实验用浓度。
1.4ART作用及作用后再培养的Hep-2细胞及培养上清的制备收集对数生长期Hep-2细胞,0.25%胰蛋白酶消化,分别用不含和含选定浓度ART的CM重悬至2×108/L,37℃5% CO2饱和湿度中培养24 h,离心收集未经ART作用同步培养的相应对照细胞(control-C)及上清(control-S),以及经ART作用后的细胞(ART-C)及上清(ART-S)。细胞经彻底清洗去除残余药物后,重悬至初始接种浓度再培养,收集连续2次再培养的细胞及上清(分别称为ART-C1、ART-S1 及ART-C2、ART-S2),以不经ART作用的相应同步再培养细胞及上清作为对照(分别称为control-C1、control-S1及control-C2、control-S2)。培养的细胞均以台盼兰染色法进行活细胞计数,MTT法检测细胞增殖的A492值;收集的上清-70℃冻存备用。
1.5Hep-2细胞培养上清对PBMC生长增殖的影响
常规制备健康志愿者外周血单个核细胞(peripheral blood monouclear cells,PBMC)悬液(5×109/L)加入96孔培养板,100 μl/孔,再分别加入Hep-2肿瘤细胞培养上清,100 μl/孔;设立不含肿瘤细胞培养上清的PBMC对照孔(control)和培养液空白对照孔;均设3复孔。混匀后置37℃5% CO2饱和湿度中培养72 h,MTT法进行检测。
1.6各种培养上清对人PBMC T淋巴细胞免疫功能指标的影响
1.6.1对植物血凝素(PHA)诱导淋巴细胞增殖反应的影响:常规制备健康志愿者PBMC悬液(1×1010/L)加入96孔培养板中,实验孔每孔加入PBMC、PHA (20 mg/L)各50 μl及待测上清100 μl;设立以CM代替待测上清的PHA诱导增殖正常对照孔(control)、单纯PBMC对照孔及培养液空白对照孔;均设三复孔,混匀后37℃5% CO2饱和湿度中培养72 h。取沉淀细胞涂片,自然干燥后以95%乙醇固定15 min,经苏木精-伊红染色,光镜下观察淋巴细胞转化情况,计数200个淋巴细胞,计算淋巴细胞转化率=(转化的淋巴细胞数/200)×100%;同时,以MTT法检测诱导增殖的A492值,按下式计算淋巴细胞诱导增殖抑制率(%)=[(control组A492值-实验组A492值)/control组A492值]×100%。
1.6.2对T淋巴细胞表面活化信号分子表达的影响:常规制备健康志愿者PBMC悬液(1×1010/L),在5 ml培养瓶中加入PBMC、PHA(20 mg/L)各0.25 ml及待测上清0.5 ml;设立以CM代替待测上清的正常对照(control)。37℃5% CO2饱和湿度中培养48 h,取1× 106个细胞,分别加入CD4-FITC及CD25-PE或CD3-FITC及CD247-PE单抗各20 μl,室温避光孵育20 min。离心弃上清,0.5 ml PBS悬浮细胞,上机检测CD3ε+、CD3ε+ζ+、IL-2Rα+细胞表达百分率,分别计算表达抑制率(%)=[(control组阳性细胞百分率-实验组阳性细胞百分率)/control组阳性细胞百分率]×100%。每次均设定淋巴细胞门,并用相同荧光素标记的人Isotype IgG作为阴性对照。
1.7统计学分析应用SPSS 13.0统计软件,计量资料以±s表示,采用F检验进行单因素方差分析(ANOVA),q检验进一步对多个样本均数间进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1实验用ART浓度的确定与无ART作用的对照组比较,ART作用于初始接种终浓度为2×108/L的Hep-2细胞24 h后,MTT法检测A492值差异无统计学意义(P>0.05)的最高浓度为6.25 mg/L,即对Hep-2肿瘤细胞无直接毒性的ART最高浓度,确定为实验用浓度。经确定浓度的ART作用24 h及作用后连续两次再培养的Hep-2肿瘤细胞,活细胞计数及MTT法检测的A492值与未经ART作用同步培养的Hep-2细胞比较,差异无统计学意义(P>0.05)。表明6.25 mg/L的ART作用于Hep-2细胞24 h后未影响其细胞生长增殖活性。见图1,表1。

图1 系列浓度的ART对Hep-2细胞生长增殖的影响
表1 ART作用后对Hep-2细胞生长增殖的影响 ±s

表1 ART作用后对Hep-2细胞生长增殖的影响 ±s
组别 细胞数(×108/L) (n=3) A492(n=10) control-C 4.35±0.10 1.22±0.08 control-C1 4.27±0.08 1.20±0.10 control-C2 4.17±0.25 1.18±0.12 ART-C 4.22±0.09 1.21±0.09 ART-C1 4.29±0.04 1.17±0.11 ART-C2 4.28±0.17 1.16±0.15 F值2.712 0.3951 P值0.097 0.843
2.2Hep-2肿瘤细胞培养上清对PBMC增殖的影响
ART肿瘤细胞培养上清与PBMC共培养后,所检测的A492值与对照组差异无统计学意义(P>0.05),表明实验用肿瘤细胞培养上清对肿瘤免疫抑制检测指示细胞PBMC无直接毒性作用。见表2。
2.3Hep-2肿瘤细胞对T细胞免疫功能的影响在以培液代替Hep-2培养上清进行正常免疫功能指标检测的正常对照组(control),淋巴细胞转化率、淋巴细胞诱导增殖的A492值、CD3ε+、CD3ε+ζ+、IL-2Rα+
表2 Hep-2细胞培养上清对PBMC生长增殖的影响n=5,±s

表2 Hep-2细胞培养上清对PBMC生长增殖的影响n=5,±s
组别A492 control-C 0.31±0.05 control-C1 0.29±0.07 control-C2 0.32±0.06 control 0.28±0.05
细胞百分率分别为(82.34±5.68) %、(0.94±0.05)、(86.07±10.05) %、(25.09±5.84) %、(39.11± 5.83) %。单纯肿瘤细胞培养上清(control-S1)可使5项免疫功能指标明显受抑,分别为(42.06±7.34) %、0.49±0.08、(49.03±7.10) %、(15.75±4.33) %、(14.99±3.21) % (P<0.01),抑制率分别为(52.58 ±6.13) %、(50.34±7.26) %、(45.28±5.38) %、(39.74±5.27) %、(64.25±9.37) %。
2.4ART对Hep-2所致T细胞免疫抑制的影响
2.4.1对PHA诱导淋巴细胞转化及增殖抑制的影响: ART直接作用后,可显著下调Hep-2肿瘤细胞所致T淋巴细胞诱导转化及增殖抑制[ART-S与control-S比较,差异有统计学意义(P<0.05)];其第1次再培养上清(ART-S1)对免疫功能抑制的逆转作用均明显降低[与ART-S、control-S1比较,差异有统计学意义(P<0.01)];此种免疫抑制逆转作用在其第2次再培养上清(ART-S2)中可继续保持[与ART-S1比较,差异无统计学意义(P>0.05)];与control-S2比较,差异有统计学意义(P<0.01)]。见表3、4。
2.4.2T淋巴细胞表面活化信号分子表达抑制的影响: ART直接作用后,可显著下调Hep-2肿瘤细胞所致的CD3ε+、CD3ε+ζ+、IL-2Rα+表达抑制[ART-S 与control-S比较,差异有统计学意义(P<0.01)];其第1次再培养上清(ART-S1)对IL-2Rα+表达抑制的逆转作用明显降低[与ART-S比较,差异有统计学意义(P<0.05) ;与control-S1比较,差异有统计学意义(P<0.01)],对CD3ε+及CD3ε+ζ+表达抑制的逆转作用持续增强[与ART-S比较,差异有统计学意义(P<0.05)];与control-S1比较,差异有统计学意义(P<0.01)];其第2次再培养上清(ART-S2),对IL-2Rα表达抑制的逆转作用继续保持[与ART-S1比较,差异无统计学意义(P>0.05)];与control-S2比较,P<0.01),对CD3ε+及CD3ε+ζ+表达抑制的逆转作用明显下降[与ART-S1比较,差异有统计学意义(P<0.05) ;与control-S1比较,差异有统计学意义(P<0.01)]回复至ART-S水平,差异无统计学意义(P>0.05)。见表3、4。
3 讨论
受空气污染、生活工作压力等因素影响,近年来喉癌发病率呈上升趋势[1]。目前,临床常规采用手术结合放化疗方案,但综合疗效不甚理想。其中,喉癌细胞产生的免疫抑制是制约综合疗效充分发挥的瓶颈性难题,尤为突出和关键的是肿瘤细胞所致T淋巴细胞免疫抑制[4-6]。本研究通过体外实验初步揭示了新型抗瘤中药制剂ART对喉癌T细胞免疫抑制的下调作用。
实验整体设计中考虑到ART在超过一定浓度范围后,可影响待测免疫指标中指示细胞的增殖存活状态及功能,因此,我们在其作用喉癌Hep-2细胞后,彻底洗去残存的中药制剂,取再培养的Hep-2细胞及其上清进行实验,且不经药物作用的单纯Hep-2培养上清对免疫指示细胞PBMC的生长增殖亦无影响,确保能真实反映ART对Hep-2肿瘤细胞所致T细胞免疫抑制的影响,而非ART及肿瘤细胞上清对免疫指示细胞生长增殖的直接影响。同时,肿瘤免疫抑制是肿瘤细胞分泌并存在于肿瘤细胞培养上清中的免疫抑制物质所直接引发的结果,而肿瘤细胞的分泌功能又直接取决于其自身增殖活性,因此,我们所使用的ART浓度不能影响Hep-2肿瘤细胞的生长增殖。结果显示,2×108/L Hep-2细胞经6.25 mg/L ART作用24 h,及作用后洗去残留药物再行连续两次24 h传代培养的细胞,其活细胞计数及MTT法检测A492值与未经药物作用同步对照培养的Hep-2之间差异无统计学意义(P>0.05)。以上实验设计和各种实验条件确定表明,本实验结果确能真实反映ART对人喉癌Hep-2细胞所致T淋巴细胞免疫抑制的影响,而非药物改变肿瘤细胞和免疫检测指示细胞的增殖存活状态所致。
PHA是T淋巴细胞多克隆激活剂,凡有功能活性的人T淋巴细胞均可被诱导转化增殖; IL-2Rα是T淋巴细胞活化标志,其表达率可反映T淋巴细胞活化水平; CD3ε和ζ链是T淋巴细胞活化信号转导的重要膜分子,CD3ε+ζ+表达率可反映T淋巴细胞活化信号转导水平。因此,本研究选用人PBMC的PHA诱导转化增殖、细胞表面IL-2Rα和CD3ε+ζ+表达,可较好地反映T淋巴细胞的免疫功能[7]。结果显示,人喉癌Hep-2细胞培养上清可稳定地显著抑制所测PBCM 的5项免疫功能指标,对T淋巴细胞诱导增殖以及CD3ε链、ζ链、IL-2Rα等T淋巴细胞活化信号表达的抑制率可达50%左右。ART作用后,均可使Hep-2细胞所致T淋巴细胞免疫抑制发生一定程度的逆转。其中,对CD3ε+ζ+表达抑制的逆转可使其暂时完全恢复至正常对照组水平;淋巴细胞转化、诱导增殖抑制以及IL-2Rα+表达抑制的下调程度及维持时间相近,CD3ε+、CD3ε+ζ+表达抑制的下调程度及维持时间相近。上述结果提示,ART可有效下调人喉癌细胞对T淋巴细胞功能的抑制,从而使T淋巴细胞部分恢复其正常抗瘤活性,部分消除肿瘤细胞免疫抑制。其中,人喉癌Hep-2细胞对T淋巴细胞IL-2Rα+表达的抑制作用最强,ART对其表达抑制的逆转强度相对较弱、对CD3ε+ζ+表达抑制的逆转作用较强。因此,下调肿瘤免疫抑制是ART的重要抗瘤作用机制之一。
表3 ART作用后的Hep-2细胞对健康成人外周血T淋巴细胞免疫功能的影响n=10,±s
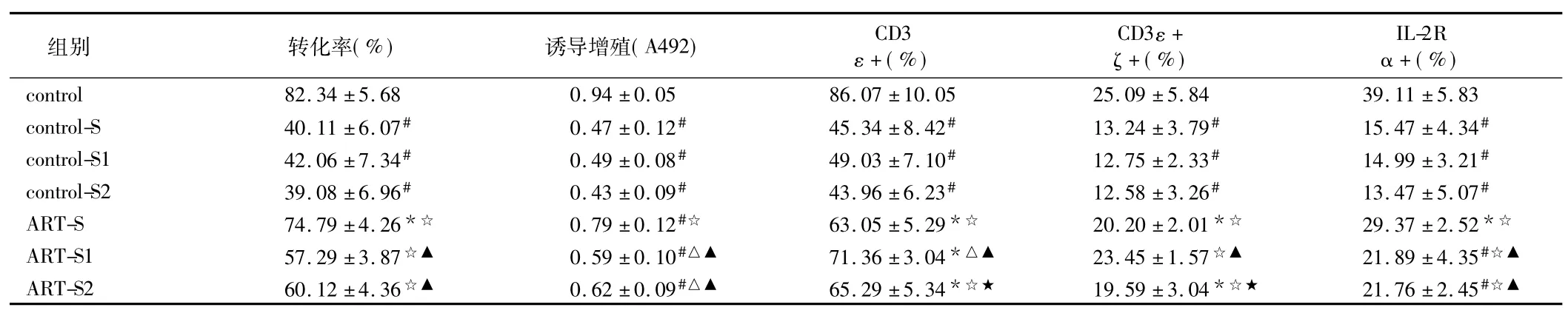
表3 ART作用后的Hep-2细胞对健康成人外周血T淋巴细胞免疫功能的影响n=10,±s
注:与control比较,*P<0.05,#P<0.01;与control-S、control-S1、control-S2比较,△P<0.05,☆P<0.01;与ART-S比较,▲P<0.05;与ART-S1比较,★P<0.05
组别 转化率(%) 诱导增殖(A492) CD3 ε+(%) CD3ε+ζ+(%) IL-2R α+(%) control 82.34±5.68 0.94±0.05 86.07±10.05 25.09±5.84 39.11±5.83 control-S 40.11±6.07# 0.47±0.12# 45.34±8.42# 13.24±3.79# 15.47±4.34#control-S1 42.06±7.34# 0.49±0.08# 49.03±7.10# 12.75±2.33# 14.99±3.21#control-S2 39.08±6.96# 0.43±0.09# 43.96±6.23# 12.58±3.26# 13.47±5.07#ART-S 74.79±4.26*☆ 0.79±0.12#☆ 63.05±5.29*☆ 20.20±2.01*☆ 29.37±2.52*☆ART-S1 57.29±3.87☆▲ 0.59±0.10#△▲ 71.36±3.04*△▲ 23.45±1.57☆▲ 21.89±4.35#☆▲ART-S2 60.12±4.36☆▲ 0.62±0.09#△▲ 65.29±5.34*☆★ 19.59±3.04*☆★ 21.76±2.45#☆▲
表4 ART对Hep-2细胞所致T淋巴细胞免疫抑制的下调影响 n=10,±s

表4 ART对Hep-2细胞所致T淋巴细胞免疫抑制的下调影响 n=10,±s
注:与control-S、control-S1、control-S2比较,*P<0.01;与ART-S比较,#P<0.05;△P<0.01;与ART-S1比较,☆P<0.05
组别 转化率(%) 诱导增殖(A492) CD3ε+(%) CD3ε+ζ+(%) IL-2Rα+(%) control-S 51.31±8.07 51.26±3.65 47.12±7.9242.23±8.14 60.24±7.54 control-S1 52.58±6.13 50.34±7.26 45.28±5.38 39.74±5.27 64.25±9.37 control-S2 50.96±8.62 53.89±5.21 49.67±7.12 45.46±9.03 63.17±8.22 ART-S 10.06±3.67* 16.20±4.25* 25.74±6.08* 20.03±5.34* 25.69±6.37*ART-S1 30.34±5.27*△ 38.23±5.09*△ 16.93±6.41* # 6.73±0.54* # 44.13±7.26* #ART-S2 26.12±6.23*△ 35.99±6.11*△ 23.45±5.43*☆ 21.10±3.34*☆ 43.39±8.11*#
ART是青蒿素的单体衍生物,是我国科学工作者自主研发的抗疟药[8],其抗瘤活性是近年来研究的热点。与已证实有抑瘤效果的中药制剂相比,ART注射液制剂使用方便、起效较快、作用较强、临床应用价值较高,且对化疗药物的交叉耐药作用小,可有效诱导肿瘤细胞凋亡和分化、影响肿瘤新生血管形成、抑制肿瘤细胞生长增殖[9-12]。本研究结果显示,ART还可同时发挥下调肿瘤免疫抑制的作用。因此,ART在抗瘤效应发挥过程中,具多靶点作用、安全高效、价廉无毒、不易产生抗药性等优势,既可正向杀伤抑制肿瘤细胞、提高机体抗瘤免疫功能,又可反向逆转肿瘤免疫抑制,可从不同角度的机制途径发挥多靶点抗瘤功效。
目前,恶性肿瘤的治疗手段已由单一的手术治疗加放化疗逐步向以手术治疗为核心的个体化综合治疗模式转变,而个体化的针对性主要集中体现在由于患病机体抗瘤免疫功能的个体化差异所导致的肿瘤生长增殖状况及预后的不同,其中肿瘤免疫抑制状况是影响综合治疗效果的关键。因此,本研究通过靶向肿瘤免疫抑制逆转作用研究,扭转输注免疫效应细胞或分子提高患病机体抗瘤免疫的被动劣势,以主动直接地矫正抗瘤能力,使机体摆脱肿瘤免疫逃逸,应能达到增强临床治疗效果、提高生存率的目的。同时,这还将为寻找肿瘤免疫抑制逆转类抗瘤药剂、深入挖掘ART的抗瘤潜力和新机制提供理论依据。
参考文献
1杨桦,黄德亮主编.头颈外科临床治疗学.第1版.郑州:郑州大学出版社,2012.288-297.
2Liu P,Jaffar J,Zhou Y,et al.Inhibition of TGFbeta1 makes nonimmunogenic tumor cells effective for therapeutic vaccination.J Immunother, 2009,32: 232-239.
3Yigit R,Massuger LFAG,Figdor CG,et al.Ovarian cancer creates a suppressive microenvironment to escape immune elimination.Gynecol Oncol,2010,117: 366-372.
4Zloza A,Jagoda MC,Lyons GE,et al.CD8 co-receptor promotes susceptibility of CD8+T cells to transforming growth factor-beta (TGF-beta) -mediated suppression.Immunol Immunother,2011,60: 291-297.
5Ksendzovsky A,Feinstein D,Zengou R,et al.Investigation of immunosuppressive mechanisms in a mouse glioma model.J Neurooncol,2009,93: 107-114.
6Hsiao YW,Liao KW,Hung SW,et al.Tumor-infiltrating lymphocyte secretion of IL-6 antagonizes tumor-derived TGF-beta and restores the lymphokine-activated killing activity.J Immunol,2004,172: 1508-1514.
7王兰兰,许化溪主编.临床免疫学检验.第5版.北京:人民卫生出版社,2012.134-149.
8Hendriksen IC,Mtove G,Kent A,et al.Population pharmacokinetics of intramuscular artesunate in African children with severe malaria: implications for a practical dosing regimen.Clin Pharmacol Ther,2013,93: 443-450.
9周天贵,周承贵,袁红纲,等.青蒿琥酯和TRAIL对前列腺癌细胞凋亡诱导作用的实验研究.重庆医学,2010,39: 663-665.
10杜幼芹,肖长义.青蒿琥酯对U14细胞的体内外抑制作用及机制.山东医药,2009,49: 37-39.
11Rasheed SA,Efferth T,Asangani IA,et al.First evidence that the antimalarial drug artesunate inhibits invasion and in vivo metastasis in lung cancer by targeting essential extracellular proteases.Int J Cancer,2010,127: 1475-1485.
12Zeng QP,Zhang PZ.Artesunate mitigates proliferation of tumor cells by alkylating heme-harboring nitric oxide synthase.Nitric Oxide,2011,24: 110-112.
Down-regulating effect of Artesunate on T lymphocytes’immunosuppression in human laryngocarcinoma cells in vitro
YANG Yanzhong*,CUI Cheng,MA Youxiang,et al.*
Department of Otorhinolaryngology,The Second Hospital of Hebei Medical University,Shijiazhuang 050000,China
【Abstract】ObjectiveTo investigate the effects of Artesunate (ART) on T lymphocytes’immunosuppression in human laryngocarcinoma cells in vitro.MethodsThe supernatants from Hep-2 (human laryngocarcinoma cell line) were pretreated with ART (ART-S),then the supernatants cultured for the first time and the second time were collected (ART-S1 and ART-S2,respectively),and the corresponding supernatants and Hep-2 without ART treatment were served as control group.The effects of different supernatants on immune parameters in human peripheral blood mononuclear cells were analyzed,including the lymphocytes proliferation induced by phytohemagglutinin (PHA),which was detected by MTT and microscope observation,and expressions of CD3ε+,CD3ε+ζ+and IL-2Rα+were measured by flow cytometry (FCM).Results The inhibitory rates of five immune parameters caused by Hep-2 cells were 52.58%±6.13%,50.34%±7.26%,45.28%± 5.38%,39.74%±5.27%,64.25%±9.37%,respectively.After pretreated with ART,the inhibition effects caused by Hep-2 were significantly decreased (P<0.01).After the first culture,the reversing effect on the inhibition of lymphocytes transformation,induced proliferation and the expression of IL-2Rα+were significantly decreased in ART-S1 group,as compared with those in ART-S group (P<0.01),and the reversing effects on the inhibition of CD3ε+and CD3ε+ζ+expressions were obviously kept,as compared with those in ART-S group (P<0.05).After the second culture,there were no significant differences in,reversing effects on the inhibition of lymphocytes transformation,induced proliferation and the expression of IL-2Rα+between ART-S2 group and ART-S1 group (P>0.05),nor were the reversing effects on the inhibition of CD3ε+and CD3ε+ζ+expressions between ART-S2 group and ART-S1 group (P>0.05).Conclusion
Human laryngocarcinoma Hep-2 cells have T lymphocytes immunosuppression effects.However Artesunate can steadily reverse the immunosuppression effects.Down-regulating tumor immunosuppression effect may be one of important anti-tumor action mechanisms of Artesunate.
【Key words】Artesunate; laryngocarcinoma; Hep-2; T lymphocytes; immunosuppression; reversion
(收稿日期:2014-07-20)
通讯作者:崔澂,050081石家庄市,中国人民解放军白求恩医务士官学校医学技术系;
doi:10.3969/j.issn.1002-7386.2015.07.003
【文章编号】1002-7386(2015) 07-0972-05
【文献标识码】A
【中图分类号】R 285.5
