复方七芍降压片对SHR内皮损伤的干预作用*
2015-04-12雍苏南张稳谭超王顺民谭元生
雍苏南 张稳 谭超 王顺民 谭元生
高血压病患病率居慢性病首位,同时也是心脑血管病最主要的危险因素。高血压的发病机制目前尚未完全阐明,仍在不断探索中。近年来研究表明,免疫炎症反应诱导的内皮功能障碍是高血压病重要的发病机制和关键环节[1]。这提示抗炎和内皮保护等联合治疗可能成为除降压治疗之外治疗高血压病的必要手段。本实验通过观察自发性高血压大鼠(spontaneously hypertensive rats,SHR)血压、血清白细胞介素-6(IL-6)和白细胞介素-8(IL-8)及肿瘤坏死因子-α(TNF-α)中药干预后的变化,研究复方七芍降压片对高血压病降压作用的可能机制,以期在中医药方面寻求防治高血压病的新思路和新方法,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄SHR 48只,体重230~270 g,雄性,清洁级,由上海斯莱克实验动物有限责任公司提供,动物生产许可证号:SCXK(沪2007-0005)。8周龄Wistar-kyoto(WKY)大鼠12只,体重225~280 g,雄性,清洁级,由上海斯莱克实验动物有限责任公司提供,动物生产许可证号:SCXK(沪2007-0005)。实验动物环境设施合格证号:SYXK(湘)2009-0001。
1.1.2 实验药物 本院药剂科制备,批号:20141116;卡托普利片(25 mg/片),中美上海施贵宝制药有限公 司 生 产, 批 号:20140914;Rat IL-6 ELISA Kit试剂盒,CUSABIO公司生产,批号:Y05031105;Rat IL-8 ELISA Kit试剂盒,CUSABIO公司生产,批号:Y17031107;Rat TNF-αELISA Kit 试剂盒,CUSABIO公司生产,批号:Y05031106。
1.1.3 实验仪器 BP-2006A型智能无创血压计(北京软隆科技有限责任公司),DT1000A型电子天平(江苏省常熟市长春仪器厂制造),biocell2010型酶标仪(奥地利)。
1.2 方法
1.2.1 分组及给药 将48只SHR随机分为模型组(SHR-M组)、卡托普利组(SHR-K组)、复方七芍降压片低剂量治疗组(SHR-D组)、复方七芍降压片高剂量治疗组(SHR-G组)4个组,每组12只,12只WKY大鼠为正常组(WKY组)。复方七芍降压片(压片前)成人每日用量为49 g,低剂量治疗组以成人等效量(大鼠体表面积/成人平均体表面积×成人每日用量)灌胃,高剂量治疗组以成人等效量4倍灌胃,卡托普利组以成人等效量灌胃。同时,模型组及正常组以等量蒸馏水开始灌胃,给药体积为10 mL/kg。各组灌胃1次/d,连续4周,灌胃期间每周测量1次血压和体重,根据体重随时调整给药量。
1.2.2 SHR尾动脉压的测定 分别在实验开始前,开始1、2、3、4周后,采用尾动脉测压法应用智能无创血压计测量给药前后大鼠血压。在每周第7天14:00-17:00测各组大鼠的血压平均值,为该鼠所在周的血压值。
1.2.3 血清IL-6、IL-8及TNF-α的测定 末次药后待血压测定完成后,用20%乌拉坦腹腔麻醉,腹主动脉取血4 mL,静置、分离血清,用酶联免疫吸附双抗体夹心法测定IL-6、IL-8及TNF-α的含量,实验方法严格按照试剂盒说明书进行操作。
1.3 统计学处理 数据处理应用SPSS 17.0软件进行。计量资料以(±s)表示,比较采用t检验,采用单因素方差分析(ANOVA)进行数据之间比较,组间两两比较采用最小显著差值法(LSD),同一组治疗前后比较采用配对。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组降压效果比较 SHR-M组的血压随用药时间的推移逐渐增高,治疗组及SHR-K组则均有下降;治疗前后SHR各组血压均高于WKY组,比较差异均有统计学意义(P<0.01);治疗1、2、3、4周后SHR-K组血压均较治疗前下降且均低于SHR-M组,比较差异均有统计学意义(P<0.01);SHR-D组血压从第3周开始,SHR-G组血压从第2周开始均低于治疗前且均低于SHR-M组,比较差异均有统计学意义(P<0.01);SHR-D及SHR-G组治疗后血压均高于SHR-K组,比较差异均有统计学意义(P<0.01);治疗3、4周后,SHR-G组血压均低于SHR-D组,比较差异均有统计学意义(P<0.05),见表1及图1。

表1 各组大鼠治疗前后血压变化比较(x-±s) mm Hg

图1 各组大鼠治疗前后血压变化比较
2.2 各组血清IL-6、IL-8及TNF-α比较 SHR各组血清炎症因子IL-6、IL-8及TNF-α水平均高于WKY组,比较差异有统计学意义(P<0.01);连续用药4周后,SHR-K组、SHR-D组及SHR-G组血清炎症因子IL-6、IL-8及TNF-α水平均低于SHR-M组,比较差异均有统计学意义(P<0.01);SHR-G组各炎症因子水平均低于SHR-D组,比较差异均有统计学意义(P<0.05),见表2。
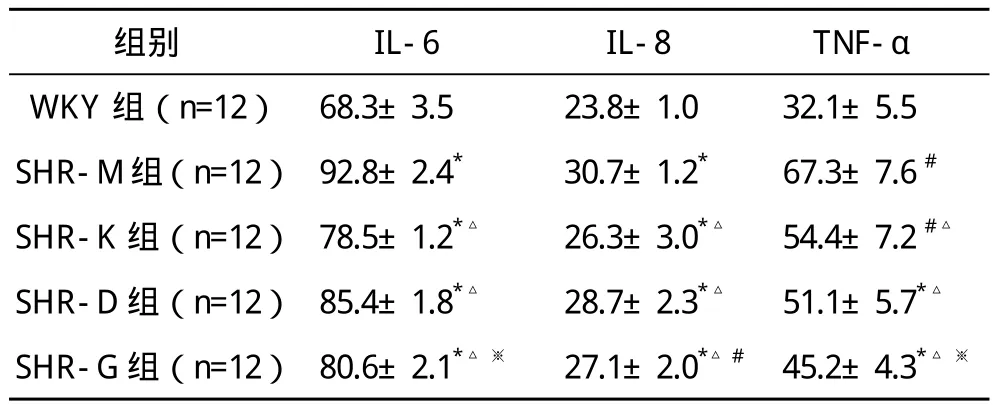
表2 各组大鼠血清IL-6、IL-8和TNF-α水平比较(x-±s)ng/L
3 讨论
血管管腔的表面均覆盖着内皮组织,不仅是一种屏障结构而且具有调节血管舒缩功能、血流稳定性和血管重塑的重要作用。血管内皮具有易损性的功能界面,血液中病理生理变化均先作用于血管内皮,导致内皮细胞功能障碍(endothelial dysfunction,EDF)。血压升高使血管壁的剪切力和应力增加,去甲肾上腺素和AT-Ⅱ等血管活性物质增多,均可损害血管内皮及其功能。内皮功能受损后导致血管舒张和收缩因子、生长抑制和促进物质、促凝和抗凝物质等生成释放不平衡,从而引起生理系统异常[2]。因此内皮功能障碍可能是高血压导致靶器官损害及其合并症的关键环节。血液中的IL-6来源于活化的单核细胞,是一种参与机体免疫和炎症反应的炎症细胞因子[3]。高血压患者普遍存在内皮的炎症反应,因而可生成许多血小板源生长因子和肿瘤坏死因子,成纤维细胞、单核细胞被这些炎症因子诱导产生IL-6,而IL-6又可使成纤维细胞和平滑肌细胞增殖,从而生成大量的PDGF,使得周围血管阻力增高,最终引发高血压。
单核细胞和内皮细胞可分泌IL-8,血清不能灭活IL-8,所以易形成局部累积,它能趋化中性粒细胞,在炎症损伤中起重要作用。IL-8可介导活化中性粒细胞,继而使其与受体结合,从而改变受体构象,超氧阴离子被启动、呼吸爆发,产生局部炎症反应,促进细胞脱颗粒、破坏内皮细胞基底膜完整性和促进中性粒细胞跨内皮细胞游走,达到损伤细胞的作用[4]。
TNF-α也是炎性细胞因子之一,它参与多种病理生理的发生过程,主要是由激活的巨噬细胞分泌形成,也可由血管内皮细胞和血管平滑肌细胞分泌。TNF-α可以促进中性粒细胞氧化代谢及脱颗粒,具有直接细胞毒作用,通过促进脂质过氧化增加血管内皮通透性,引起内皮舒缩功能障碍,从而减少血管内皮细胞释放NO和前列腺素;增加炎性介质IL-1的分泌量,导致血管平滑肌细胞增生、肥大,引起结缔组织增多、内膜增生,血管壁僵硬度增加,使得管腔狭窄,外周阻力增加,导致高血压形成[5-7]。因此,TNF-α在高血压及其并发症的发生过程中扮演中心环节的角色[8]。
高血压病属中医“眩晕”、“头痛”范畴。眩晕可定位于肝肾,肝肾阴虚,水不涵木,阴不维阳,肝阳上亢,肝风内动,发为眩晕,即肝阳化风。肝肾阴虚,一方面阴虚可致血枯脉涩,日久成瘀,瘀血阻络,髓海失濡;另一方面,阴虚阳亢,肝失疏泄,气血运行不畅,日久亦可致瘀血阻络,气血不能上达,清窍失养,眩晕发作,即瘀血化风。故高血压患者中医病机可用“虚、瘀、风”来概括,并且中医理论认为瘀血停滞导致脉络损伤,脉络损伤反过来又能加重瘀血停滞。针对此病病机,采用养阴柔肝、化瘀息风立法的医院制剂复方七芍降压片治疗效果确切。该方由三七、白芍、桑寄生、杜仲、丹参、天麻、萝芙木、地龙、葛根、炒香附、甘草组成。方中三七活血化瘀通络,白芍养阴柔肝息风,共为君药。桑寄生、杜仲补益肝肾,丹参活血祛瘀,天麻平肝息风,均为臣药。萝芙木平肝清热,地龙息风通络,葛根生津活血,炒香附理气疏肝,共为佐药。甘草为使,调和诸药。以上合用,使得阴虚得补,阳亢得平,脉络得畅,髓海得濡、清窍得养、眩晕自止。
剂量,复方七芍降压片对内皮损伤的调节作用可能是其发挥降压作用的机制之一。本研究显示,与SHR-M组比较,随着时间的延长,SHR-K组、SHR-D组及SHR-G组血压均明显降低;治疗3、4周后,SHR-G组血压均低于SHR-D组,比较差异均有统计学意义(P<0.05)。以上结果表明复方七芍降压片有确切的降压效果,且高剂量复方七芍降压片的降压效果较低剂量好。SHR血清IL-6、IL-8以及TNF-α水平存在明显的异常,提示细胞因子IL-6、IL-8以及TNF-α可能是导致高血压病内皮细胞功能障碍的作用因子。治疗后,SHR-K组、SHR-D组及SHR-G组血清炎症因子IL-6、IL-8及TNF-α水平均低于SHR-M组,比较差异均有统计学意义(P<0.01);SHR-G组各炎症因子水平均低于SHR-D组,比较差异均有统计学意义(P<0.05)。以上结果表明复方七芍降压片可降低炎症因子水平,且高剂量的效果优于低剂量,复方七芍降压片对内皮损伤的调节作用可能是其发挥降压作用的机制之一。
[1] Bogdanski P,Kujawska-Luczak M,Lacki J,et al.Evaluation of selected interleukins,tumor near oasis factor,insulin and lepton in obese patients with hypertension[J].Pol Merkur Lekarski,2003,15(88):347-351.
[2]朱树雄.血管内皮功能不全及其防治与心力衰竭[J].岭南心血管病杂志,2001,7(5):331-334.
[3]朱瑞,王运杰,卞威,等.高血压性脑出血血肿周围脑组织白细胞介素-6的表达[J].国际神经病学神经外科学杂志,2008,35(5):393-397.
[4]陆如岳,罗利飞,朱红国.35例原发性高血压病患者血管内皮功能及炎症因子的变化[J].放射免疫学杂志,2010,23(3):294-295.
[5]谭安雄,钱凤,朱耀斌,等.替米沙坦减少高血压合并2型糖尿病患者炎症细胞因子和内皮素[J].中华高血压杂志,2009,17(3):226-229.
[6]杨静,李新立,陶芳,等.原发性高血压患者动脉僵硬度与血栓调节蛋白和肿瘤坏死因子-α的关系[J].中华高血压杂志,2009,17(4):351-354.
[7]陈建英,陈晓于,谢晓明,等.生脉注射液对老年单纯收缩期高血压患者TNF-α和IL-6水平的影响[J].中南药学,2009,7(8):577-579.
[8]褚剑锋,陈可冀.炎症与高血压应对策略[J].中西医结合心脑血管病杂志,2007,5(2):95-98.
