40例结直肠癌肝转移手术前应用新辅助化疗效果观察
2015-04-12丁祥林
丁祥林
结直肠癌是严重威胁人类生命安全的恶性肿瘤之一,据相关文献[1]统计结果显示,该疾病致死率在美国的所有恶性肿瘤中位居第二,而在中国则位居第五,近些年发生率逐年增长,越来越引起人们的重视。结直肠癌致死的患者中大约50%是因为肿瘤发生了转移,这其中70%发生了肝转移[2]。目前外科手术治疗是最主要的手段,患者的5年存活率与接受手术的时间呈显著的负相关性,但在患者初次就诊时能接受根治性手术的通常不超过15%[3]。结直肠癌发展至晚期后往往病情极为复杂,此时如何增加根治性手术的切除率以及术后的复发率成为关注的焦点。有研究显示新辅助化疗能为根治性手术的实施争取机会,但目前国内相关资料较少,笔者自2013年7月-2015年7月期间采用新辅助化疗治疗结直肠癌肝转移,现将相关情况报告如下,为临床治疗提供参考。
1 资料与方法
1.1 一般资料 选取2013年7月-2015年7月期间于苏州永鼎医院肿瘤科收治的结直肠癌肝转移患者共40例,其中男21例,女19例,年龄32~72岁,平均年龄(55.1±10.3)岁。肿瘤原发部位:结肠者共23例,直肠者17例,肿瘤转移至肝后均为多发灶。新辅助化疗方案:单纯FOLFIRI方案者3例,FOLFOX6方案者27例,两种方案联合应用者10例。本研究方案经上报医院伦理委员会审查通过后实施,所有患者在接受治疗前均被告知相应的治疗方案,并签署知情同意书。
1.2 纳入及排除标准 (1)患者均为首次于本院进行住院治疗;(2)所有患者均为单纯肝转移,且自愿接受新辅助化疗;(3)原发灶和转移灶均行病理学诊断确诊;(4)住院前均进行详细的CT或MRI检查并评估确认原发灶、肝转移灶可切除;(5)患者年龄不超过75岁,且KPS评分不低于60分;(6)治疗效果观察指标明确;(7)排除患者合并有高血压、糖尿病、心脏病等全身疾病。(8)排除合并肠穿孔、急性肠梗阻或严重感染等严重并发症者。
1.3 方法
1.3.1 新辅助化疗方案 (1)FOLFOX6方案:奥沙利铂(85 mg/m2)静滴2 h,d1;甲酰四氢叶酸(400 mg/m2)静滴2 h,d1;400 mg/m25-FU静脉推注,紧接下来2.4 g/m25-FU静滴持续46 h,2周后重复1次以上方案。每次实施方案前30分钟均给予患者5-HT3受体拮抗剂以减轻呕吐反应。嘱患者在治疗期间避免受到冷刺激,若在治疗过程中发现患者病情继续进展或发生 Ⅳ级毒性反应则应及时终止本化疗方案或更换化疗方案。(2)FOLFIRI方案:国产伊立替康180 mg/m2静滴90 min,d1,四氢叶酸钙400 mg/m2静滴2 h,d1,氟尿嘧啶0.4 g/m2静推(四氢叶酸钙之后用),氟尿嘧啶2.4 g/m2持续静脉灌注(经化疗泵灌注)46 h,每14天重复,14 d为一周期,2周后重复1次以上方案。每次实施方案前30分钟均给予患者5-HT3受体拮抗剂以减轻呕吐反应,若患者出现腹泻则及时给与盐酸洛哌丁胺胶囊,若在治疗过程中发现患者病情继续进展或发生顽固性腹泻等严重不良反应则应及时终止本化疗方案或更换化疗方案。
1.3.2 手术方法 患者接受新辅助化疗获得手术条件后停止化疗至少15 d后方可进行手术治疗,开腹或腹腔镜下切除原发灶,开腹手术切除肝转移灶,严格按照无瘤原则进行手术操作,按照结直肠癌手术标准指南确定切除范围,切除标本均送病理检查。
1.4 治疗效果评价标准 同一病灶在接受新辅助化疗后2周进行复查,选择与治疗前相同的检查方法。根据WHO提出的实体瘤治疗效果评价标准(RECIST)对本资料中的患者情况进行评价,新辅助化疗过程中出现的不良反应均进行记录并分析,相关标准参照美国国家癌症研究所提出的化疗毒性分级标准进行,血清CEA若超过5.0 ng/mL则认为是阳性结果。新辅助化疗效果评价结果表示:CR:目标病灶消失;PR:目标病灶至少缩小30%;PD:目标病灶增加超过20%或有新病灶发生;SD:目标病灶缩小程度未达到PR标准或增加程度未达到PD标准。有效=CR+PR。
1.5 统计学处理 采用Excel建立数据库,使用SPSS 18.0统计软件进行分析,计量资料采用(±s)表示,比较采用t检验,计数资料采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者接受新辅助化疗前后血清CEA、原发灶和转移灶的变化情况比较 本资料患者接受新辅助化疗(4.2±0.7)个周期,其中转移灶治疗效果获得CR者共0例,获得PR者共27例,获得PD者共2例,获得SD者共11例,新辅助化疗对转移灶有效率为67.5%(27/40)。原发灶获得CR者共0例,获得PR者共22例,获得PD者共3例,获得SD者共15例,新辅助化疗对原发灶有效率55.0%(22/40)。治疗前血清CEA阳性率为85.0%(34/40),接受新辅助化疗后血清CEA阳性率为47.5%(19/40),新辅助化疗前后血清CEA阳性率比较差异有统计学意义( 字2=5.774,P<0.05)。新辅助化疗前后的原发灶平均大小、转移灶平均大小及血清CEA值比较,差异均有统计学意义(P<0.05),见表 1。
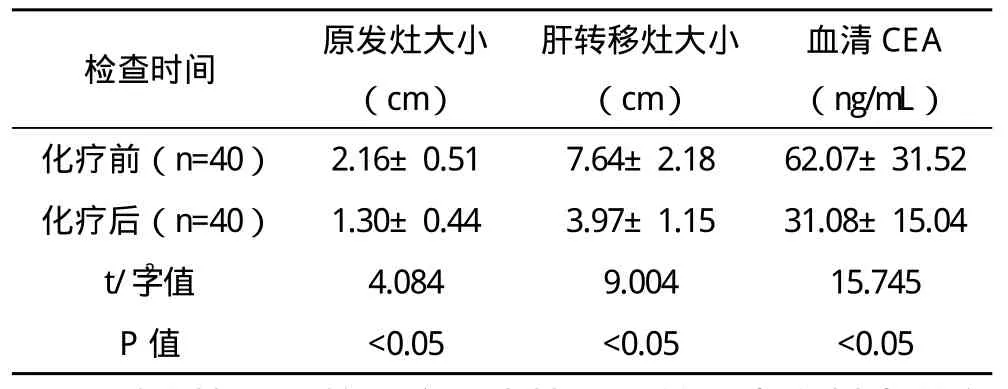
表1 新辅助化疗前后血清CEA值、原发灶大小和转移灶大小的比较(x-±s)
2.2 手术情况及并发症发生情况比较 本资料中共有14例(35.0%)获得根治性切除术,其中1例患者发生切口感染,1例患者发生肝功能衰竭,并发症发生率为5.0%,无患者发生围手术期死亡。
3 讨论
结直肠癌是一种致死率较高的恶性肿瘤疾病,发生肝转移后若不能及时接受根治性手术则患者的5年生存率为0,中位生存时间为7个月[4]。若能及时接受根治性手术则5年生存率可增加至40%~50%,中位生存时间可增长至35个月[5]。利用外科手术的方式将转移灶切除是根治的唯一方法,但接受根治性手术有较为严格的适应证[6]。传统的外科观点认为,根治性手术仅当转移灶被局限在半肝范围内,且转移灶数量低于3个,转移灶发现时间与原发灶被切除之间时间超过12个月,未发生肝门淋巴结或其他部位的转移,手术切缘需超过病灶边缘1 cm等,在这样的要求下,过去仅大约10%的患者能获得根治性手术的机会,但这样的情况明显不符合现代外科手术的要求[7-9]。近些年美国肝胆胰协会提出,若对患者的术前评估认为在将转移灶完全切除后剩余的肝组织仍能完成肝脏的正常生理功能以及相邻的肝组织具有足够的血流和胆道则可进行根治性手术[10]。随着肝脏外科手术技术的发展、对手术器械的改进以及对围手术期的管理提高等因素,目前肝转移灶数量、分布情况以及转移灶大小等对患者能否接受手术方面的影响越来越小[11]。Lehmann等[12]的研究结果表明,传统手术指征的手术接受率为18.1%,扩大手术指征后手术切除率可达到29.4%,而前者术后复发率为29.7%,5年生存率为42.4%,中位生存时间45.1个月,后者术后复发率36.3%,5年生存率为50.7%,中位生存时间58.1个月,扩大手术指征后的手术接受率明显增加(P<0.05),而复发率、5年生存率以及中位生存时间等比较差异均无统计学意义(P>0.05)。
新辅助化疗是通过化疗的方法来获得降低肿瘤临床分期的目的,从而为患者争取到接受根治性手术的机会,同时有利于一些未被发现的微小转移灶被清除,有利于患者预后的改善[13-14]。目前新辅助化疗在进展期乳腺癌以及子宫颈癌等方面获得了广泛的应用,且效果较为理想[15]。本资料中选择了FOLFOX6以及FOLFIRI两种化疗方案单用或联合应用,其中27例(67.5%)的转移灶体积明显缩小,为患者增加了获得根治性手术的机会。在临床上,新辅助化疗的应用有一定的限制,笔者认为在术前评估原发灶和转移灶具备可切除条件或潜在可切除时方可取得较为理想的效果,而对于转移灶被认为是不可切除者,则不适合新辅助化疗,而更倾向于选择姑息性治疗。本研究资料结果显示,新辅助化疗对转移灶有效率67.5%(27/40),对原发灶有效率55.0%(22/40)。治疗前血清CEA阳性率85.0%(34/40),接受新辅助化疗后血清CEA阳性率为47.5%(19/40),新辅助化疗前后血清CEA阳性率比较差异有统计学意义( 字2=5.774,P<0.05),同时血清CEA值比较差异有统计学意义(t=15.745,P<0.05)。新辅助化疗前原发灶平均大小(2.16±0.51)cm,化疗后平均大小(1.30±0.44)cm,化疗前后比较差异有统计学意义(t=4.084,P<0.05)。新辅助化疗前转移灶平均大小(7.64±2.18)cm,化疗后平均大小(3.97±1.15)cm,化疗前后比较差异有统计学意义(t=9.004,P<0.05)。14例(35.0%)获得根治性切除术,其中1例患者发生切口感染,1例患者发生肝功能衰竭,并发症发生率为5.0%,无患者发生围手术期死亡。说明本新辅助化疗方案的安全性较好,能被多数患者所接受,且能增加患者获得根治性切除术的几率。随着肝脏外科手术技术的进一步发展以及新辅助化疗方面研究的进一步深入,新辅助化疗在改善结直肠癌肝转移患者预后中扮演越来越重要的角色。
[1] Tamas K,Walenkamp A M,Hospers G A.Rectal and colon cancer:Not just a different anatomic site[J].Cancer Treat Rev,2015,28(2):5760-5766.
[2] Ayez N,Grünhagen D J,Verhoef C.The use of neo-adjuvant chemotherapy in patients with resectable colorectal liver metastases[J].Eur J Surg Oncol,2015,41(7):859-867.
[3] Fernandes E,Ferreira J A,Santos L L.New trends in guided nanotherapies for digestive cancers[J].J Control Release,2015,10(3):288-307.
[4] Ayez N,Radema S A,Hillegersberg R,et al.Neo-adjuvant chemotherapy followed by surgery versus surgery alone in high-risk patients with resectable colorectal liver metastases[J].BMC Cancer,2015,26(15):180-185.
[5] Bonney G K,Coldham C,Mirza D F.Role of neoadjuvant chemotherapy in resectable synchronous colorectal liver metastasis[J].J Surg Oncol,2015,111(6):716-724.
[6] Slesser A A,Khan F,Rao S.The effect of a primary tumour resection on the progression of synchronous colorectal liver metastases[J]. Eur J Surg Oncol,2015,41(4):484-492.
[7] De Felice F,Musio D,Tombolini V.Neoadjuvant chemoradiotherapy for locally advanced rectal cancer[J].World J Gastrointest Oncol,2014,15(12):438-440.
[8] Berardi R,Maccaroni E,Cascinu S.Locally advanced rectal cancer[J].World J Gastroenterol,2014,20(46):17 279-17 287.
[9] Leung U,Kuk D,Fong Y.Long-term outcomes following microwave ablation for liver malignancies[J].Br J Surg,2015,102(1):85-91.
[10] Khan K,Wale A,Chau I.Colorectal cancer with liver metastases[J].World J Gastroenterol,2014,20(35):12 391-12 406.
[11] Musters G D,Sloothaak D A,Tanis P J.Perineal wound healing after abdominoperineal resection for rectal cancer[J].Int J Colorectal Dis,2014,29(9):1151-1157.
[12] Lehmann A M,Chondrogiannis S,Rubello D.Early prediction of response by 18F-FDG PET/CT during preoperative therapy in locally advanced rectal cancer[J].Eur J Surg Oncol,2014,40(10):1186-1194.
[13] Ahmed S,Johnson K,Iqbal N.Advances in the management of colorectal cancer: from biology to treatment[J].Int J Colorectal Dis,2014,29(9):1031-1042.
[14] Bohac G C,Guaqueta D,Hartshorn K L.Disparity in the use of combined modality therapy for rectal cancer in the older adult[J].J Geriatr Oncol,2013,4(1):90-97.
[15] Schouten S B,De Bruin A F,Harst E.Is microvessel density correlated with anastomotic leakage after low anterior resection[J].Hepatogastroenterology,1900, 61(129):90-93.
