酶法提取鲍鱼内脏蛋白质工艺的研究
2015-04-12陈锦权
郭 芳,方 婷,林 杰,陈锦权
(1.吕梁学院 生命科学系,山西 吕梁 033000;2.福建农林大学 食品科学学院,福建 福州 350002)
鲍鱼(abalone)是海洋软体单壳贝类,属原始腹足目、鲍科[1-2]。其营养价值极高,富含多种生物活性因子[3]。众多研究表明,鲍鱼的内脏中存在具有消炎、抗肿瘤、调节免疫、抗应激等功效的物质[4-8]。水解动物蛋白(hydrolyzed animal protein,HAP)是指蛋白质经过生物催化等方法处理而得到的产物。HAP富含人体必需氨基酸,营养高,性能优,不含胆固醇,因蛋白含量高(其中多为小分子多肽,易溶于水)且人体的吸收利用率高等特点而被评为优质的蛋白源[9]。
工业上主要通过酸法、碱法和酶法等工艺生产HAP。相关研究表明,对不同的动物蛋白原材料,采用不同种类的水解蛋白酶,调整加酶量及其他相关酶解参数,可以生产出优质的HAP[10]。
鲍鱼内脏中富含蛋白质,但是随着鲍鱼养殖业、加工业的迅速发展,大量的鲍鱼脏器被当作加工废弃物而堆积起来,极容易变质腐烂,造成了经济损失的同时也会引来环境污染的问题。因此本试验以鲍鱼内脏为原料,采用胰蛋白酶对提取内脏中蛋白质的反应条件进行了优化,旨为鲍鱼脏器蛋白资源的综合利用提供理论和试验依据。
1 材料与方法
1.1 材料与试剂
鲍鱼内脏:漳州欧圣食品有限公司;胰蛋白酶(4 000 U/g):南宁东恒华道生物科技责任有限公司。
1.2 仪器与设备
L-550台式低速离心机:长沙湘仪离心机有限公司;DHO-9240A电热恒温鼓风干燥机:上海精密试验设备有限公司;FA1004电子天平:上海精天电子仪器有限公司;PHSJ-SF实验室PH计:上海精科有限公司;UV6300PC紫外可见光分光光度计:上海美谱达仪器有限公司;ATN-300 全自动定氮仪:上海洪纪仪器设备有限公司。
1.3 试验方法
1.3.1 酶法提取工艺[11]
冻藏鲍鱼内脏解冻→打浆→过胶体磨→过高压脉冲电场→酒精脱色→鲍鱼内脏预处理液→加水匀浆→调整pH值→酶解→加热灭酶(沸水浴10 min)→冷却离心(4 000 r/min、20 min)→鲍鱼内脏酶解液
1.3.2 鲍鱼内脏蛋白质分离提取的单因素试验
以总氨基酸态氮含量为指标,分别考察料液比、pH值、酶解温度、提取时间、酶量等条件对鲍鱼内脏蛋白提取效果的影响。
1.3.3 鲍鱼内脏蛋白质分离提取的响应面优化试验
在单因素试验的基础上,采用Box-Benhnken试验设计及响应面分析法,探讨pH值、酶用量、温度、料液比及其交互作用对提取效果的影响,并建立提取率和各影响因素间的数学模型,试验因素与水平见表1。

表1 鲍鱼内脏蛋白质分离提取响应面试验因素与水平Table 1 Factors and levels of response surface design for abalone visceral protein extraction optimization
1.3.4 测定方法
蛋白质水解度(degree of hydrolysis,DH):按照参考文献[12]的方法测定;总氨基酸态氮含量:按照参考文献[13]的方法测定;蛋白质含量:按照参考文献[14]的方法测定;氮回收率按照参考文献[15]的方法计算。
2 结果与分析
2.1 单因素变化对鲍鱼内脏蛋白质提取效果的影响
2.1.1 料液比对鲍鱼内脏蛋白质提取效果的影晌
在胰蛋白酶添加量为0.15%,温度为55 ℃,pH值为7.0,时间为4 h的条件下,配制不同料液比,分别进行蛋白提取试验,结果见图1。
由图1可知,总氨基酸态氮含量随料液比的增加呈下降趋势,料液比为1∶4(g∶mL)时,总氨基酸态氮含量最大,随着料液比的增大,提取液总氨基酸态氮含量急剧下降。当料液比>1∶4(g∶mL)以后,减小的速率逐渐变小,最后趋于稳定。但在实际操作中过高浓度的待酶解液会稀释所得的蛋白提取液的浓度,不利于后续的纯化操作[16],所以料液比选为1∶4(g∶mL)。
2.1.2 pH值对鲍鱼内脏蛋白质提取效果的影响
在胰蛋白酶添加量为0.15%,温度为55 ℃,料液比为1∶4(g∶mL),时间为4 h的条件下,分别在不同pH值条件下进行蛋白提取试验,结果见图2。

图2 p H值对鲍鱼内脏蛋白质提取效果的影响Fig.2 Effect of pH on extraction yield of abalone visceral protein
由图2可知,鲍鱼内脏中蛋白质提取率的波动程度受pH的影响比较大。pH值在5~7的范围内,总氨基酸态氮含量随着pH的增大而增大,pH>7时,总氨基酸态氮含量呈下降的趋势。当pH值为7时,总氨基酸态氮含量最高而且条件最温和,有利于蛋白质活性的保存,所以选择最适pH值为7。
2.1.3 酶解温度对鲍鱼内脏蛋白质提取效果的影响
在胰蛋白酶添加量为0.15%,pH值为7.0,料液比为1∶4(g∶mL),时间为4 h的条件下,分别在不同温度条件下进行蛋白提取试验,结果见图3。
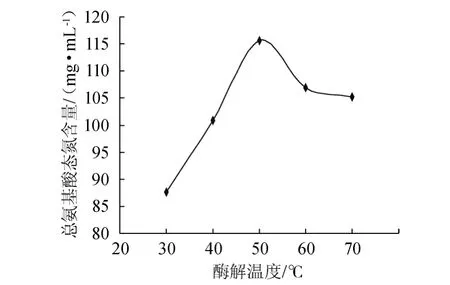
图3 提取温度对鲍鱼内脏蛋白质提取效果的影响Fig.3 Effect of extraction temperature on extraction yield of abalone visceral protein
酶的催化条件具有特异性,不同的酶在特定的温度范围内才能发挥最大的催化作用。因此,适度提高温度可提升酶的催化活力;但酶的化学本质是蛋白质,高温会使蛋白质变性,同样影响酶法提取反应。由图3可知,在酶解温度为30~50 ℃的范围内,总氨基酸态氮含量随温度升高而升高;酶解温度为50 ℃时,总氨基酸态氮含量达到最高值;酶解温度高于50 ℃后,总氨基酸态氮含量随温度的升高而逐渐下降。因此选择最适的酶解温度50 ℃。
2.1.4 提取时间对鲍鱼内脏蛋白质提取效果的影响
在胰蛋白酶添加量为0.15%,pH值为7.0,酶解温度为55 ℃,料液比为1∶4(g∶mL)的条件下,分别在不同提取时间下进行蛋白提取试验,结果见图4。

图4 酶解时间对鲍鱼内脏蛋白质提取效果的影响Fig.4 Effect of enzymolysis time on extraction yield of abalone visceral protein
由图4可知,在1~4 h范围内,提取时间越长,总氨基酸态氮含量越高,但增长速率在3 h后逐渐降低,提取时间4 h时总氨基酸态氮含量达到最大,>4 h之后提取率呈现急剧降低的趋势,这可能是由于提取时间过长引起了蛋白质的过度降解[17]。4 h以后胰蛋白酶的酶解作用已经达到充分状态,继续延长时间反而引起鲍鱼内脏中其他物质分解影响蛋白质的浸出,所以认为较为适宜的提了以时间是4 h。
2.1.5 酶用量对鲍鱼内脏蛋白质提取效果的影响
在料液比为1∶4(g∶mL)时,酶解温度为55 ℃,pH值为7,经4 h 酶解的条件下,测定不同胰蛋白酶用量对总氨基酸态氮含量(Y)的影响,结果见图5。

图5 酶用量对鲍鱼内脏蛋白质提取效果的影响Fig.5 Effect of enzyme addition on extraction yield of abalone visceral protein
由图5可知,胰蛋白酶用量为0.1%~0.2%范围内,随着酶用量的增加,总氨基酸态氮含量快速增加;超过0.2%后,酶用量再增加时,总氨基酸态氮含量变化不明显,所以确定最佳酶用量为0.2%。
2.3 响应面试验
2.3.1 试验结果与分析
试验设计方案和结果见表2。

表2 鲍鱼内脏蛋白质分离提取响应面试验结果与分析Table 2 Results and analysis of response surface experiment for abalone visceral protein extraction optimization
2.3.2 模型的建立及显著性检验
响应数据的方差分析结果见表3,其中F模型=31.09,对应P<0.01,表明回归模型极其显著。失拟项F=1.31,对应P>0.05,不显著,表明此模型拟合较好。
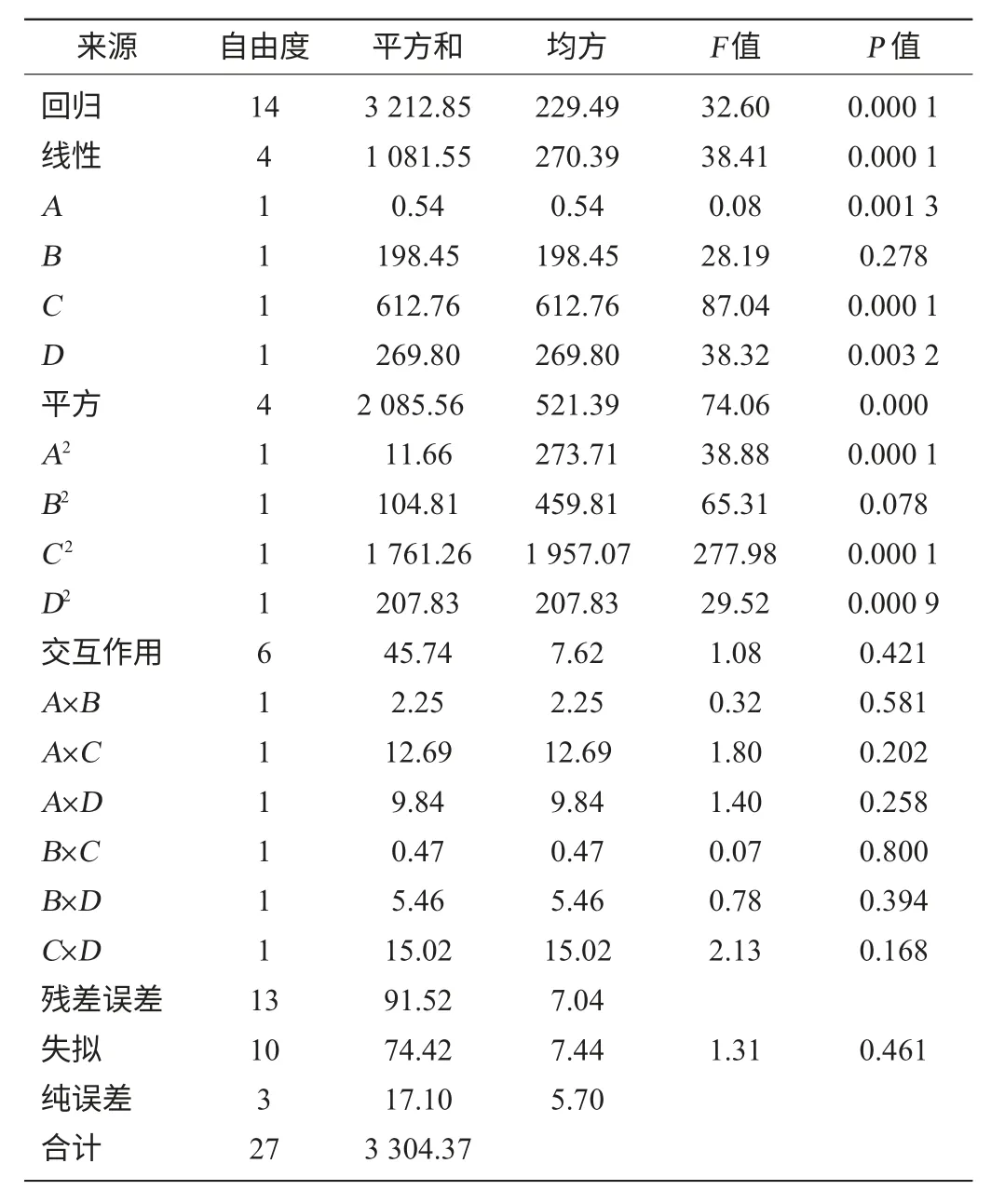
表3 显著性检验结果Table 3 Significant analysis results of the model
利用Design Expert软件,获得拟合后的鲍鱼内脏蛋白总氨基酸态氮含量对编码自变量酶解时间、酶解温度、料液比、酶用量的二次多项回归方程:

2.3.3 鲍鱼内脏蛋白质最佳提取工艺条件
根据二次回归数学模型进行优化,获得最优鲍鱼内脏蛋白提取工艺参数为酶添加量0.15%,提取时间为4 h,料液比为1∶4(g∶mL),酶解温度为54.88 ℃,pH值为7.08,此时的鲍鱼内脏酶解液总氨基酸态氮含量为165 mg/100 mL。为方便试验,优化工艺参数为酶添加量0.15%,提取时间为4 h,料液比为1∶4(g∶mL),酶解温度为55 ℃,pH值为7。此时测得鲍鱼内脏酶解液总氨基酸态氮含量为163 mg/100 mL,蛋白质含量为1.478 g/100 g,说明该模型可行。此条件下水解度为51.9%,氮回收率为38.1%。
3 结论
在单因素试验的基础上,应用响应面回归分析法对酶法提取鲍鱼内脏蛋白质的工艺条件进行了优化。考察了pH值、酶解温度、胰蛋白酶添加量和提取时间4个因素对提取工艺的影响,通过分析可以发现,温度是显著性的因素,并确定了酶法提取鲍鱼内脏蛋白质的最佳提取工艺条件为pH值为7,酶解温度为55 ℃,提取时间为4h,胰蛋白酶添加量0.15%,此条件下得到的酶解鲍鱼内脏酶解液总氨基酸态氮含量为163 mg/100 mL,蛋白质的水解度为51.9%,氮回收率为38.1%,这对鲍鱼内脏蛋白质资源的综合利用能提供一定的试验依据。

图6 各因素相互作用对总氨基酸态氮影响的响应面和等高线Fig.6 Response surface plots and contour line of effects of interaction between solid liquid ratio,enzyme addition,pH and temperature on total amino nitrogen content
[1]李太武,苏秀榕,丁明进,等.鲍的生物学[M].北京:科学出版社,2004.
[2]KRESGE N,VACQUIER V D,STOUT C D.Abalone lysine:the dissolving and evolving sperm protein[J].Bio Essays,2001,23(1):95-103.
[3]易美华,王锡彬.海南鲍营养成分及活性物质的分析研究[J].农牧产品开发,1997(12):34-38.
[4]苏勇昌,刘淑集,王 茵,等.鲍鱼内脏多糖的提取及其抗氧化活性研究[J].吉林农业,2010(10):170-171.
[5]朱莉莉,孙黎明,李冬梅,等.鲍鱼内脏蛋白多糖体内对H22 肝癌的抑制作用[J].营养学报,2009,31(5):478-481,485.
[6]王莅莎,朱蓓薇,孙黎明,等.鲍鱼内脏多糖的体外抗肿瘤和免疫调节活性研究[J].大连工业大学学报,2008,27(4):289-293.
[7]DIAS P F,SIQUEIRA J M,VENDRUSCOLO L F,et al.Antiangiogenic and antitumoral properties of a polysaccharide isolated from the seaweedSargassum stenophyllum[J].Cancer Chemoth Pharm,2005,56(4):436-446.
[8]彭汶铎,陈启亮,赵金华.鲍鱼酶解提取渡的生理活性[J].中国食品卫生杂志,2004,16(3):218-220.
[9]王志民,袁永俊,张艳萍,等.水解动物蛋白的酶法应用[J].四川工业学院学报,1999(2):92-94.
[10]李志军,张 明.水解蛋白的研究与应用[J].食品研究与开发,2003,24(4):42-44.
[11]陈锦权.一种分离纯化鲍鱼蛋白的方法:中国,CN102178027[P].2011.09.14.
[12]ADLER-NISSEN J.Enzymic hydrolysis of food proteins[M].London:Elsevier Applied Science Publishers Ltd.1986.
[13]何雪莲.罗非鱼加工下脚料发酵生产鱼露的研究[D].广州:华南热带农业大学硕士论文,2007.
[14]中华人民共和国卫生部.GB 5009.5—2010 食品中蛋白质的测定方法[S].北京:中国标准出版社,2010.
[15]杨 晋,陶宁萍,王锡昌.文蛤的营养成分分析及其用于海味香精的酶解液制备[J].食品工业科技,2007,28(4):146-149.
[16]冯小黎,金业涛,苏志国.分离纯化中蛋白质的不稳定性及其对策[J].生物工程进展,2000,20(3):67-70.
[17]肖 连,冬李彗,星减晋.啤酒糟中蛋白质的酶法提取及功能特性研究[J].中国酿造,2008,27(19):36-39.
