拐枣不同提取物的体外抗氧化作用
2015-04-12郑朋朋杨正涛戚丽蓉敖新宇
郑朋朋,李 珊,杨正涛,戚丽蓉,敖新宇*
(西南林业大学 生命科学学院,云南 昆明 650224)
拐枣(Hovenia dulcis)属鼠李科(Rhamnaceae)拐枣属(Hovenia)植物,又名鸡爪李、万寿果、枳椇等,可食部分是果柄(花序轴)而非果实。我国食用药用拐枣已有1 500多年,《本草纲目》中记述:枳木具性干、平、无毒。止渴除烦,去膈上热,利大小便,功用同蜂蜜。拐枣果实含丰富的葡萄糖、苹果酸钙、蛋白质、维生素、矿物质及黄酮类等活性物质,具有一定的营养保健功能[1-3]。有报道称拐枣能提高肝脏解毒酶活性,从而起到保护肝脏的功能;拐枣提取物对蓝氏贾第鞭毛虫起到抑制作用;以及拐枣多酚类物质具有抗氧化性[4-7]。
测定提取物抗氧化性能力的方法很多,其中1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid ammonium salt,ABTS)自由基清除试验是应用最广泛,测定结果稳定可靠,是国际承认的测定物质抗氧化性的方法[8-10]。提取物抗氧化能力与多酚含量之间存在密切联系,因此多酚含量也成为抗氧化能力的重要指标[11-13]。查阅相关文献,国内有关于拐枣提取物多酚含量与抗氧化性的研究极少,因此本研究对拐枣子、拐枣和拐枣枝乙醇浸提物抗氧化性进行比较,运用福林-酚法测定拐枣提取物浸膏不同极性提取物中多酚含量和清除DPPH、ABTS自由基法评价体外抗氧化性,确定抗氧化性最强的提取物,从而为拐枣资源的开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
拐枣子、拐枣、拐枣枝:产于云南省昆明市(经过烘干、粉碎、过筛等预处理备用)。
茶多酚标准品(纯度>98%):上海时代生物科技有限公司;福林-酚(Folin-Ciocalteu)、DPPH自由基、ABTS自由基:美国Sigma公司;过硫酸钾、甲醇、乙醇、乙酸乙酯、正丁醇、石油醚、碳酸钠、维生素C均为分析纯:国药集团化学试剂有限公司。
1.2 仪器与设备
DHG-9240A型电热恒温鼓风干燥箱、DZF-6030A型真空干燥箱:上海一恒科学仪器有限公司;BS224S电子天平:德国SARTORIUS公司;M20型粉碎机:德国KIKAWERKE公司;80目筛子:北京祥宇伟业仪器设备有限公司;B490真空旋转蒸发仪:瑞士BUCHI公司;TU-1901型紫外分光光度计:北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 拐枣不同部分乙醇浸提物的提取
分别称取100 g拐枣子、拐枣和拐枣枝置于500 mL烧杯中,加入500 mL体积分数为80%的乙醇溶液,浸提1 d,抽滤,滤渣再用体积分数为80%乙醇溶液重复浸提2次,合并3次浸提液,旋转蒸发浓缩到一定体积,放入真空干燥箱中,45 ℃干燥1 d,得到拐枣子、拐枣和拐枣枝体积分数为80%的乙醇浸提物,各提取物用蒸馏水配制成所需质量浓度的待测液进行抗氧性研究。
1.3.2 拐枣不同极性萃取物的萃取
称取1 kg拐枣,用5 L 体积分数为80%的乙醇溶液浸泡48 h,分离出浸提液,重复浸提3~4次,合并提取液减压浓缩得浸膏300 g。加入适量水混悬,依次用沸程60~90 ℃石油醚、乙酸乙酯、甲醇进行萃取,旋转蒸发浓缩萃取溶液,再置于真空干燥箱进行干燥,得石油醚萃取物、乙酸乙酯萃取物、正丁醇萃取物、甲醇萃取物和萃取剩余物,各萃取物用相应溶剂配制成所需质量浓度的待测液,测定其多酚含量和抗氧活性。
1.3.3 拐枣不同极性部位多酚含量的测定
茶多酚标准曲线绘制:准确称取茶多酚标准品40.0 mg,溶解后定容至100 mL,配制成400 μg/mL的茶多酚标准溶液;精确量取400 μg/mL的茶多酚标准溶液0、0.125 mL、0.250 mL、0.500 mL、0.750 mL、1.000 mL于25 mL容量瓶中,再分别加入1.0 mL 福林-酚试剂,摇匀后静置5 min,再分别加入10%碳酸钠2 mL,最后定容至刻度,摇匀,避光反应1 h后,在波长760 nm下测定吸光度值。多酚含量的测定:取1.0 mL不同提取物所配制的待测液,加入1.0 mL福林-酚试剂,摇匀后静置5 min,再加入10%碳酸钠2 mL,定容至刻度,摇匀,避光反应1 h后,在波长760 nm处测定吸光度值。以茶多酚标准曲线回归方程计算样品中多酚含量。
1.3.4 抗氧化性试验[14-17]
DPPH自由基清除率的测定:取1.0 mL不同质量浓度的样品溶液(阳性对照为不同质量浓度的维生素C(vitamin C,VC)溶液)于试管中,分别加入2.0 mL用无水乙醇配制6×10-5mol/LDPPH溶液,振摇混匀后置于暗室中反应30min,于波长518 nm处测定吸光度值,以1.0 mL不同质量浓度的样品溶液与2.0 mL无水乙醇混合液为本底溶液测定样品本底吸光度值,以2.0 mL DPPH溶液与1.0 mL无水乙醇混合液测定空白对照溶液吸光度值,DPPH自由基清除率的计算公式如下:
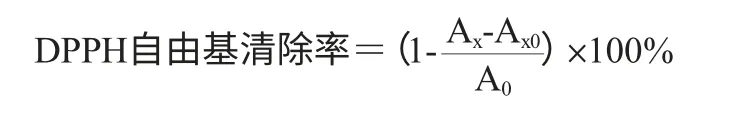
式中:Ax为不同样品溶液+DPPH溶液的吸光度值;Ax0为样品本底吸光度值;A0为空白对照溶液吸光度值。
ABTS自由基清除率的测定:用去离子水将ABTS溶解,配制ABTS浓度为7 mmol/L,加入过硫酸钾使过硫酸钾的浓度为2.45 mmol/L,然后将该溶液在室温下避光反应12~16 h。再将生成的ABTS+·溶液用pH 7.4磷酸缓冲液(phosphate buffer solution,PBS)稀释至适当浓度,使其在波长734 nm条件下的吸光度值为,得到ABTS自由基工作液。在试管中加入1.0 mL不同质量浓度样品溶液(以不同质量浓度的VC溶液作为阳性对照),再加入2.0 mL的ABTS自由基工作液,混合、摇匀,在室温下反应6 min后,在波长734 nm条件下测定其吸光度值。用蒸馏水代替样品溶液作为空白对照,ABTS自由基清除率的计算公式如下:

式中:Ax为不同样品溶液吸光度值;Ax0为样品本底吸光度值;A0为空白对照溶液吸光度值。
以DPPH和ABTS自由基清除率的半抑制浓度(half maximal inhibitory concentration,IC50)来反映检测物的抗氧化活性,即抗氧化性越强,该数值越低。
2 结果与分析
2.1 茶多酚标准曲线的绘制
以茶多酚标准溶液质量浓度(C)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线,结果见图1。

图1 茶多酚标准曲线Fig.1 Standard curve of tea polyphenols
由图1可知,由Origin 8.0对实验数据处理,得到标准曲线的线性回归方程:A=8.358 95×10-4C+0.039 89,其中线性相关系数R2=0.998,表明茶多酚溶液的质量浓度与吸光度值呈现良好的线性关系。
2.2 不同部分拐枣乙醇浸提物的抗氧化性
DPPH-乙醇溶液呈深紫色,抗氧化剂存在时与DPPH的孤对电子进行配对,溶液的紫色减弱,吸光度值减小,吸光度值减小的程度和抗氧化剂呈剂量关系,可借此来评价样品的抗氧化性[17]。拐枣不同部分在体积分数80%的乙醇浸提物质量浓度2 mg/mL时对DPPH和ABTS自由基清除率结果见表1。

表1 不同部分拐枣乙醇浸提物对DPPH和ABTS自由基的清除率Table 1 Scavenging effects of different parts of Hovenia dulcis on DPPH and ABTS radical
由表1可知,拐枣子、拐枣和拐枣枝在体积分数为80%的乙醇浸提物质量浓度为2 mg/mL时均具有较强清除DPPH、ABTS自由基的能力。表1中标准偏差(standard deviation,SD)结果的说明试验所测定的数据准确可靠。拐枣子、拐枣和拐枣枝对DPPH自由基清除效率分别为68.43%、87.07%和76.87%,对ABTS自由基的清除效率分别为82.03%、95.67%和89.57%。3个不同部位中,拐枣具有更强的抗氧化性,因此后续试验选用拐枣进行不同极性浸提,和对不同极性浸提物的抗氧化性进行研究。
2.3 拐枣不同极性萃取物抗氧化性研究
2.3.1 拐枣不同极性萃取物对DPPH自由基清除作用
拐枣不同极性萃取物对DPPH自由基清除作用,结果见图2。由图2可知,各物质对DPPH自由基清除率均随着拐枣提取物质量浓度的增加而增大,达到一定质量浓度后,对DPPH自由基清除率维持在最高水平不再增大。甲醇萃取物和萃取剩余物的清除率要低于其他萃取物的清除率,这可能与其中的多酚含量低有关;正丁醇萃取物在样品质量浓度<0.8 mg/mL的对DPPH自由基清除率要高于石油醚萃取物,但其最大清除率要略低于石油醚萃取物;乙酸乙酯萃取物在样品质量浓度<1.4 mg/mL的对DPPH自由基的清除率大于其他4种物质,>1.4 mg/mL之后其清除率与石油醚萃取物清除效率相当,达到最高,为94.0%,VC在0.1mg/mL时就达到了最大水平,当样品质量浓度>1.4mg/mL时,VC与乙酸乙酯、石油醚萃取物的DPPH自由基清除率没有显著性差异,从而说明,这两个萃取物有很强的清除DPPH自由基的能力。清除DPPH自由基大小顺序为石油醚萃取物>乙酸乙酯萃取物>VC>正丁醇萃取物>萃取剩余>甲醇萃取物。因此,采用石油醚和乙酸乙酯进行萃取具有较强的清除DPPH自由基的能力。

图2 拐枣不同极性萃取物对DPPH自由基的清除率Fig.2 Scavenging effects of Hovenia dulcis extract with different polarity on DPPH radical
2.3.2 拐枣不同极性萃取物对ABTS自由基清除作用
拐枣不同极性萃取物清除ABTS自由基试验结果见图3。由图3可知,各物质对ABTS自由基的清除效率差距较大,能清晰辨别各物质清除率的大小,清除率的大小是乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物>萃取剩余物>甲醇萃取物,其中乙酸乙酯萃取物的最大清除率为98.57%,VC的最大清除率为99.80%,与VC相当,两者没有显著差异。因此,采用乙酸乙酯进行萃取具有较强的清除ABTS自由基的能力。

图3 拐枣不同极性萃取物对ABTS自由基的清除率Fig.3 Scavenging effects of Hovenia dulcis extract with different polarity on ABTS radical
2.4 不同极性萃取物多酚含量、IC50与最大清除率
拐枣不同极性萃取物多酚含量,以及清除自由基的IC50和最大清除率见表2。由表2可知,拐枣不同极性部位多酚含量大小为乙酸乙酯萃取物>正丁醇萃取物>萃取剩余物>甲醇萃取物>石油醚萃取物。对DPPH和ABTS自由基清除的IC50大小为VC<乙酸乙酯萃取物<正丁醇萃取物<石油醚萃取物<萃取剩余物<甲醇萃取物。
对DPPH自由基的最大清除率大小为石油醚萃取物>乙酸乙酯萃取物>VC>正丁醇萃取物>萃取剩余>甲醇萃取物,其中石油醚、乙酸乙酯和正丁醇萃取物的DPPH自由基最大清除效率不存在明显差异。对ABTS自由基的最大清除率大小为VC>乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物>萃取剩余>甲醇萃取物,各物质的ABTS自由基最大清除率差异显著,此结果与对2种自由基清除IC50值大小结果相一致。综合IC50和最大清除率可知,乙酸乙酯和正丁醇萃取物具有更稳定的DPPH自由基及ABTS自由基清除率,说明拐枣不同极性萃取物中乙酸乙酯和正丁醇极性部位具有更强和更稳定的抗氧化活性。
结合不同极性萃取物多酚含量可知,多酚含量与抗氧化性存在正相关性,乙酸乙酯萃取物的多酚含量最大,为202.8 mg/g,正丁醇萃取物的次之,多酚含量为173.7 mg/g,其中石油醚萃取物多酚含量仅为36.1 mg/g,但石油醚萃取物的抗氧化性要强于萃取剩余物和甲醇(对DPPH自由基清除作用最强),说明石油醚萃取物中除含有多酚类物质,还存在其他具有抗氧化物质。
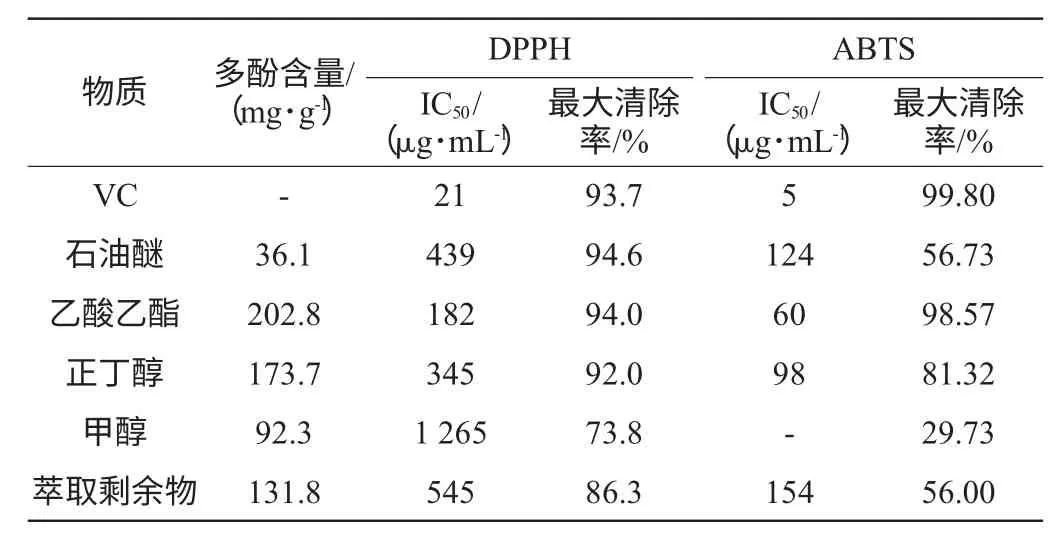
表2 拐枣不同极性萃取物中多酚含量及对DPPH和ABTS自由基清除作用的IC50和最大清除率Table 2 Polyphenol content,IC50and maximum scavenging efficiency of different polarity of Hovenia dulcis on DPPH and ABTS radical
3 结论
通过对拐枣子、拐枣和拐枣枝体积分数为80%的乙醇溶液浸提物抗氧化性进行比较,得出拐枣体积分数为80%的乙醇溶液浸提物的抗氧化性最强;依次用石油醚、乙酸乙酯、正丁醇、甲醇萃取拐枣体积分数为80%的乙醇浸提浸膏分别得4个不同的极性萃取物,对不同极性萃取物进行体外抗氧化性试验,拐枣不同极性萃取物中,乙酸乙酯萃取物的抗氧化能力最强,其多酚含量为202.8 mg/g,对DPPH和ABTS自由基清除作用的IC50分别为182 μg/mL和60 μg/mL,最大清除效率分别为94.0%和98.57%;与VC的抗氧化性无明显差异。试验表明,拐枣提取物有较好的抗氧化能力,其抗氧化活性除与多酚含量有关,还与其他物质有关,具有开发利用的价值。
[1]郑 刚,姜 俊.枳椐属植物及其药用的研究进展[J].实用医药杂志,2004,21(8):755-756.
[2]李维新,何志刚,林晓姿,等.拐枣的营养保健功能及其果汁饮料的研制[J].食品科学,2005,26(8):249-251.
[3]何 涛,杜瀛琨,蓝伦礼,等.枳椇子的研究概况[J].云南中医中药杂志,2009,30(5):64-66.
[4]WANG M C,ZHU P L,JIANG C X,et al.Preliminary characterization,antioxidant activityin vitroand hepatoprotective effect on acute alcohol-induced liver injury in mice of polysaccharides from the peduncles ofHovenia dulcis[J].Food Chem Toxicol,2012,50(9):2964-2970.
[5]KIM M H,CHUNG Y T,LEE J H,et al.Hepatic detoxification activity and reduction of serum alcohol concentration ofHovenia dulcisfrom Korea and China[J].Kor Soc Med Crop Sci,2000,8(3):225-233.
[6]GADELH A P,VIDAL F,CASTRO T M,et al.Susceptibility of Giardia lamblia toHovenia dulcisextracts[J].Parasitol Res,2005,97(5):399-407.
[7]LI G,MIN B S,ZHENG C J,et al.Neuroprotective and free radical scavenging activities of phenolic compounds fromHovenia dulcis[J].Arch Pharm Res,2005,28(7):804-809.
[8]MUTHUKUMARAN P,SALOMI S,UMAMAHESHWARI R.In vitroantioxidant activity ofPremna serratifoliaLinn[J].Asian J Res Pharm Sci,2013,3(1):15-18.
[9]ZHENG J,DING C X,WANG L S,et al.Anthocyanins composition and antioxidant activity of wildLycium ruthenicumMurr.from Qinghai-Tibet Plateau[J].Food Chem,2011,126(3):859-865.
[10]JADHAV A B,PAUL B N,KALASKAR M G.Antioxidant activity ofKydia calycinaRoxb.leaves extract[J].J Pharm Phytother,2013,1(1):2-3.
[11]FERNANDEZ-PACHON M S,VILLANO D,GARCIA-PARRILLA M C,et al.Antioxidant activity of wines and relation with their polyphenolic composition[J].Anal Chim Acta,2004,513:113-118.
[12]ISABELLE M,LEE B L,LIM M T,et al.Antioxidant activity and profiles of common fruits in Singapore[J].Food Chem,2010,123:77-84.
[13]GRANATO D,KATAYAMA F C U,DE CASTRO I A.Phenolic composition of South American red wines classified according to their antioxidant activity,retail price and sensory quality[J].Food Chem,2011,129:366-373.
[14]HASAN S M R,HOSSAIN M M,RAUSHANARA A,et al.DPPH free radical scavenging activity of some Bangladeshi medicinal plants[J].J Med Plan Res,2009,3(11):875-879.
[15]VILLANO D,FERNANDEZ-PACHON M S,MOYA M L,et al.Radical scavenging ability of polyphenolic compounds towards DPPH free radical[J].Talanta,2007,71:230-235.
[16]THAIPONG K,BOONPRAKOBA U,CROSBY K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].J Food Compos Anal,2006,19:669-675.
[17]刘 玮,叶 川,林 琳,等.微波和高温灭菌对神仙豆活性成分及其抗氧化性的影响[J].中国酿造,2015,34(6):53-57.
