82例急性早幼粒细胞白血病形态学及免疫表型特征分析
2015-04-11张文玲王晓菲张晨晰张立文
陈 立,陈 郁,张文玲,王晓菲,张晨晰,张立文
1承德县医院 检验科,河北承德 067400;2解放军总参谋部第61研究所 门诊部,北京 100141;3解放军总医院 临检科,北京 100853
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是急性髓细胞性白血病(acute myeloid leukemia,AML)中的一种特殊亚型,其发病凶险,早期死亡率高,以弥散性血管内凝血(disseminated intravascular coagulation,DIC)或纤溶亢进所致严重出血倾向为主要特点。近年来,随着以维甲酸、砷剂联合蒽环类抗生素为基础的化疗药物的广泛应用,APL患者的长期生存率提高到了90% ~ 95%[1]。因而快速准确诊断APL对及时选择合适的治疗方案至关重要。目前其快速诊断和预后判断主要依靠细胞形态学和细胞化学染色。流式细胞术(flow cytometry,FCM)对急性白血病诊断、分型及预后判断具有重要的临床意义[2-3],本研究对82例APL患者骨髓细胞应用流式细胞术检测,以形态学诊断分型为基础,进一步分析其免疫表型及细胞形态学特点,为临床明确诊断及鉴别提供重要的实验依据。
对象和方法
1 研究对象 选取2010年8月- 2014年3月于解放军总医院就诊的82例初诊APL患者。诊断标准参照天津标准和FAB标准,其中男性54例,女性28例,中位年龄37(23 ~ 64)岁;M3a(粗颗粒)者20例,M3b(细颗粒)者57例,M3v(变异型)者5例。82例均行骨髓穿刺(bone marrow aspiration,BMA)及流式细胞术检测。
2 主要仪器和试剂 流式细胞仪为美国Becton Dickinson公司的FACSCalibur。所用单克隆抗体 (CD33、CD13、CD9、CD64、CD117、CD2、CD11b、CD16、CD19、CD15、CD4、CD56、CD34、CD3、CD7、CD10、CD14、CD20、HLA-DR)及各色同型对照均购自美国Becton Dickinson公司。
3 流式细胞分析 所有标本均行流式细胞术检测免疫表型。无菌操作取3 ml EDTA-K3抗凝的骨髓样品,用流式细胞仪Cell Quest软件获取30 000个有核细胞,对数取样,CD45/SSC设门,检测骨髓有核细胞各种抗原的表达率。流式细胞术检测结果以荧光强度在<102为阴性,102~ 103为弱阳性,
103~ 104为强阳性,以抗原表达>20%为阳性。
4 骨髓涂片检查 无菌操作取患者0.2 ml骨髓液,涂片,室温晾干,运用瑞氏-吉姆萨(Wright-Giemsa’s)混合染液,染色15 min,水洗晾干后镜检,在涂片佳、染色良好、细胞分布均匀处,分类计数200个有核细胞,计算异常早幼粒细胞的百分比。
5 统计学处理 实验数据采用SPSS17.0统计软件处理,正态分布资料以±s表示,两组间的显著性差异比较采用独立样本的t检验或Mann-Whitney检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
结 果
1 骨髓细胞形态及流式细胞分群 每例标本经骨髓细胞形态学检查,其中异常早幼粒细胞比例为50.5% ~ 94.5%,此类细胞大小不一,呈类圆或不规则形;细胞质丰富,色蓝,细胞质内可见粗细不一、紫红色颗粒及Auer小体,边缘伪足样突起明显;胞核多呈不规则形,核有扭曲、凹陷、折叠及分叶;核染色质细致,核仁l ~ 3个(图1)。进行CD45/SSC设门后将骨髓细胞分为淋巴细胞、单核细胞、粒细胞及幼稚细胞群,在APL患者中均可见一群异常细胞,这群细胞占核细胞总数的45.6% ~ 88.2%。该细胞的特点:细胞群均一、明显,CD45弱阳性,SSC值较大(图2)。在细胞分布及抗原表达中CD33和CD13呈强阳性表达,且CD33荧光强度均匀一致(图3)。
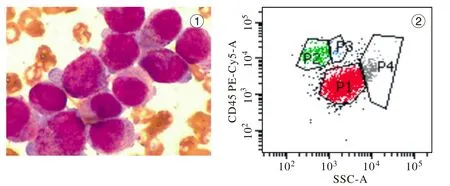
图1 APL患者骨髓细胞形态图 2 APL患者骨髓细胞CD45/SSC散点图P1:幼稚细胞群; P2:淋巴细胞; P3:单核细胞; P4:粒细胞Fig. 1 Bone marrow cell morphology of APL patientsFig. 2 Scatter diagram of CD45/SSC of APL patients P1: blasts; P2: lymphocytes; P3: monocytes; P4: granulocyte

图3 82例APL患者CD13抗原和CD33抗原表达散点图Fig. 3 Scatter diagram of CD13 and CD33 antigen expression of 82 APL cases
2 APL患者的免疫表型分析 82例APL细胞全部表达抗原CD33和CD13,其平均阳性细胞比例分别为90.2%、85.3%;CD64和CD9抗原阳性表达率也较高,分别为91.5%、85.4%。表达早期髓系抗原CD117阳性率为65.9%,表达T淋巴细胞相关抗原CD2阳性率为11.0%,17.1%的患者异常表达CD56,表达髓系成熟标志CD15抗原阳性率仅为9.8%。CD19、CD34、CD7和HLA-DR抗原阳性表达率较低,基本不表达CD16、CD4、CD3、CD10、CD14和CD20。见表1。

表1 82例APL患者免疫表型Tab. 1 Immunophenotypic characteristics of 82 APL cases
3 APL患者阳性抗原表达强度分析 根据阳性细胞比例的不同范围,即20% ~ 40%、40% ~ 60%、60% ~ 80%和80% ~ 100%进一步分析阳性抗原表达分布,CD13、CD9、CD64、CD117、CD56在4个不同的表达强度范围内均有分布。其中CD33和CD13主要分布在80% ~ 100%的强表达范围内,CD9和CD64大多分布在60% ~ 80%和80% ~ 100%的表达范围内,淋系标记CD56和CD2主要分布在20% ~ 40%和40% ~ 60%的弱表达范围内,CD117大多分布在20% ~ 40%和60% ~ 80%的表达范围内。而CD15、CD11b、CD19、CD7、CD34和HLA-DR大多分布在20% ~ 40%的弱表达范围内,其平均阳性细胞比例均较低。见表2。
4 APL患者抗原比较 按白血病细胞表达CD34和HLA-DR的强度,分成CD34+和(或)HLA-DR+(包 括CD34+HLA-DR+、CD34+HLA-DR-、CD34-HLA-DR+)共27例(32.9%)以 及CD34-和HLADR-共55例(67.1%)两组进行比较,其中抗原CD2和CD56在两组间的表达有统计学差异(P<0.05),其他抗原组间比较无统计学差异(P>0.05)。见表3。
5 M3a、M3b及M3v型中各抗原阳性表达率比较M3a型CD117抗原阳性表达率明显高于M3v型(P<0.05),M3v型CD34抗原阳性表达率明显高于M3a和M3b型(P<0.01),而其他抗原组间比较无统计学差异(P>0.05)。见表4。

表2 82例APL患者的阳性抗原表达强度Tab. 2 Positive antigen expression intensity of 82 APL cases
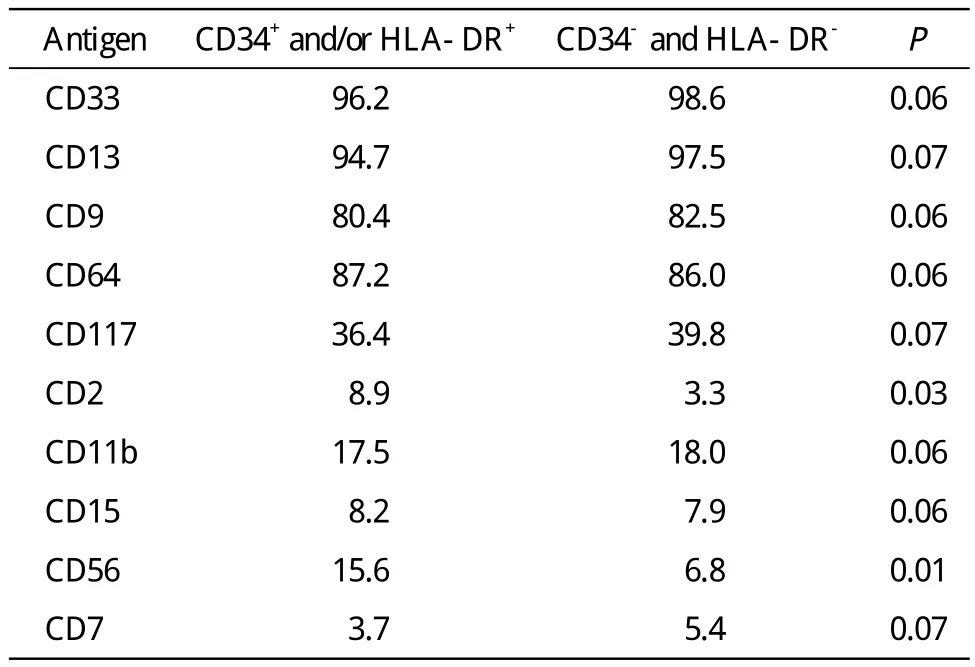
表3 APL患者的CD34+和(或) HLA-DR+组与CD34-和HLA-DR-组比较Tab. 3 Comparison of CD34+ and/or HLA-DR+ group and CD34- and HLA-DR- group (%)
讨 论
CD13、CD33是髓系特异性免疫标志,在不同类型白血病中表达率不同。Kaleem等[4]报道大部分APL细胞具有特殊的免疫特征,高表达CD13、CD33和CD9,而CD34、HLA-DR大多为阴性。本研究结果显示,APL患者白血病细胞群均一、明显,因其颗粒较多表现为SSC值较大,与成熟粒细胞相似;82例APL患者表现为CD33+CD13+阳性共表达,共表达率100.0%,CD33抗原的平均阳性细胞比例可达90.2%,CD13次之(85.3%)。抗原CD64和CD9阳性表达率及平均阳性细胞比例分别为91.5%(67.4%)、85.4%(68.2%),表达率与文献报道相似[5]。而抗原CD34、HLA-DR阳性表达率较低。这说明通过CD45/SSC散点图特征及细胞高表达抗原CD13、CD33和CD9,但CD34和HLA-DR阳性表达率较低时应该考虑APL的可能性。正常情况下髓系成熟标志CD15抗原在早幼粒细胞阶段即开始高表达[6],然而与正常早幼粒细胞不同,APL患者的异常早幼粒细胞很少表达这个抗原(表达率仅为9.8%),且表达强度也较弱。
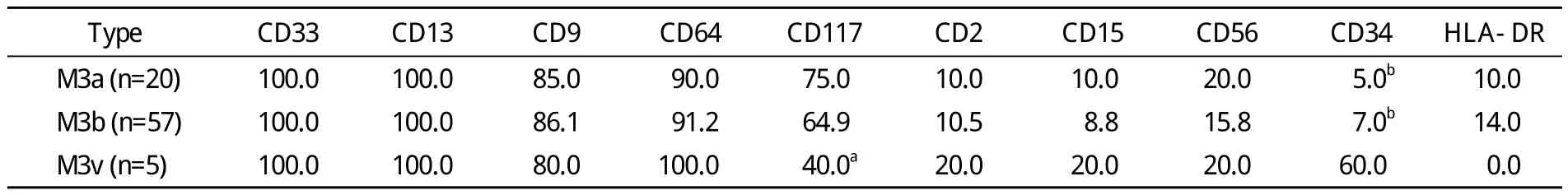
表4 M3a、M3b及M3v型中各抗原阳性表达率比较Tab. 4 Comparison of antigen positive rate of M3a, M3b and M3v (%)
各抗原表达阳性细胞比例不尽相同,CD33抗原不但阳性率和阳性细胞比例高,且分布较一致;而CD13、CD9、CD64、CD117、CD56等抗原的阳性细胞比例分布不一致,为20% ~ 100%,这决定了初诊时具有上述抗原表达的APL细胞比例高低不等。因此尽可能选用初诊幼稚细胞中表达率高的抗体,使其适用范围更广。CD117是一种分子量为145 kU的跨膜蛋白受体,其配体为干细胞因子(stem cell factor,SCF)。SCF是重要的造血生长因子,与其他细胞因子协同作用可刺激造血干/祖细胞的增殖和分化。有文献报道CD117在正常骨髓细胞的阳性率较低,主要在干细胞、髓系定向祖细胞上表达[7]。国内外关于APL患者中CD117阳性表达率报道多为23.0% ~ 80.0%。本研究结果显示,CD117阳性表达率及平均阳性细胞比例分别为65.9%与56.4%。尽管CD117的阳性细胞比例有差异,但目前还没有更好的标志可以替代CD117进行早期细胞设门。另外,对初治CD117表达不高的患者,利用CD117进行设门分析时,可能会低估白血病细胞的比例,因此在解释结果时要加以说明。
CD34是干细胞祖细胞的标志,表达于最早的干细胞祖细胞上,随细胞成熟其抗原表达逐渐减弱直至消失,HLA-DR表达于白血病细胞的较早分化阶段,我们按照患者异常早幼粒细胞在这2种抗原的表达强度,将所有患者分为表达较为幼稚的CD34+和(或) HLA-DR+组和表达较为成熟CD34-和HLA-DR-组。结果显示,CD34+和(或) HLA-DR+组表达CD2、CD56抗原强度明显高 于CD34-和HLA-DR-组。Montesinos等[8]发现,APL患者异常表达CD56完全缓解的持续时间更短,5年复发率更高,总体生存期更短。国外文献报道CD56阳性与APL复发及预后存在一定的相关性[9]。但目前临床对于CD56阳性出现APL复发的相关机制尚不清楚,主要有以下两种解释:1) CD56阳性的细胞,大多都比较幼稚,带有多能干造血干细胞性质,对以维甲酸+蒽环类为基础的药物缺乏敏感性[10]。2)CD56阳性患者治疗过程中,往往高表达P-糖蛋白,从而更容易出现化疗药物耐药。CD2是T淋巴细胞上分布的一种绵羊红细胞受体,与T淋巴细胞的活化和增殖有关。有文献报道,白血病细胞表达CD34和CD2的APL患者对ATRA的治疗效果较差,早期死亡率更高,更容易复发,总体生存期和无病生存期相对较短[11]。故CD2和CD34也可作为APL预后不良指标之一。急性白血病系列混杂模型认为[12-14],表达CD34、HLA-DR同时跨系CD2或CD56的APL患者,其白血病肿瘤干细胞可能起源于系列未确定前更为原始的造血细胞。而不表达CD2和CD56的APL细胞则可能起源于髓系已确定后较为成熟的髓系祖细胞[15-16]。因此,表达CD34、HLA-DR抗原的APL细胞更多出现跨系表达CD2和CD56。
APL形态学诊断可分为M3a型(粗颗粒)、M3b型(细颗粒)和M3v型(变异型),M3v型是指异常早幼粒细胞胞核呈双叶、多叶或肾形,胞质内无或少颗粒,Auer小体少见。在82例APL患者中M3b型比例最高为69.5%。我们进行免疫表型分析结果显示,M3a型CD117抗原阳性表达率明显高于M3v型,M3v型CD34抗原阳性表达率明显高于M3a和M3b型。这提示M3v型患者CD34表达率高,此型APL细胞可能来源于更原始的祖细胞。据文献报道[17-18],M3v型患者中表达CD2阳性率高,而M3a、M3b型大多不表达CD2,推断CD2和M3v有一定关系。本研究中82例APL患者诊断M3v型仅5例,表达CD2抗原有1例,但由于M3v型例数过少,无法证实CD2与M3v型的关系,尚需扩大样本量进一步研究。对于常见的M3a型较易鉴别,但M3b、M3v型细胞颗粒细小,似灰尘样,核扭曲折叠,易误诊为单核细胞,因此以骨髓细胞形态学为基础结合免疫表型分析,有助于鉴别诊断及了解细胞的不同分化阶段和类型。
1 Wang ZY, Chen Z. Acute promyelocytic leukemia: from highly fatal to highly curable[J]. Blood, 2008, 111(5): 2505-2515.
2 徐晓兰,范志平,宋兰林,等.伴t(11;17)(q23;q21)易位的急性早幼粒细胞白血病1例并文献复习[J].南方医科大学学报,2007,27(6):923-924.
3 常晓丽,董征,刘莎,等.伴t(11;17)(q23;q21)易位的急性早幼粒细胞白血病1例并文献复习[J].解放军医学杂志,2013,38(5):378-382.
4 Kaleem Z, Crawford E, Pathan MH, et al. Flow cytometric analysis of acute leukemias. Diagnostic utility and critical analysis of data[J]. Arch Pathol Lab Med, 2003, 127(1): 42-48.
5 Paietta E. Expression of cell-surface antigens in acute promyelocytic leukaemia[J]. Best Pract Res Clin Haematol, 2003, 16(3):369-385.
6 王建中.临床流式细胞分析[M].上海:上海科学技术出版社,2005:287-288.
7 Rizzatti EG, Garcia AB, Portieres FL, et al. Expression of CD117 and CD11b in bone marrow can differentiate acute promyelocytic leukemia from recovering benign myeloid proliferation[J]. Am J Clin Pathol, 2002, 118(1): 31-37.
8 Montesinos P, Rayón C, Vellenga E, et al. Clinical significance of CD56 expression in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline-based regimens[J]. Blood, 2011, 117(6): 1799-1805.
9 Breccia M, De Propris MS, Minotti C, et al. Aberrant phenotypic expression of CD15 and CD56 identifies poor prognostic acute promyelocytic leukemia patients[J]. Leuk Res, 2014, 38(2):194-197.
10 Percherancier Y, Germain-Desprez D, Galisson F, et al. Role of SUMO in RNF4-mediated promyelocytic leukemia protein (PML)degradation: sumoylation of PML and phospho-switch control of its SUMO binding domain dissected in living cells[J]. J Biol Chem,2009, 284(24):16595-16608.
11 Ahmad EI, Akl HKh, Hashem ME, et al. The biological characteristics of adult CD34+ acute promyelocytic leukemia[J]. Med Oncol, 2012, 29(2): 1119-1126.
12 Miyamoto T, Iwasaki H, Reizis B, et al. Myeloid or lymphoid promiscuity as a critical step in hematopoietic lineage commitment[J]. Dev Cell, 2002, 3(1): 137-147.
13 曾静霞.急性早幼粒细胞白血病不同治疗方案的疗效分析[D].太原:山西医科大学,2011:1-35.
14 王克强, 亓云法, 王静, 等. 急性早幼粒细胞白血病细胞形态学分型临床意义分析[J]. 中华肿瘤防治杂志, 2014, 21(7):538-542.
15 Grimwade D, Enver T. Acute promyelocytic leukemia: where does it stem from?[J]. Leukemia, 2004, 18(3): 375-384.
16 Zhang L, Cao Z, Zou Y, et al. Quantification of PML/RARa transcript after induction predicts outcome in children with acute promyelocytic leukemia[J]. Int J Hematol, 2012, 95(5): 500-508.
17 Albano F, Mestice A, Pannunzio A, et al. The biological characteristics of CD34+ CD2+ adult acute promyelocytic leukemia and the CD34 CD2 hypergranular (M3) and microgranular (M3v)phenotypes[J]. Haematologica, 2006, 91(3): 311-316.
18 Varma N, Agarwal C, Varma S. Evaluation of PML immunofluorescence, flow cytometric immunophenotypic analysis,and reverse transcriptase polymerase chain reaction for PML/RARa for rapid diagnosis of acute promyelocytic leukemia[J]. Cancer,2011, 117(2):435.
