秦皇岛海域“褐潮”海水对卤虫、轮虫存活和摄食的影响研究
2015-04-11孔凡洲王云峰周名江
公 晗 , 孔凡洲 王云峰 颜 天 周名江
(1.中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛266071; 2.中国科学院大学, 北京100049)
褐潮通常是指由于海金藻纲(Pelagophyceae)微藻抑食金球藻(Aureococcus anophagefferens)或Aureoumbra lagunensis暴发性增殖而形成的藻华现象[1], 藻华发生期间, 水体呈现黄褐色。抑食金球藻呈金黄色, 球形, 直径约为 2 μm[2]。A.lagunensis与抑食金球藻的形态相似, 直径为4~5 μm[3]。
自1985年起, 美国东海岸抑食金球藻频频暴发,暴发密度高于1.0 ×106个/mL[4], 给贝类养殖业造成了巨大损失; 1990年~1996年, 德克萨斯州A.lagunensis暴发时, 细胞密度最高达到1.0×107个/mL[5], 给海洋生态系统造成了巨大危害。自2009年起, 中国渤海秦皇岛沿岸海域连续 5年暴发了褐潮, 导致当地养殖贝类大量滞长甚至死亡; 2010年, 河北省直接经济损失达2亿元[6]。褐潮的一个优势种为抑食金球藻, 其细胞密度最高达1.0×106个/mL[7]。
褐潮藻的不同株系毒性有差异[8], 中国褐潮毒性的研究还未见被报道, 相关研究亟待开展。浮游动物是微藻的初级消费者, 与藻华的发生及生态效应有密切关系。国外已有研究表明, 褐潮会影响中、小型浮游动物的生长、发育、摄食及繁殖等[9]。作者选取了海洋生态毒理学研究中常用的模式生物——卤虫(Artemia salina)、褶皱臂尾轮虫(Brachionus plicatilis, 以下称轮虫)为对象, 研究了秦皇岛褐潮现场海水对其存活、摄食的影响; 同时以3株室内培养的褐潮藻(抑食金球藻CCMP 1984、CCMP 1850,A.lagunensisCCMP 1507)为参照, 首次初步评价了秦皇岛褐潮的毒性, 为今后有关中国褐潮毒理的研究提供基础。
1 材料与方法
褐潮海水于2013年7月2日(褐潮暴发高峰期)采自秦皇岛, 采集站位坐标为119°25’54’E, 39°46’37’N。从采集至用于实验, 时间约为1 h。
3株褐潮藻购于美国海藻及微生物中心(NCMA,原 CCMP), 球等鞭金藻(Isochrysis galbana, 以下简写为ISO)、小球藻(Chlorellasp., 以下简写为CHL)由中国科学院海洋研究所藻种中心提供。藻培养温度为18℃, 光暗比为14 h: 10 h。用于藻类培养的海水引自青岛胶州湾外太平角无污染海水, 使用前经沉淀沙滤、0.45 μm混合纤维滤膜过滤, 高温煮沸消毒。选择生长良好的指数期藻液在显微镜下用血球计数板计数后用于实验。
实验用卤虫为卤虫卵经23 ℃海水孵化得到的无节幼体 (instar II-Ⅲ)。轮虫由中国科学院海洋研究所培养中心提供, 为实验室常年培养种。
1.1 褐潮海水中浮游植物色素及类群分析
褐潮海水经 20 μm筛绢过滤后, 在血球计数板下进行镜检。过滤50 mL于GF/F玻璃纤维滤膜(平均孔径0.68 μm), 取6个平行样用于色素分析。色素分析用内标(Internal Standard, IS)为 8′-阿朴-β, ψ-胡萝卜醛(Apocarotenal, Apo)。所用材料与试剂、样品的预处理、高效液相色谱(HPLC)分析及浮游植物类群的 CHEMTAX分析方法参照孔凡洲等[10]。根据Kong等[11]中给出的But含量与褐潮藻的细胞密度关系, 计算得到现场海水中褐潮藻的细胞密度。
1.2 浮游动物存活实验
1.2.1 卤虫存活实验
实验选用24孔培养板, 每孔加入1 mL测试藻液。在解剖镜下用滴管将卤虫转移到培养板各孔中,每孔分别放10只卤虫。
秦皇岛褐潮海水及 3株美国褐潮藻分别用于实验中, 现场海水中褐潮藻、CCMP1984、CCMP 1850、CCMP 1507密度分别为8.0 × 105(HPLC计算结果)、1.5 × 107、1.5 × 107、1.0× 106个/mL。以球等鞭金藻(1.0 × 105个/mL)为对照组, 另设灭菌海水为饥饿组,每组3个平行。实验共进行48 h, 24 h 时更换新鲜实验液, 分别于24、48 h记录卤虫存活数。
CCMP 1507(1.0 × 106个/mL)经 0.45 μm 混合纤维滤膜过滤浓缩后(过滤负压不超过 5 kPa), 将藻细胞重新悬浮于与原藻液等体积的新鲜海水中; 取部分藻细胞重悬液, 用超声波细胞粉碎机破碎; 藻细胞重悬液、藻细胞破碎液和去藻过滤液分别用于实验中。实验共进行60 h, 24 h 时更换新鲜实验液, 分别于12、24、36、48、60 h 记录卤虫存活数。
1.2.2 轮虫存活实验
实验容器、实验体积、实验对象数目及实验用藻密度设置同 1.2.1。实验前, 挑选挂卵轮虫置于灭菌海水中培养24 h, 吸取刚出生4 h以内的幼体用于实验。实验以小球藻(1.0 × 106个/mL)为对照组, 实验进行24 h, 实验结束后记录轮虫存活数。
1.3 浮游动物摄食实验
1.3.1 卤虫摄食实验
实验在黑暗条件下进行, 实验温度为 20 ℃, 实验时间为8 h, 实验容器为500 mL烧杯, 实验体积为300 mL, 每个烧杯分别加入卤虫 600~700只。实验结束时, 以筛绢滤出卤虫, 用灭菌海水反复冲洗后,取100只滤于GF/F 玻璃纤维滤膜上。将滤膜放入棕色瓶中, 加入5 mL 90%的丙酮溶液, 冰浴超声破碎,放入 4 ℃冰箱中避光萃取 24 h, 采用特纳(Turner Designs) 荧光计测出荧光值求出卤虫体内色素含量。按照王荣[12]所做改进, 以叶绿素 a 与脱镁叶绿酸 a 的绝对含量(ng/个)来定量卤虫体内色素。将摄食量定义为:

式中,F为实验时间内每只卤虫的摄食量;c(Chla)和c(Pha.A) 分别为实验时间内每只卤虫体内叶绿素 a和脱镁叶绿酸a 含量。
实验分为两个部分: (1)单独投喂褐潮海水或美国褐潮藻; (2)投喂褐潮海水或美国褐潮藻与球等鞭金藻混合饵料。现场海水中褐潮藻、CCMP 1984、CCMP 1850、CCMP 1507 密度分别为 8.0 × 105、5.0 ×105、5.0 × 105、5.0 × 104个/mL。所有实验都设置等生物量的球等鞭金藻(5.0 × 104个/mL)为对照组、灭菌海水为饥饿组, 每组3个平行。
1.3.2 轮虫摄食实验
实验材料与方法类似于 1.3.1, 不同之处为: 实验前, 将轮虫置于灭菌海水中饥饿处理 24 h; 每个烧杯分别加入轮虫1 000~1 200只; 实验采用小球藻(3.0 × 105个/mL)为对照组。
1.4 数据分析与统计
使用SPSS 16.0 进行单因素方差分析(One-Way ANOVA), 采用 LSD和 Duncans比较各处理组的显著性差异。
2 结果与分析
2.1 褐潮现场海水分析结果
2.1.1 镜检结果
过滤后的样品在显微镜下观察, 样品中主要为2~4 μm金黄色球形藻, 在血球计数板下计数得到细胞密度约为1.0× 106个/mL。
2.1.2 色素组成
如图1所示, 在微型和微微型浮游植物样品中,主要色素组分是 19’-丁酰氧基岩藻黄素(19’-butanoyloxyfucoxanthin, But)、岩藻黄素(Fucoxanthin,Fuco)、硅甲藻黄素(Diadinoxanthin, Diad)和叶绿素a(Chlorophylla, Chla), 此外还有微量的多甲藻素(Peridinin, Peri)、19’-己酰氧基岩藻黄素(19’-hexanoyloxyFucoxanthin, Hex)、别黄素(Alloxanthin, Allo)、玉米黄素(Zeaxanthin, Zea)、叶黄素(Lutein, Lut)。结合镜检结果, 表明现场海水中有海金藻、硅藻、定鞭藻、隐藻、绿藻、蓝藻、甲藻, 且主要为海金藻。

图1 微型及微微型浮游植物样品的色素分析色谱(检测波长440 nm)Fig.1 HPLC chromatograms of nano-sized and pico-sized phytoplankton samples (Detection wave length at 440 nm)
2.1.3 不同浮游植物类群对Chla含量的贡献
应用 CHEMTAX软件, 构建海金藻、硅藻、定鞭藻、隐藻、绿藻、蓝藻、甲藻 7类微藻的色素比率初始矩阵如表1初始色素, 对该矩阵进行优化后得到最终矩阵如表1最终色素所示。应用这一矩阵,计算了不同浮游植物类群的 Chla含量, 得到各类群Chla含量占总Chla含量比例, 做图2。可以看出, 浮游植物样品中主要为海金藻, 比例高达72.6%。

图2 基于CHEMTAX分析的各微藻类群比例Fig.2 Ratios of different phytoplankton groups based on the results of CHEMTAX

表1 CHEMTAX分析中不同微藻类群的初始和最终色素比率矩阵Tab.1 Input and output ratios of marker pigments to Chla for the selected phytoplankton groups
2.2 褐潮对浮游动物存活的影响
2.2.1 褐潮对卤虫存活的影响
卤虫无节幼体在各处理组中24、48 h的存活率如图3所示。在褐潮海水中, 卤虫48 h存活率下降至 77%, 与对照组有显著差异, 与饥饿组无显著差异。在CCMP 1507中, 卤虫24 h存活率仅为60%, 48 h存活率仅为 30%, 与对照组有显著差异。在 CCMP 1984、CCMP 1850实验组中, 卤虫48 h存活率与对照组无显著差异, 存活率在90%以上。

图3 投喂单一饵料时卤虫的存活率Fig.3 Survival of Artemia salina exposed to a unialgal diet
依据上述实验结果, 探究CCMP 1507不同组分对卤虫存活的影响。实验表明(图4), 卤虫在藻细胞重悬液、藻细胞破碎液中的存活率急剧下降, 60 h 内全部死亡, 存活率显著低于对照组及饥饿组; 卤虫在藻滤液中的存活率下降趋势与饥饿组无显著差异。即藻细胞重悬液、藻细胞破碎液显著降低卤虫存活率, 藻滤液对卤虫的存活无显著影响。表明该藻的毒性主要来自藻细胞。
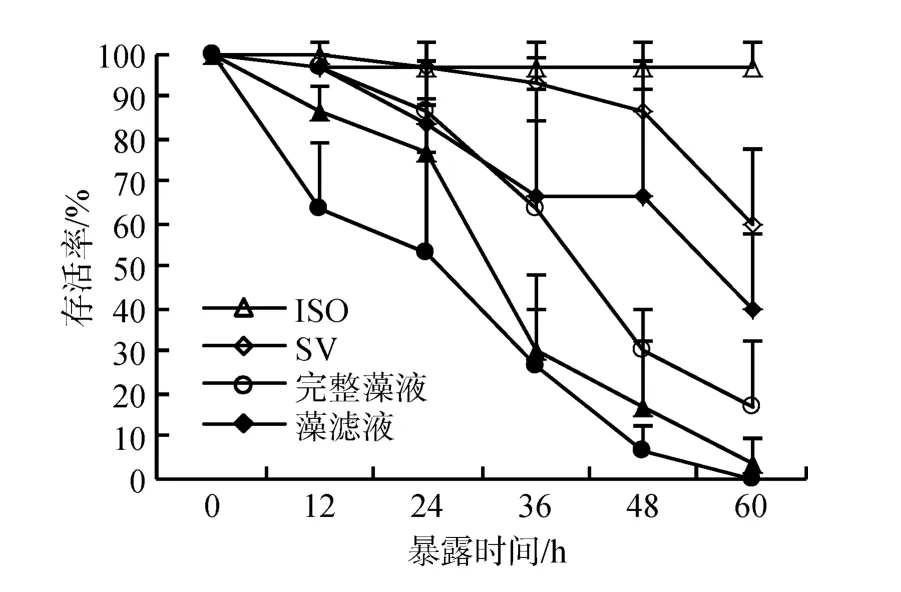
图4 卤虫在CCMP 1507不同组分中的存活率Fig.4 Survival of Artemia salina exposed to different components of CCMP 1507
2.2.2 褐潮对轮虫存活的影响
各实验组轮虫24 h存活率均为100%(图5), 褐潮海水及美国3株褐潮藻对轮虫都没有急性致死效应。

图5 投喂单一饵料时轮虫的存活率Fig.5 Survival of Brachionus plicatilis exposed to a unialgal diet
2.3 褐潮对浮游动物摄食的影响
2.3.1 褐潮对卤虫摄食的影响
图6表示分别单独投喂褐潮海水、CCMP 1984、CCMP 1850、CCMP 1507时, 卤虫8 h的摄食量。可见卤虫在褐潮海水中的摄食量与饥饿组无显著差异,表明卤虫不摄食褐潮海水中微藻。卤虫在 3株美国褐潮藻中的摄食量显著低于对照组。

图6 投喂单一饵料时卤虫的摄食量Fig.6 Ingestion of Artemia salina on a unialgal diet
图7表示分别投喂褐潮海水、CCMP 1984、CCMP 1850、CCMP 1507与金藻混合饵料时, 卤虫8 h的摄食量。结果表明, 在褐潮海水与金藻混合饵料中, 卤虫可以摄食, 但摄食量显著低于对照组, 8 h内摄食量由(5.5±0.4)ng/个降至(2.4±0.4)ng/个。表明褐潮海水对卤虫的摄食有抑制作用。CCMP 1507具有相同的效应。在CCMP 1984与金藻的混合饵料中, 卤虫的摄食量高于对照组; 在CCMP 1850与金藻的混合饵料中, 卤虫的摄食量与对照组无显著差异, 表明这两株藻对卤虫的摄食没有抑制作用。

图7 投喂混合饵料时卤虫的摄食量Fig.7 Ingestion of Artemia salina on a mix diet
2.3.2 褐潮对轮虫摄食的影响
图8表示分别单独投喂褐潮海水、CCMP 1984、CCMP 1850、CCMP 1507时, 轮虫8 h的摄食量。可见轮虫在褐潮海水中摄食量显著低于对照组, 与饥饿组无显著差异, 表明轮虫不摄食现场海水中微藻。轮虫对CCMP 1507的摄食量显著低于对照组。轮虫对CCMP 1984、CCMP 1850的摄食量与对照组无显著差异。

图8 投喂单一饵料时轮虫的摄食量Fig.8 Ingestion of Brachionus plicatilis on a unialgal diet
图9表示分别投喂褐潮海水、CCMP 1507与小球藻混合饵料时, 轮虫8 h的摄食量。结果表明, 轮虫在混合饵料中, 8 h内摄食量由(1.5±0.2)ng/个分别下降至(0.9±0.1)ng/个、(0.5±0.3)ng/个。表明褐潮海水及CCMP 1507对卤虫的摄食有抑制作用。
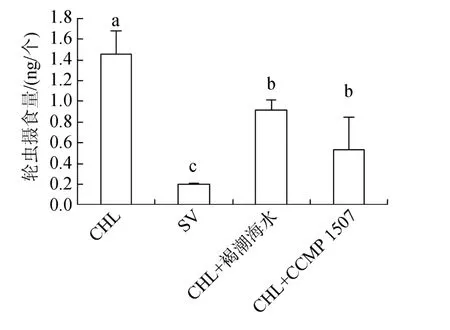
图9 投喂混合饵料时轮虫的摄食量Fig.9 Ingestion of Brachionus plicatilis on a mix diet
3 讨论
3.1 秦皇岛褐潮对浮游动物的潜在危害
本研究首次初步评价了秦皇岛褐潮对两种浮游动物——卤虫及轮虫存活、摄食的毒性。结果表明, 秦皇岛褐潮会影响卤虫的存活, 抑制卤虫、轮虫的摄食。
暴露于褐潮海水中, 卤虫24 h存活率未受到影响, 而 48 h存活率与饥饿组无显著差异, 表明卤虫48 h存活率的下降可能是饥饿导致的, 这一点也得到了卤虫摄食实验的证实。结合现场实验与室内实验结果分析表明, 与以往赤潮藻毒性特点不同, 褐潮藻的急性致死效应不明显, 其危害主要表现为对海洋生物摄食的影响。
秦皇岛褐潮藻不仅影响两种浮游动物摄食, 而且抑制浮游动物对其他饵料藻的摄食。长期暴露于褐潮发生海域, 浮游动物的生长很可能受到抑制,进而导致浮游动物生物量的降低, 从而更有利于微藻的生长使得藻华得以长时间持续。由于浮游动物对藻细胞大小具有摄食选择性, 所以褐潮对与卤虫、轮虫大小相近的其他浮游动物或者贝类的阶段性浮游幼虫也可能会产生一定的危害效应, 进而对整个浮游动物群落结构产生影响, 最终通过食物链影响整个海洋生态系统。因此秦皇岛褐潮对海洋生态系统的影响值得密切关注。
就浮游动物的毒性而言, 秦皇岛褐潮的毒性效应与CCMP 1507毒性效应相似, CCMP 1984、CCMP 1850的毒性相对较弱。实验所用CCMP 1507密度远低于现场密度, 对卤虫的存活、摄食产生了显著抑制效应。实验所用CCMP 1984、CCMP 1850密度远高于现场密度, 对卤虫没有产生致死效应, 并且在本研究中没有发现这两株藻对卤虫、轮虫摄食的抑制效应。
在本研究中, 卤虫、轮虫对 CCMP 1984、CCMP 1850的摄食表现出了不同的效应: 前者对两株藻的摄食量较低, 而后者可以正常摄食。Smith等[13]曾报道汤氏纺锤水蚤(Acatia tonsa)无节幼虫不摄食 CCMP 1850。这些不同效应可能与浮游动物的摄食选择性有关。此外, Bricelj[9]曾报道CCMP 1784 (CCMP 1984的无菌株)降低猛水蚤(Coullana canadensis)无节幼虫及纺锤水蚤桡足幼虫的存活率, 但是本研究中作者并未观察到CCMP 1984对卤虫、轮虫的致死效应, 表明不同的浮游动物对褐潮藻的敏感性可能不同。
3.2 褐潮藻的毒性来源
本研究结果表明, CCMP 1507的毒性主要来源于藻细胞。但是这种毒性物质具体是何种物质, 目前相关的研究还很少。
有学者[14-15]认为,A.lagunensis可能产生一种抑制浮游动物摄食的物质[3]。例如, 抑食金球藻和A.lagunensis都含有高浓度的二甲颈基丙酸内盐(DMSP)。但是目前有关 DMSP对浮游动物摄食的抑制作用并不清楚, 例如Chrysochromulina polylepis与Phaeocystis pouchetii都产生大量的 DMSP, 前者抑制挺挺虫(Tintinnid)的生长及摄食, 后者却可以被多种浮游动物摄食[16-17]。
在本实验中, 作者只观察到在 CCMP 1984、CCMP 1850中卤虫的摄食量低, 但并未发现这两株藻抑制卤虫摄食其他藻, 因此无法推断二者是否产生藻毒素。尽管有学者[18-19]认为, 抑食金球藻对捕食者的抑制作用主要是细胞产生毒素引起的, 但是这一观点主要是通过研究抑食金球藻对贝的危害效应得出的推论。例如, 目前有很多学者认同抑食金球藻产生的抑制物质可能是存在于胞外多糖聚合物(EPS)层中类似多巴胺(DA)的一种物质。但是, 目前并未检测到该藻产生的毒素物质[4,20], 因此有关抑食金球藻产毒的结论依旧存在争议。鉴于中国还未分离到褐潮藻的纯种藻株, 有关中国褐潮藻的分离、毒害效应、影响机制的研究还有待进一步开展。
[1] Sieburth J M, Johnson P W, Hargraves P E, et al.Ultrastructure and ecology ofAureococcus anophagefferensgen.et sp.nov.(Chrysophyceae) the dominant picoplankter during a bloom in Narragansett Bay, Rhode Island,summer 1985[J].J Phycol, 1988, 24: 416-425.
[2] Hudson R, DeYoe D A S, Robert R.Description and characterzation of the algal speciesAureoumbra LagunensisGen.en.et Sp.Nov.and referral ofAureoumbraandAureococcusto the Pelagophyceae[J].Phycol, 1997, 33: 1042-1048.
[3] Edward J, Buskey, C J H.Effects of the Texas (USA)'brown tide' alga on planktonic grazers[J].Marine Ecology Progress Series, 1995, 126: 285-292.
[4] Greenfield D I, Lonsdale D J, Cerrato R M, et al.Effects of background concentrations ofAureococcus anophagefferens(brown tide) on growth and feeding in the bivalveMercenaria mercenaria[J].Mar Ecol Prog Ser, 2004, 274: 171-181.
[5] Landon A W, Paul A M, Richard D K, et al.Sublethal effects of Texas brown tide onStreblospio lychaetalarvae[J].Journal of Experimental Marine Biology and Ecology, 2000, 248: 121-129.
[6] 国家海洋局, 2011年中国海洋灾害公报[R].北京: 国家海洋局, 2012.
[7] Zhang Q C, Qiu L M, Yu R C, et al.Emergence of brown tides caused byAureococcus anophagefferensHargraves et Sieburth in China[J].Harmful Algae, 2012, 19:117-124.
[8] Bricelj V M, MacQuarrie S P, Schaffner R A.Differential effects ofAureococcus anophagefferensisolates (“brown tide”) in unialgal and mixed suspensions on bivalve feeding[J].Mar Biol, 2001, 139: 605-615.
[9] Bricelj V M, Lonsdale D J.Causes and ecological consequences of brown tides[J].Limnology and Oceanography, 1997, 42(5): 1023-1038.
[10] 孔凡洲, 于仁成, 张清春, 等.对桑沟湾海域一次藻华事件原因种的初步分析[J].海洋环境科学, 2012,31(6): 824-829.
[11] Kong F Z, Yu R C, Zhang Q C, et al.Pigment characterization for the 2011 bloom in Qinhuangdaoimplicated “brown tide” events in China[J].Chinese Journal of Oceanology and Limnology, 2012, 30(3): 361-370.
[12] 王荣.荧光法测定浮游植物色素计算公式的修正[J].海洋科学, 1986, 10(8): 1-5.
[13] Smith J K, Lonsdale D J, Gobler C J, et al.Feeding behavior and development ofAcartia tonsanauplii on the brown tide algaAureococcus anophagefferens[J].Journal of Plankton Research, 2008, 30(8): 937-950.
[14] Keller M D, Bellows W K, Guillard R R L.Dimethylsulfide production and marine phytoplankton:An additional impact of unusual blooms[J].Novel Phytoplankton Blooms, 1989, 35: 101-115.
[15] Stockwell D A, Buskey E, Whitledge T.Toxic phytoplankton blooms in the sea[C]// Proceedings 5th International Conference on Toxic Marine Phytoplankton.Amsterdam: Elsevier Science Publishers, 1993: 693-698.
[16] Admiraal W, Venekamp L.Significance of tintinnid grazing during blooms ofPhaeocystis pouchetii(Haptophyceae) in Dutch coastal waters[J].Netherlands Journal of Sea Research, 1986, 20(1): 61-66.
[17] Carlsson P, Graneli E, Olsson P.Toxic marine phytoplankton[C]//Proceedings of the Fourth International Conference on Toxic Marine Phytoplankton.New York:Elsevier, 1990, 116-122.
[18] Bricelj V M, MacQuarrie S P, Smolowitz R.Concentration-dependent effects of toxic and non-toxic isolates of the brown tide algaAureococcus anophagefferenson growth of juvenile bivalves[J].Mar Ecol Prog Ser, 2004, 282: 101-114.
[19] Gainey L F, Shumway S E.The physiological effect ofAureococcus anophagefferens(brown tide) on the lateral cilia [J].Biol Bull, 1991, 181: 298-306.
[20] Harke M J, Gobler C J, Shumway S E.Suspension feeding by the Atlantic slipper limpet (Crepidula fornicata) and the northern quahog (Mercenaria mercenaria) in the presence of cultured and wild populations of the harmful brown tide alga,Aureococcus anophagefferens[J].Harmful Algae, 2011, 10(5): 503-511.
