肾虚-痰瘀-酿毒-病络—中医对老年性痴呆早期发病病机认识*
2015-04-11张占军王永炎
张占军,王永炎
(1.北京师范大学认知神经科学与学习国家重点实验室,北京 100875;2.北京师范大学老年脑健康研究中心,北京 100875;3.中国中医科学院中医临床基础医学研究所,北京 100700)
肾虚-痰瘀-酿毒-病络—中医对老年性痴呆早期发病病机认识*
张占军1,2,王永炎2,3△
(1.北京师范大学认知神经科学与学习国家重点实验室,北京 100875;2.北京师范大学老年脑健康研究中心,北京 100875;3.中国中医科学院中医临床基础医学研究所,北京 100700)
老年性痴呆是一种与年龄密切相关的神经退行性“失连接”疾病,属于中医“健忘”、“文痴”、“呆证”等范畴。目前早期老年性痴呆的发病机制尚不明确,缺少系统的论述和总结。故通过总结中医文献、临床研究、实验研究等方面,在前人研究基础上提出了“肾虚-痰瘀-酿毒-病络”为老年性痴呆早期的核心病机,补肾化浊、解毒通络是老年痴呆早期治法的关键环节,为进一步深入研究老年性痴呆早期的中医证候演变规律,中医药的早期治疗和防控提供理论参考。
早期老年性痴呆;肾虚;痰瘀;酿毒;病络;失连接
老年性痴呆又名阿尔茨海默病(Alzheimer’s disease,AD),是一种与年龄密切相关的神经退行性“失连接”疾病,属于中医“呆痴”、“文痴”、“痴呆”、“愚痴”、“神呆”等范畴,其发病机制尚不明确,已经成为65岁及以上人群的第五位致死原因[1]。按照疾病发展进程,通常情况下AD患者从正常脑功能到痴呆形成大致可分为症状前阶段、临床前阶段、轻度痴呆、中度痴呆和重度痴呆5个阶段。本课题组提出AD是一个“渐进的、三维的、由脑能量代谢障碍启动的、由功能性改变缓慢演变为器质性改变的、存在物质流、能量流和信息流障碍并相互影响的慢性神经退行性疾病”[2]。AD中后期,患者由于脑实质已经发生改变,治疗难以逆转。如能在AD器质性失连接改变之前的阶段进行早期干预,则有助于减缓或逆转痴呆的脑功能损害,故AD的早期(主要包括症状前阶段和临床前阶段)为最佳干预治疗时段。因此,我们在前人经验及课题组研究结果的基础上,对AD早期病机进行了深入探讨和总结,提出肾虚-痰瘀-酿毒-病络的病机演变理论。
1 老年性痴呆早期发病及病理演变规律
已知年龄是 AD发病的基础,载脂蛋白 ε4 (APOE ε4)等位基因是目前最为公认的AD患病危险基因,携带该基因者不仅增加AD的患病率,还显著提前发病年龄[3];糖尿病、高血压病、高脂血症、动脉粥样硬化和其他心脑血管病等老年疾病是导致AD高发的基础性疾病,而Aβ沉积、神经纤维缠结和神经元突触的缺失是AD的核心病理[4]。基于上述改变所导致的脑网络失连接是病变的关键和核心。老龄后血管顺应性下降,ApoE ε4等导致血脂代谢和葡萄糖代谢紊乱,会进一步损伤脑血管内皮细胞,使血管内壁动脉粥样硬化斑块进一步加剧,脑血管运载功能下降,导致脑神经细胞物质和能量代谢障碍,神经细胞因缺血缺氧导致氧化损伤,神经胶质细胞因能量供应不足导致微炎症损伤,神经递质因物质供应不足导致合成、释放等不足,进而神经元突触功能下降甚至缺失,各种因素互为因果、相互影响,超出机体自稳和自我调节能力,最终导致脑网络功能异常,甚至脑网络结构发生改变,形成轻度认知功能障碍(Mild cognitive impairment,MCI),进而导致早期痴呆[5-6]。
我们前期研究发现,早期痴呆患者在工作记忆任务负荷下额叶和颞叶的脱氧血红蛋白变化异常[7]。采用弥散张量成像(Duffusion tensor imaging,DTI)技术发现,多领域早期痴呆患者全脑白质网络拓扑结构受损[8],最显著的差异出现在额叶和颞叶,患者胼胝体以及右侧内囊的白质连接性损伤与认知损伤相关联[9]。经过情景记忆的认知任务提高大脑的工作负荷后,早期痴呆患者与记忆相关的默认网络等后部脑区之间的连接出现了明显的下降[10],不同亚型MCI患者在脑的关键区域,出现脑萎缩与脑区的异常激活[11]。
研究表明,2型糖尿病(Type 2 diabetes mellitus,T2DM)影响多个领域认知功能,是痴呆的独立危险因素,大大提高了AD发生的危险性。我们关于糖尿病的系列研究发现,T2DM是MCI的重要风险因素,T2DM并发MCI在社区老年人中高达21%[12]。而且在自发性脑活动研究中发现,T2DM并发MCI患者的额叶、颞叶、海马、楔前叶等AD相关脑区的ALFF低频振幅异常改变[13]。T2DM对于大脑的影响可能发生在认知障碍之前,随后对非 MCI的T2DM患者研究也证实了这一假说,不仅发现非MCI的T2DM患者脑白质广泛受损[14],而且这类患者大脑活动工作记忆模式发生了改变[15]。
我们对老年APOE ε4携带者和非携带者进行了10项认知功能评估以及生化指标检测、静息态功能磁共振成像扫描和弥散张量成像扫描。研究发现,尽管APOE ε4携带者与非携带者在各领域认知功能、各项血脂指标方面比较差异无统计学意义,但APOE ε4携带者的白质网络连接效率出现了广泛下降,而功能网络效率下降主要集中在内侧颞叶区域。由此可见,APOE ε4对于脑内灰质和白质损伤的模式和路径,可能存在程度不同和机制各异的病理机制,但无论是在功能网络还是白质结构网络,APOE ε4携带者旁海马区域的连接效率均减低,进而影响APOE ε4携带者的记忆功能和脂代谢功能[16]。与此同时还发现,APOE基因启动子rs405509 TT基因携带者会随着年龄的增加使左侧海马的体积变薄,加速认知功能的下降[17]。由此可见,遗传和年龄是AD病变的高危因素,葡萄糖代谢紊乱是AD的重要病变基础,脑供养供能不足、氧化和微炎症损伤,最终导致微环境紊乱-脑失连接,脑网络整体传输效率障碍(图1)。

图1 老年性痴呆早期发病及病理演变
2 肾虚-痰瘀-酿毒-病络是老年痴呆早期的核心病机演变
肾精亏虚衰是AD早期发生的前提条件。肾为水火之宅,内寓元阴元阳,是人体一身阴阳之根本,“五脏六腑之阴气,非此不能滋;五脏六腑之阳气,非此不能发”(《景岳全书》)。肾中阴阳充足,五脏六腑得以充养才能各司其职,发挥各自的生理功能。肾藏精,精生髓充脑,脑为元神之腑,神有所主则耳聪目明、思维敏捷。若肾脏虚衰、五脏六腑功能失调,则气血津液生化受阻,脑髓充养乏源,继而导致脑神无以充养、智力减退。现代多项研究显示,高危基因携带可能与先天肾精亏虚有着重要的联系[18]。
年龄是AD发病的基础,75岁是其发病的关键界线。随着年龄的增加,“年老肾精虚衰,髓源亏乏,使髓海不充,则神明不清而成呆病矣”(《内经精义》);肾精亏虚,充脑乏源,故“高年无记性者,脑髓渐空”(《医林改错》),表明人至老年,五脏六腑之功能逐渐减退,导致阴阳气血俱虚,阴气自半,肝肾阴虚,或肾中精气虚衰,不能生髓乏源,髓海空虚则会引起髓减脑消、神机失用而成痴呆。
痰瘀是引起AD的病理因素。人至年老,肾精亏虚,元阳无根,温煦蒸腾无力,无以温脾,脾不散精,清浊不分,清者聚集成痰,浊者汇聚变脂(浊),“意舍不清,神官不职,使人健忘”(《济生方·健忘论治》);痰瘀不分,相互胶结,“积于胸中,盘踞于心外,神明不清而成呆病”(《辨证录》),痰积即久,蒙蔽神明,可致“痰气最盛,呆气最深”(《石室秘录》);痰瘀阻于络道,络脉不畅,血运无力,阻于心脉,则“凡心有瘀血,亦令健忘”(《景岳全书》),阻于元神,则“血在上,则浊蔽而不明矣”(《血证论》);肾精虚衰,滋养乏力,元阴难藏,阴不制阳,虚阳浮越,则见“肝气最急,郁则不能急矣,于是肾气来滋,至肝则止;心气来降,至肝则回。以致心肾两相间隔,致有遗忘也”(清·陈士铎)。
病络是AD的关键病机。随着病程的进展,痰瘀互阻,邪气蕴结(《金匮要略心典》“毒者,邪气蕴结不解之谓”),酿浊化毒,毒邪积于脑,形成特异性病理产物,流于脑窍、脑络失养,导致脑络受损,形成病络之证,神机受伤则见学习记忆功能和认知功能障碍。由此可知,早期痴呆病机发展的基础是肾虚,痰湿和浊毒是导致病机演变的关键,病络是早期痴呆的病机核心(图2)。
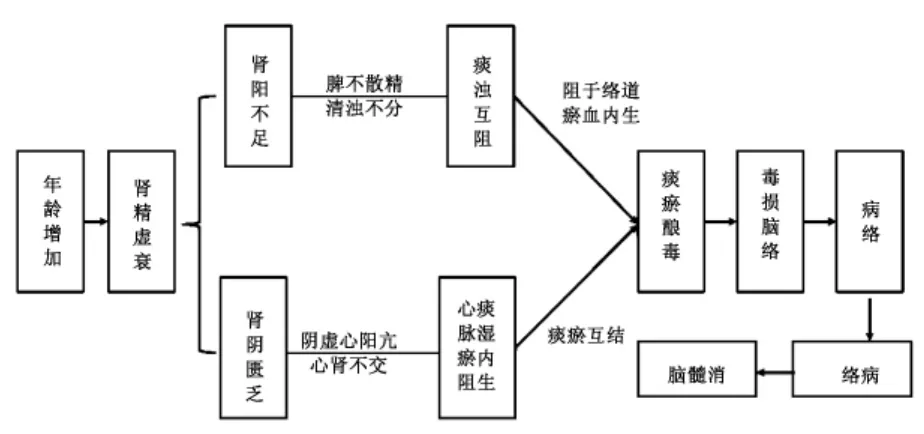
图2 老年性痴呆早期病机演变规律
3 补肾化瘀、解毒通络是老年痴呆早期的治疗关键
中医理论认为“五脏之伤,穷必及肾”,是基于未病先防的思想,表明了补肾固本在治疗五脏疾病方面的重要性。与之相反,肾脏损伤也必然会累及其他脏腑。早在20世纪80年代,课题组就提出“毒邪”和“络病”可以作为AD等疾病深入研究的切入点,认为“毒损脑络”是AD发生发展的核心病机[19],并指出解毒通络法是AD的治疗关键。本课题组前期在“毒损脑络”理论指导下,应用解毒通络法干预MCI患者,结果发现药物作用靶区正是疾病最为易感的后扣带回、楔前叶等区域,解毒通络方可通过调节大脑后扣带回(PCC)区域的负激活而发挥整体调节作用的神经机制[20]。在AD动物模型方面,通过能量代谢-认知行为-组织病理-基因表达等多个层面,验证中药治疗AD模型大鼠的疗效,发现解毒通络方可显著减轻AD大鼠的认知障碍,提高AD大鼠的脑葡糖糖代谢水平,显著影响了19个基因的表达,其中近60%的基因与神经保护和神经发生有关[21]。
综上所述,AD早期的发病机制主要由肾精虚衰引起,进而导致脾不散精,清浊不分,痰瘀互阻;或阴虚阳亢,心肾不交,心脉瘀阻,致使痰瘀酿毒、毒损脑络而成病络,使神机失用,日久发为呆病。针对以上AD早期“肾虚-痰瘀-酿毒-病络”的病机演变过程,中医临床防治AD应以填补肾精、充养脑髓治其本,以化痰清浊、活血化瘀、解毒通络治其标,以使肾精充足,脑髓充盈,神机复用。同时,应注意补虚切忌滋腻太过,以免损伤脾胃,酿生痰瘀,化生瘀血。
[1] Alzheimer’s Association.2008 Alzheimer’s disease facts and figures[J].Alzheimers&Dementia,2008,4(2):110-133.
[2] 张荫杰,徐世军,代渊,等.通络醒脑泡腾片对痴呆大鼠突触素表达的影响[J].中药药理与临床,2012,28(3):84-87.
[3] Michaelson D M.APOE epsilon4:The most prevalent yet understudied risk factor for Alzheimer’s disease[J].Alzheimers &Dementia,2014,10(6):861-868.
[4] Giacobini E,Gold G.Alzheimer disease therapy-moving from amyloid-beta to tau[J].Nature Reviews Neurology,2013,9 (12):677-686.
[5] Liu CC,Kanekiyo T,Xu H,et al.Apolipoprotein E and Alzheimer disease:risk,mechanisms and therapy[J].Nature Review Neurology,2013,9(2):106-118.
[6] Dean DC 3rd,Jerskey BA,Chen K,et al.Brain differences in infants at differentialgeneticrisk forlate-onsetAlzheimer disease:a cross-sectional Imaging Study[J].JAMA Neurology,2014,71(1):11–22.
[7] Niu HJ,Li X,Chen YJ,et al.Reduced prefrontal activation during a working memory task in mild cognitive impairment:a noninvasive near-infrared spectroscopy study[J].CNS Neuroscience&Therapeutics,2013,19(2):125-131.
[8] Shu N,Liang Y,Li H,et al.Disrupted topological organization in white matter structural networks in amnestic mild cognitive impairment:relationship to subtype[J].Radiology,2012,265 (2):518-527.
[9] Li H,Liang Y,Chen KW,et al.Different patterns of white matter disruption among amnestic MCIsubtypes:relationship with neuropsychological performance[J].Journal of Alzheimer’s Disease,2013,36(2):365-376.
[10] Wang L,LiH,LiangY,etal.Amnesticmildcognitive impairment:topologicalreorganization ofthedefaultmode network in amnestic mild cognitive impairment[J].Radiology,2013,268(2):501-514.
[11] Li X,Zheng L,Zhang JY,et al.Differences in functional brain activation and hippocampalvolume among amnestic mild cognitive impairment subtypes[J].Current Alzheimer Research,2013,10(10):1080-1089.
[12] Li X,Ma C,Zhang JY,et al.Prevalence of and potential risk factors for mild cognitive impairment in community-dwelling residents of Beijing[J].Journal of the American Geriatrics Society,2013,61(12):2111-2119.
[13] Zhou XQ,Zhang JY,Chen YJ,et al.Aggravated cognitive and brain functional impairment in mild cognitive impairment patients with type 2 diabetes:a resting-state functional MRI study[J].Journal of Alzheimer’s Disease,2014,41(3):925-935.
[14] Zhang JY,Wang YX,Wang J,et al.White matter integrity disruptions associated with cognitive impairments in type 2 diabetic patients[J].Diabetes,2014,63(11):3596-3605.
[15] Chen YJ,Liu Z,Zhang JY,et al.Altered brain activation patterns under different working memory loads in patients with type 2 diabetes[J].Diabetes Care,2014,37(12):3157-3163.
[16] Chen YJ,Chen KW,Zhang JY,et al.Disrupted functional and structural networks in cognitively normal elderly subjects with the APOE ε4 allele[J].Neuropsychopharmacology,2014,in press.
[17] Chen YJ,Li P,Gu B,et al.The effects of an APOE promoter polymorphism on human corticalmorphology during nondemented aging[J].Journal of Neuroscience,2014,in press.
[18] 周岚.老年痴呆的中医辨证分型特点及其与APOE基因多态性相关性的初探[D].湖北中医学院,2004.
[19] 徐世军,赵宜军,张文生,等.从中医脑络功能演变谈轻度认知障碍的病机[J].中医杂志,2011,52(19):1627-1629.
[20] Zhang JY,Wang ZJ,Xu SJ,et al.The effects of CCRC on cognition and brain activity in aMCI patients:A pilot placebo controlled BOLD fMRI study[J].Current Alzheimer Research,2014,11(5):484-493.
[21] Zhang JY,Li P,Wang YP,et al.Ameliorative effects of a combination of baicalin,jasminoidin and cholic acid on ibotenic acid-induced dementia model in rats[J].PloS One,2013,8(2): e56658.
R228
A
1006-3250(2015)03-0244-03
2014-12-10
国家自然科学基金重点项目(81430100);国家自然科学基金面上项目(81274001,81173460,30873458);国家科技重大专项(重大新药创制)(2013ZX09103002-002)
张占军(1972-),男,教授,医学博士,博士研究生导师,从事轻度认知障碍和老年性痴呆的理论及临床研究。
△通讯作者:王永炎(1938-),男,教授,主任医师,博士研究生导师,中央文史馆馆员,中国工程院院士,从事中医药防治老年痴呆、中风病的临床与基础研究,E-mail:zhjtcm@163.com。
