胸内巨大淋巴结增生症的外科诊疗分析
2015-04-11丁政李向楠赵佳朱登彦吴恺赵松
丁政 李向楠 赵佳 朱登彦 吴恺 赵松
胸内巨大淋巴结增生症的外科诊疗分析
丁政 李向楠 赵佳 朱登彦 吴恺 赵松
目的 探讨胸内巨大淋巴结增生症的临床特征、影像学表现、治疗方法及预后情况。方法 回顾性分析郑州大学第一附属医院胸外科自2009年11月至2015年11月收治的6例巨大淋巴结增生症患者临床资料,分析肿瘤的位置、CT表现、手术结果、病理结果及预后情况。结果 6例患者皆行外科手术完整切除肿瘤,术后病理证实为巨大淋巴结增生症,其中透明血管型4例、浆细胞型1例、混合型1例。6例患者术后随访1~6年,无失访病例,均保持无病生存状态。结论 胸内巨大淋巴结增生症多较局限,术前极易误诊,主要采取以手术为主的综合治疗。若能完全切除肿瘤,必要时术后辅助放化疗,几乎可以彻底治愈。
巨大淋巴结增生症; Castleman病; 透明血管型; 浆细胞型; 混合型
胸内巨大淋巴结增生症又被称作胸内Castleman病(Castleman’s disease,CD),是一种罕见的胸部肿瘤,主要分为透明血管型、浆细胞型和混合型三种。胸内Castleman病主要表现为纵隔、肺门、肺实质内单发或多发淋巴结肿大,临床症状多不明显,实验室检查及影像学检查缺乏特异性,临床诊断与鉴别诊断较为困难。本研究分析了郑州大学第一附属医院胸外科收治的6例单中心型巨大淋巴结增生症患者的临床资料,并结合相关文献,对其外科诊疗经验进行分析总结,现报道如下。
资料与方法
一、基本资料
回顾性分析2009年11月至2015年11月郑州大学第一附属医院胸外科收治的6例胸内单中心型巨大淋巴结增生症患者的临床资料,其中男性4例,女性2例;年龄15~44岁,平均32.8岁;病程1个月~2年,平均6.7个月。单发病变4例,分别位于右肺上叶、胸廓入口处、左前上纵隔和右前上纵隔;多发病变2例,1例位于左前上纵隔及左颈部,1例位于右肺门及隆突下。6例患者术前均行常规抽血检查,其中合并贫血2例,合并肝损伤3例,血凝六项异常3例,红细胞沉降率加快4例。
二、病例纳入和排除标准
1.纳入标准:(1)无恶性肿瘤病史,无免疫抑制剂长期接触史;(2)肿大淋巴结部位较局限,边界较清楚,术前估计肿瘤可以完全切除;(3)全身状况良好,能耐受全麻下纵隔肿瘤切除术或肺叶切除术;(4)术后病理确诊为巨大淋巴结增生症。
2.排除标准:(1)存在恶性肿瘤病史或免疫抑制剂长期接触史;(2)肿大淋巴结广泛存在,无法完全切除;(3)心肺功能较差,不能耐受全麻手术;(4)术后病理未确诊为巨大淋巴结增生症。
三、手术方法
病例1:病变位于左前上纵隔,术前考虑胸腺瘤,遂行胸腔镜纵隔肿瘤切除术。患者右侧卧位,左侧腋中线第7肋间建立观察孔,腋中线第4肋间、腋前线第5肋间建立操作孔,探查肿瘤大小2cm× 2cm×1cm,包膜完整,血供丰富,钝锐性结合完整切除肿瘤。
病例2:病变位于右肺上叶肺实质内,术前考虑右上肺癌,遂行右肺上叶切除术+系统淋巴结清扫术。患者左侧卧位,右侧第5肋间进胸,探查见肿瘤位于右上肺实质内,大小3cm×3cm×3cm,质硬,边界不清,打开前纵隔胸膜,依次游离并离断肺静脉、动脉、支气管,完整切除右肺上叶并清扫各组淋巴结。
病例3:病变位于右前上纵隔,术前CT诊断Castleman病,遂行胸腔镜纵隔肿瘤切除术。患者左侧卧位,右侧腋中线第7肋间建立观察孔,腋中线第4肋间、腋前线第5肋间建立操作孔,探查肿瘤大小6cm×5cm×4cm,包膜完整,血供丰富,钝锐性结合完整切除肿瘤。
病例4:病变位于上腔静脉旁,术前考虑胸骨后甲状腺肿,遂行胸骨后肿瘤切除术。患者仰卧位,纵行劈开部分胸骨,可见肿瘤位于上腔静脉后方,大小5cm×4cm×3cm,仔细游离肿块,结扎滋养动脉,完整切除肿瘤。
病例5:病变位于右肺门及隆突下,术前根据CT考虑Castleman病,遂行纵隔肿瘤切除术。患者左侧卧位,右侧第5肋间进胸,探查见肿物位于右肺中叶与下叶支气管之间,大小约5cm×4cm×4 cm,质韧,表面光滑,边界清晰,于中叶、下叶支气管间钝锐性结合完整切除肿瘤,于隆突下完整切除肿大淋巴结。
病例6:病变位于左前上纵隔及左颈部,肿瘤最大约4cm×4cm×3cm,术前CT诊断Castleman病,遂行纵隔肿瘤切除术+左颈部淋巴结清扫术。患者首先右侧卧位,左侧第3肋间进胸,钝锐性结合完整切除纵隔肿瘤,然后换仰卧位,左锁骨上一横指做5cm弧形切口,清扫左颈部4、5区多个肿大淋巴结。
四、病理学检查方法
患者标本切除后立即送至病理科,10min内用4%多聚甲醛固定,脱水后进行石蜡包埋。根据需要取病变组织制成切片,然后进行苏木精-伊红染色(HE染色),先肉眼观察切片的组织密度、颜色等是否一致,然后用低倍镜(40倍)全面观察病变组织特点。最后,应用免疫组织化学技术测定病变组织化学成分的变化。
五、随访
1.随访方法:患者术后第1年,每隔3个月进行电话或短信联络;术后第2年及以上,每隔6个月进行电话或短信联络知,通知患者门诊复查,进行病情询问、体格检查及颈胸部CT平扫,详细记录复查的结果。
2.随访指标:(1)术前症状有无缓解;(2)原发病灶术后有无复发;(3)其他部位有无新发淋巴结肿大;(4)有无其他脏器远处转移灶。
结 果
一、影像学表现
本组6例患者术前均行CT扫描,平扫多无明显特异性,表现为界限清楚、形状不规则、密度欠均匀的软组织肿块影;增强扫描时,病变多明显强化,CT值90~160HU,平均125HU,病变周围可见增强小血管影。其中2例患者病变分别位于肺门和肺叶内,纤维支气管镜检查未见异常,部分患者CT表现如图1所示,2例患者行浅表器官彩色超声检查发现颈部肿物,形状不规则,边界清晰,其内可及明显血流信号。本组6例患者中,根据CT特征性表现,3例于术前诊断Castleman病,另3例分别误诊为肺癌、胸腺瘤和胸骨后甲状腺肿,可见本病临床误诊率很高。
二、术中、术后和随访情况
1.手术及恢复情况:本组6例患者均采取手术治疗,术式包括开胸手术切除和微创胸腔镜手术切除2种,术中均完全切除肿瘤。6例患者均术后恢复良好,无手术相关并发症,住院时间9~16d,平均12d。
2.术后病理结果:手术切除标本6例,4例透明血管型(hyaline vascular variant,HVV),1例浆细胞型(plasma-cell variant,PCV),1例混合型(mixed variant,MV)。三型病变镜下共同表现为淋巴滤泡明显增生并小血管穿入其中,但HVV可见淋巴滤泡和小血管大量增生,PCV可见滤泡间及副皮质区浆细胞明显增生,MV滋养血管和浆细胞均增生明显(图2)。本组6例患者免疫组织化学检测表现分别为CD3(+)、CD43(+)、CD20(+)、CD21(FDC+)和Ki-67(+)<30%。
3.随访和预后情况:6例患者术后随访1~6年,无失访病例,且无病生存至今(表1)。

图1 胸内Castleman病患者病变的位置。A:病变位于肺门;B:病变位于右上肺;C:病变位于右上肺
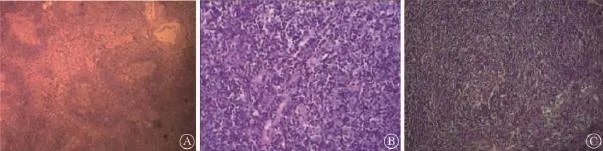
图2 显微镜下Castleman病患者的病理学表现(HE×40)。A:透明血管型(HVV);B:浆细胞型(HVV);C:混合型(MV)
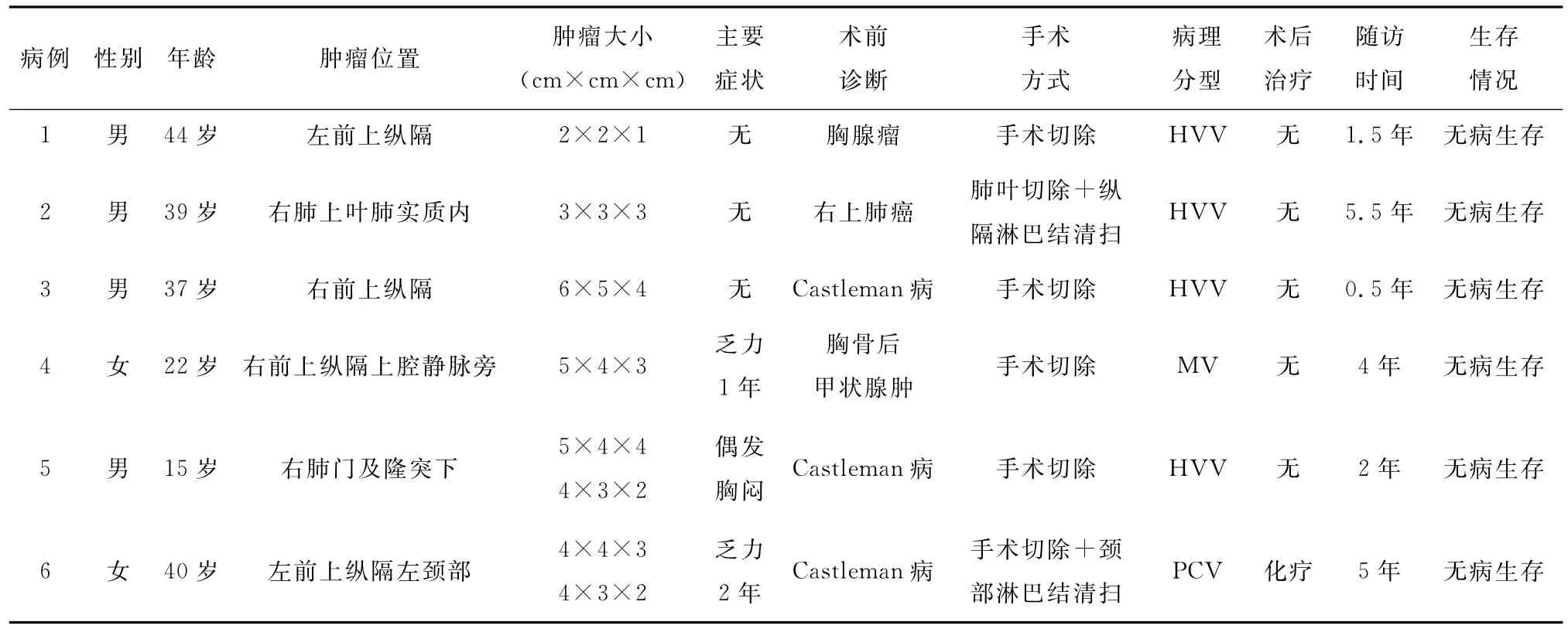
表1 6例胸内Castleman病患者的手术相关资料
讨 论
Castleman等[1]于1956年首次报道一种局限于纵隔的肿块,组织学显示其淋巴滤泡及毛细血管明显增生,命名血管滤泡性淋巴结增生(vascular follicular lymphnode hyperplasia),又叫Castleman病(Castleman’s disease,CD)。1969年Flendring等[2]又提出了CD的又一组织学亚型,以浆细胞增生为特征,常伴全身性症状。由于该类患者淋巴结肿大十分明显,直径可达10cm以上,故又名巨大淋巴结增生症(giant lymphnode hyperplasia)。CD是一种罕见的特殊类型的反应性淋巴结增生性疾病,肿大淋巴结可发生于全身任何部位,以胸部最为常见(占约70%),胸内CD依次好发于前纵隔、气管旁和肺门,肺实质内极其少见[3-4]。本组6例患者中,4例病变位于前纵隔,2例位于肺门和肺实质内。
CD因其发病率较低、发病部位多变、临床表现各异而极易误诊,故既往罕见报道。近些年,随着穿刺活检技术快速发展、微创手术水平和病理诊断水平日益提高,越来越多的CD患者获得明确诊断和及时治疗,这也使该病越来越受到临床医师的关注。但CD的病因及发病机制目前尚不明确,国内外现阶段研究认为其可能与淋巴结慢性炎症、免疫缺陷或自身免疫性疾病有关。El-Osta等[5]提出部分CD患者常伴有免疫功能异常,静脉血检测可发现白介素水平或IgG含量升高,本组1例PCV型患者出现不明原因贫血伴IgG含量升高,可能与此有关。Guihot等[6]提出人类疱疹病毒(human herpes virus,HHV)8型(HHV-8)和人类免疫缺陷病毒(human mmunodeficiency virus,HIV)感染可能与本病有关,主要见于多中心型,尤其与浆细胞型密切相关,部分HHV-8(+)或HIV(+)多中心型CD最终可发展成为B细胞淋巴瘤,而本组6例无类似病毒感染患者。
临床分型上,目前普遍采用的是Frizzera等[7]于1988年提出的分型标准,按肿大淋巴结部位及数量分为单中心型CD(unicentric Castleman's disease,UCD)和多中心型CD(multicentric Castleman's disease,MCD)。病理分型上,目前普遍采用的是Kell等[8]于1972年提出的分型标准,根据镜下肿瘤组织学特征分为HVV、PCV和MV型。HVV滤泡周围由多层环心排列的淋巴细胞形成特殊的“洋葱皮”样结构,PCV特征表现为滤泡间各级浆细胞成片增生,可见Russell小体,同时仍有少量淋巴细胞及免疫母细胞。本组6例患者中,4例HVV型、1例PCV型和1例MV型,病理表现均符合上述特征。
根据最新研究[9-11]发现,UCD患者占47%~81%,MCD患者占19%~53%。UCD中位发病年龄30~40岁,大多为HVV型(占76%~91%),最常累及纵隔淋巴结(占约65%),其次为颈、腋及腹部淋巴结,偶见于结外组织如喉、外阴、心包、肺等器官,患者多无明显症状,主要表现为单一部位淋巴结肿大。UCD患者PCV型较少见,占9%~24%,患者多表现为腹腔单发淋巴结肿大,常伴发热乏力、消瘦贫血等全身性症状,肿块切除后症状可明显缓解或消除,且极少复发。MCD患者的中位发病年龄为50~60岁,PCV型居多(占约77%),患者多部位淋巴结肿大,多数伴有全身症状及多系统受累表现,如肝脾肿大、肌无力、淋巴瘤、干燥综合征、肾病综合征等,易伴发感染,甚至引起多器官衰竭导致死亡。本组6例患者均属于UCD,临床特点与报道相符,4例HVV型患者无明显症状,2例PCV和MV型患者伴有乏力症状。
本病多无明显特征性症状,实验室检查及影像学检查缺乏特异性,病理学检查为CD诊断的金标准。然而CD以HVV型居多,病灶滋养血管丰富,穿刺活检出血风险较大,故术前确诊极为困难。CT检查对本病诊断有较高价值,特别是CT增强扫描意义重大。CT平扫可见肿块密度不均匀,病灶内可见低密度影和高密度影混杂,低密度影与增生的淋巴滤泡透明样变或胶样囊性变有关,而高密度钙化影与淋巴滤泡内增生的小血管玻璃样变或钙质沉积有关。CT增强扫描可见病灶大多明显强化,但不同病理亚型病灶的强化特点有所不同[12],HVV型病灶是一种富血管性病变,于动脉期明显强化,强化特点几乎与主动脉一致,而PCV、MV型病灶强化特点无明显特征性,极易误诊。本组6例患者均行CT增强扫描,4例HVV型病变中的2例CT表现极具特征性,CT值110~160HU,以动脉期强化最为明显,几乎与胸、腹主动脉同步,病灶周围可见点状异常增强的滋养血管,术前依据CT表现诊断为CD,2例HVV型病变和1例MV型病变因CT特征不明显而误诊;1例PCV型病变者CT特征不明显,但因纵隔和颈部多个淋巴结肿大而行穿刺病理确诊Castleman病。
UCD患者病灶局限,疾病发展呈良性病程,以手术治疗为主,肿块完全切除后极少复发,患者可长期保持无病生存状态。Talat等[13]最新研究表明,外科手术切除对于各型UCD患者治愈率几乎达到100%。但对于一些病灶较大不能完全切除或身体无法耐受手术的UCD患者,可行单纯放疗或联合放疗,Vries等[14]研究表明放疗总有效率为89.6%,完全缓解率为44.8%。部分MCD患者病变相对局限,全身症状较轻,可以考虑手术姑息性切除并术后辅助化疗,同样可以取得较好的治疗效果。但部分MCD患者病变较广泛,合并严重全身性病变,且不断侵袭发展,可致多器官受累,最终引起多器官衰竭导致患者死亡,不建议外科手术切除,首选联合化疗,但目前尚无标准治疗方案,可选用COP方案(环磷酰胺+长春新碱+泼尼松)或CHOP方案(环磷酰胺+阿霉素+长春新碱+泼尼松)化疗,总体预后较差,中位生存期为26个月[15]。胸内CD病灶大多为单中心型,以手术切除为主要治疗方法[16]。本组6例患者均完全切除肿瘤,其中1例PCV型患者纵隔和左颈部多个淋巴结肿大,术后给予CHOP方案化疗4周期,剩余5例患者术后未行任何治疗。6例患者分别随访1~6年,均保持无病生存状态。
1 Castleman B,Lverson L,Menendex V.Localized mediastinal lymphnode hyperplasia resembling thymoma[J].Cancer,1956,9:822-830.
2 Bowen WB,Lewis JJ,Filippa DA,et al.The management of unicentric and multicentric Castleman’s disease:a report of 16 cases and a review of the literature[J].Cancer,1999,85;706-717.
3 Cronin DM,Warnke RA.Castleman disease:an update on classification and the spectrum of associated lesions[J].Adv Anat Pathol,2009,16(4):236-246.
4 沈明敬,徐忠恒,徐中华,等.胸腔Castleman病诊治分析[J].中华胸心血管外科杂志,2014,30(8):491-492.
5 El-Osta HE,kurzrock R.Castleman’s disease:from basic mechanisms to molecular theraputics[J].Oncologist,2011.16(4):497-511.
6 Guihot A,Oksenhendler E,Galicier L,et al.Multicentric Castleman disease is associated with polyfunctional effector memory HHV-8-specific CD8+T cell[J].Blood,2008,111(3):1387-1395.
7 Frizzera G.Castleman’s disease and related disorders[J].Semin Diagn Pathol,1988,5(4):346-364.
8 Keller AR,Hochholzer L,Castleman B.Hyaline-vascular and plasma-cell types of giant lymph node hyperplasia of the mediastinum and others locations[J].Cancer,1972,29(3):670-683.
9 Dispenzieri A,Armitage JO,Loe MJ,et al.The clinical spectrum of Castleman’s disease[J].Am J Hematol,2012,87(11):997-1002.
10 Kim TU,Kim S,Lee JW,et al.Plasma cell type of Castleman’s disease involving renal parenchyma and sinus with cardiac tamponade:case report and literature review[J].Korean J Radiol,2012,13(5):658-663.
11 Jain S,Chatterjee S,Swain JR,et al.Unicentric Castleman’s disease masquerading pancreatic neoplasm[J].Case Rep Oncol Med,2012,2012:793403.
12 王仁贵,霍萌,王丹丹,等.胸腹部局限性Castleman病的CT特征分析[J].中华放射学杂志,2010,44(11):1161-1166.
13 Talat N,Belgaumkar AP,Schulte KM.Surgery in Castleman’s disease:a systematic review of 404published cases[J].Ann Surg,2012,255(4):677-684.
14 De Vries I,Van Acht M,Demeyere T,et al.Neoadjuvant radiotherapy of primary irresectable unicentric Castleman's disease:a case report and review of the literature[J].Radiat Oncol,2010,5:7.
15 Weisenburger DD,Nathwani BN,Winberg CD,et al.Multicentric angiofollicular lymph node hyperplasia:a clinicopathologic study of 16cases[J].Hum Pathol,1985,16(2):162-172.
16 赵静,丁嘉安,姜格宁.胸内血管滤泡性淋巴结增生症15例分析[J].中华结核和呼吸杂志,2000,23:256.
Surgical diagnosis and treatment of giant lymph node hyperplasia in the chest
Ding Zheng,Li Xiangnan,Zhao Jia,Zhu Dengyan,Wu Kai,Zhao Song.Department of Thoracic Surgery,The First Affiliated Hospital of Zhengzhou University.Zhengzhou 450052,China.
Zhao Song,Email:zhaosong@zzu.edu.cn
Objective To investigate the clinical characteristics,imaging features,treatment and prognosis of giant lymph node hyperplasia in the chest.Methods The clinical data of 6patients with giant lymph node hyperplasia treated in Department of Thoracic Surgery,The First Affiliated Hospital of Zhengzhou University between November 2009and November 2015were retrospectively analyzed.The tumor location,CT findings,surgical results,pathological findings and prognosis were analyzed.Results All patients underwent surgical resection for giant lymph node hyperplasia which was proved by postoperative pathology.Among them,there were 4cases of hyaline vascular variant,1case of plasmacell variant and 1case of mixed variant.Patients were followed up for 1to 6years,and none was lost in follow-up.All patients are still alive and free of disease.Conclusions Most giant lymph node hyperplasia in the chest is limited,which are easy to be misdiagnosed before operation.Comprehensive treatment based on operation is the main treatment.After complete resection and necessary postoperative adjuvant radiotherapy and chemotherapy,the patient can be almost completely cured.
Giant lymph node hyperplasia; Castleman’s disease; Hyaline vascular variant;Plasma-cell variant; Mixed variant
2015-11-05)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.04.010
450052 郑州大学第一附属医院胸外科,郑州大学肺癌诊疗研究中心,郑州市胸部肿瘤重点实验室
赵松,E-mail:zhaosong@zzu.edu.cn
丁政李向楠赵佳,等.胸内巨大淋巴结增生症的外科诊疗分析[J/CD].中华胸部外科电子杂志,2015,2(4):254-258.
