杂交狼尾草不同外植体愈伤组织诱导
2015-04-10臧文静苟孝琴武炳超杨盛婷张新全黄琳凯
臧文静,陈 莹,李 青,苟孝琴,武炳超,杨盛婷,张 锐,张新全,黄琳凯
(四川农业大学动物科技学院,四川 成都611130)
杂交狼尾草是美洲狼尾草(Pennisetum americanu m)和象草(Pennisetu m pur p ureu m)的三倍体种间杂交种[1],具有明显的杂种优势,适应性广、产量高、较耐盐[2],作为优良牧草,其已经在长江中下游广泛推广种植。另外,由于生物量大、干物质产量高、光合效率高的特点[3],近年来杂交狼尾草作为能源植物成为生物质能源研究的热点之一。
研究并建立较为高效的组织培养体系是遗传转化体系建立、分子育种、基因功能研究的前提和基础。近年来国内相继有专家学者对狼尾草属植物的组培及快繁体系进行探索,在象草(Pennisetum pur pureu m)腋芽外植体消毒方法的筛选中研究表明用自来水冲洗60 min,0.1%升汞浸泡消毒25 min,2%次氯酸钠浸泡消毒20 min,可以使污染率降到13.33%[4]。对红色狼尾草(Pennisetu m setaceu m ‘Rubr u m’)的离体培养及产业化生产的研究中表明,顶芽和节段用0.1% 升汞灭菌8~12 min效果最好,出愈率可达75%和90%[5]。研究表明绒毛狼尾草(Pennisetu m setaceu m )幼嫩花穗在添加了2,4-D 的MS和N6两种基本培养基上都能诱导出愈伤组织,但MS培养基上的诱导率稍微高一些,在MS+3 mg·L-12,4-D 中诱导率达100%[6]。但关于杂交狼尾草组织培养的研究报道相对较少。王凭青等[7]以杂交狼尾草的茎节(带侧芽)、茎段、心叶和嫩叶为外植体材料获得再生苗。单独使用2,4-D其它植物生长调节剂如ABA、NAA 或KT 时,形成的愈伤组织胚性不高,难于再生,而添加了KT、ABA 等激素,则可以有效提高愈伤组织的胚性[8]。刘芳等[9]发现杂交狼尾草比普通禾本科植物再生更为困难,且易染菌及分化率低等问题。因此,研究并创建较为高效的组织培养体系是需要解决的重要课题。本文以杂交狼尾草成熟种子及心叶为外植体,采用两步法灭菌,以MS培养基为基础培养基,通过调节诱导培养基的激素种类及浓度,探索杂交狼尾草愈伤组织诱导及分化培养基的激素配方,从而筛选出最佳配比,为狼尾草组培及快繁体系提供科学依据。
1 材料与方法
1.1 试验材料及处理
本文的试验材料为邦得1号杂交狼尾草种子及心叶。杂交狼尾草种子由北海市绿邦生物创景发展有限公司提供,心叶取自四川农业大学试验园区(5-7月)中采集的杂交狼尾草健康茎段。
先用洗手液将剥去外皮的杂交狼尾草茎段表面灰尘洗净,然后将其截成3~4 c m,用流水冲洗20~30 min后备用。邦得1号杂交狼尾草种子,在常温条件下用洗手液稀释液浸泡24 h,再用流水冲洗20~30 min后备用。
1.2 试验方法
1.2.1 外植体消毒试验 将初步处理后的杂交狼尾草的茎段以及邦得1号杂交狼尾草种子分别置于75%乙醇处理,用无菌水冲洗2~3次,接着再用滴加2~3滴吐温的0.1% Hg Cl2处理,用无菌水冲洗2~3次。其中75%乙醇设置10、20、30 s 3个时间梯度,0.1% Hg Cl2设置6、8、10 min 3个时间梯度。
用无菌滤纸吸干外植体上的水分,在超净工作台内用解剖刀将茎段剖开取出内部幼嫩的心叶切成长约1 c m 的块状,将心叶和种子小心接种在培养基上,把接种完毕的锥形瓶置于(25±2)℃的黑暗条件下培养,接种2 d后开始观察,此后每天观察一次,记录杂交狼尾草种子及心叶出愈数及污染数,计算其出愈率。记录杂交狼尾草种子的发芽种子数、出愈种子数、以发芽及出愈的种子为存活数,计算种子的存活率及出愈率,每处理每锥形瓶中接种10个,重复9次。
1.2.2 培养基制备 以MS为基本培养基,依据试验设计中的不同浓度梯度的激素水平,调节培养基中的琼脂、蔗糖的含量,将培养基的p H 值调至5.8~6.2,在121 ~126 ℃条件下,灭菌20 min,备用。
1.2.3 愈伤组织诱导 杂交狼尾草种子以及心叶的愈伤组织诱导培养基均为:MS+2,4-D+6-BA。两种不同外植体的MS培养基中2,4-D 与6-BA 的质量浓度各有6种处理组合[9]。种子愈伤组织诱导中2,4-D 设 置6 个 浓 度 水 平(3、4、5、6、7、8 mg·L-1),6-BA 设 置2 个 浓 度 水 平(0.3、0.4 mg·L-1),两因素共12个处理。心叶愈伤组织诱导中2,4-D(3、5、7 mg·L-1)与6-BA(0.5、1.0、1.5 mg·L-1)均为3 个浓度水平,两因素共9 个处理。每种培养基中添加8 g·L-1琼脂和20 g·L-1蔗糖。在种子愈伤组织诱导培养处理中,每处理每锥形瓶接种10 个,3 个锥形瓶为一组,重复3 组。在心叶愈伤组织诱导培养处理中,每处理每锥形瓶接种5个,3个锥形瓶为一组,重复3组。
将接种完毕的锥形瓶置于(28±1)℃的黑暗条件下培养,接种2 d后开始观察,每天观察一次,观察并记录出愈情况,愈伤组织的数目、生长速度以及形态特征。统计结果,选取最佳处理组合。
1.2.4 分化培养 杂交狼尾草种子分化培养基为MS+NAA+6-BA。MS培养基中NAA 设0.5、0.7 mg·L-12个浓度水平,6-BA 设1、2、3 mg·L-13个浓度水平,两因素共6个处理。每种培养基中添加0.7%琼脂和3%蔗糖。每处理每锥形瓶接种5个,重复10次。
在种子诱导出的愈伤组织中选取表面纯净干燥、体积较大的个体,接种在分化培养基上,每种处理的培养基分别接种10瓶,每瓶5块愈伤组织。将其置于28 ℃,光照16 h,光照强度为100 000 lx,以及温度为25 ℃、黑暗8 h恒温培养。每天记录愈伤组织的颜色、形态特征的变化、出芽的情况以及出芽的数目,选取最佳处理组合。
生根培养基:1/2 MS添加0.7%琼脂和3%蔗糖。在分化培养25 d后,将生长出幼芽的愈伤组织在无菌环境条件下转接至生根培养基中。
1.3 数据分析
每日观察记录的数据经整理后,分别按照以下公式计算:


采用SPSS 19.0软件利用了比较均值单因素模块针对种子出愈率、心叶出愈率分别进行了方差分析和多重比较;采用Excel 2010利用公式模块针对种子出愈率、心叶出愈率分别进行了标准误的计算。
2 结果与分析
2.1 不同外植体最佳消毒方式
成熟种子在基础培养基上,2 d后开始出芽,6 d后大部分种子出芽。4 d后,部分出芽种子长出白色有透明度的松软组织;同时,部分种子周围有淡黄色油状液体渗出,为带菌种子。自开始记录的第16天停止出愈和出芽,愈伤组织呈白色或浅黄色颗粒状,带菌种子四周菌斑变大。结果表明,种子消毒方式中,A8即酒精30 s、0.1% Hg Cl2处理8 min污染率最低,为7%,除与A7和A9处理间差异不显著外,污染率显著低于其他处理(P<0.05);心叶消毒方式中B9即酒精30 s、0.1% Hg Cl2处理10 min污染率最低,为6%,除B8处理外,污染率显著低于其他处理。

表1 不同消毒方法对不同外植体污染率的影响Table 1 Effects of different treat ments on the contamination rate of different explant
心叶在基础培养基上,14 d 开始长出愈伤组织,部分心叶周围有乳白色或淡黄色油状液体渗出,为带菌材料。
2.2 愈伤组织诱导
经过75%乙醇处理30 s,再用0.1% Hg Cl2处理8 min的成熟饱满种子,经过4 d的28 ℃黑暗培养,大多数种子能够在出芽的部位逐渐长出淡白色且结构较为松散的愈伤组织,随后愈伤组织变大且致密并有部分突起、表面变得干燥且呈现淡黄色颗粒状。经过16 d的培养,存活种子均能出愈,其中大部分愈伤组织淡黄色致密以及具有较高的分化潜能。种子的12种处理水平出愈率差别明显(表2),最大的75%,最小的41%,处理Ⅵ与处理Ⅸ出愈率较高,且两者差异不显著(P>0.05),除Ⅸ与Ⅴ差异不显著外,Ⅵ和Ⅸ显著高于其他处理。因此,采用MS+5 mg·L-12,4-D+0.4 mg·L-16-BA的培养基配方进行愈伤组织诱导,可得到足够多的高质量愈伤组织。同样,采用心叶外植体进行愈伤组织诱导时,出愈率最高为60%(表3),最低为13%,处理Ⅰ出愈率显著高于其他处理(P<0.05)。心叶出愈率以及出愈质量明显低于用种子诱导的,故采用种子作为外植体诱导分化。
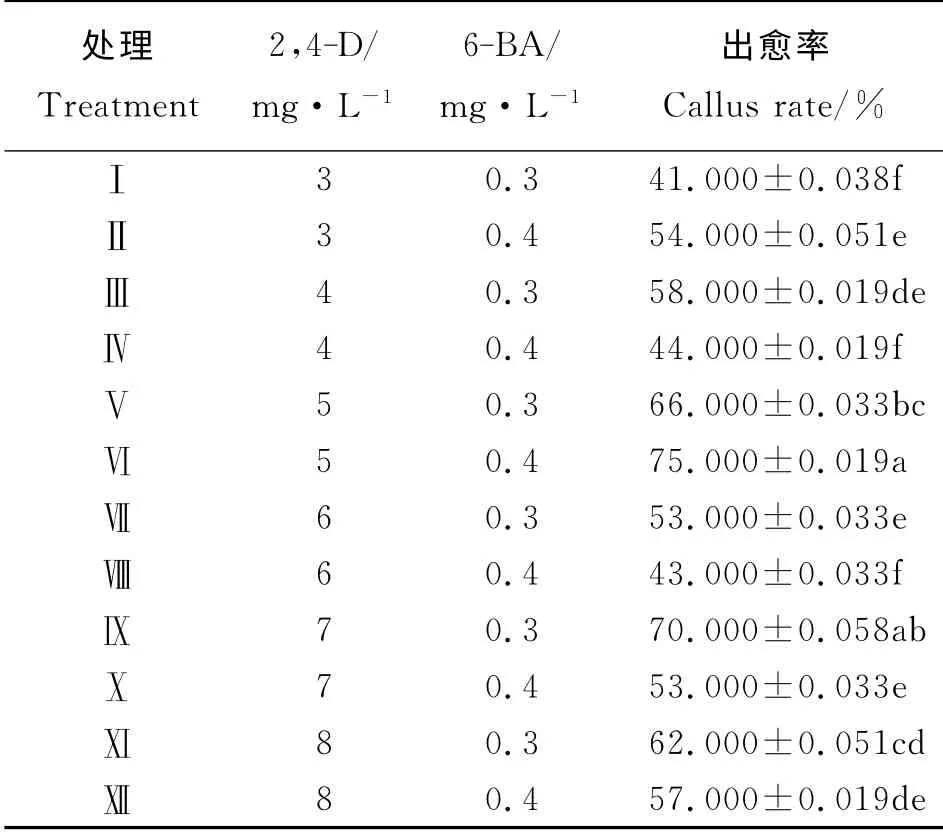
表2 不同浓度的2,4-D和6-BA对种子愈伤组织诱导的影响Table 2 Influence of different concentration combination of 2,4-D and 6-BA on seeds callus induction
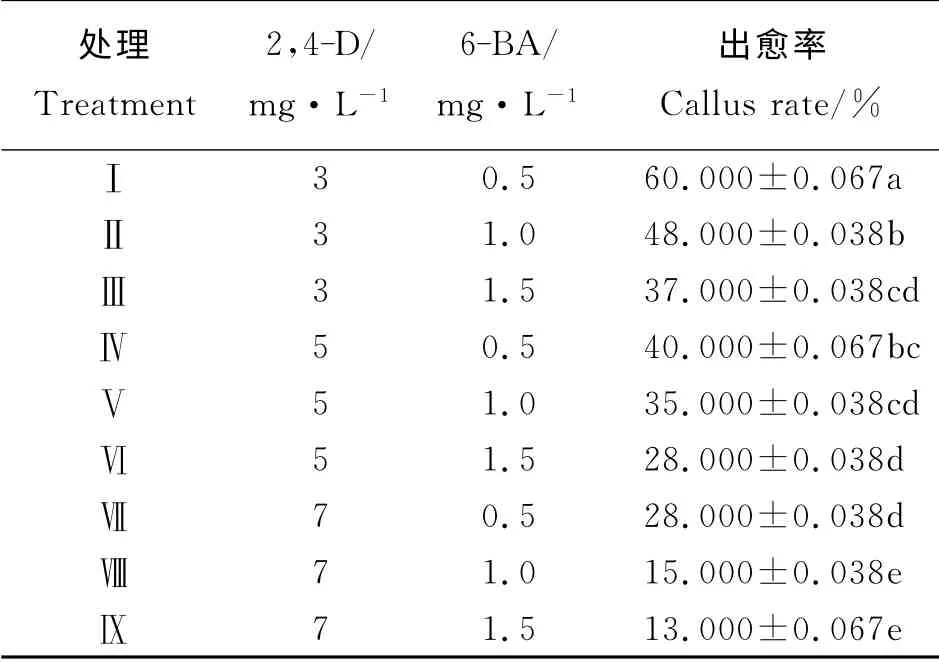
表3 不同浓度的2,4-D和6-BA对心叶愈伤组织诱导的影响Table 3 Influence of different concentration combination of 2,4-D and 6-BA on buds callus induction
2.3 分化培养
愈伤组织在分化培养基上进行光照培养。在接种到分化培养基的第10天开始,愈伤组织上开始出现绿色的点。16 d时部分绿色的点分化成嫩芽(图1),每块愈伤组织平均有3~5个芽,新芽能够很好的直立向上生长。但仍有一部分愈伤组织没有分化出芽,由周边开始变黄褐化,小部分愈伤组织褐化严重。在添加不同质量浓度的NAA 与6-BA 的处理时,各处理中愈伤组织分化出芽的数目均不相同。愈伤组织分化MS+0.5 mg·L-1NAA+3.0 mg·L-16-BA 的分化率最高,可达62.5%,伴随极少量的褐化情况;培养基MS+0.5 mg·L-1NAA+1.0 mg·L-16-BA 以及培养基MS+0.7 mg·L-1NAA+1.0 mg·L-16-BA 的分化率较低,分别为32.5%和37.5%,同时愈伤组织的褐化情况严重。
将分化出芽的愈伤组织块转接到1/2 MS培养基中进行生根培养。大部分带有幼芽的愈伤组织能生根,根系生长良好;小部分的愈伤组织根系生长缓慢;极少部分的愈伤组织不能生根。

图1 种子和心叶胚性愈伤组织的诱导和分化Fig.1 Embryonic callus induction of Pennisetu m americanum×P.Pur pureums’seeds and lobus cardiacus and differentiation
3 讨论
2,4-D 浓度是诱导外植体出愈的主要因素。当2,4-D 的浓度为7 mg·L-1时,心叶外植体的出愈率低,愈伤组织白色透明或半透明,为非胚性愈伤组织,并且大部分外植体出现褐化。种子外植体最佳出愈率的诱导培养基中2,4-D 的浓度为5 mg·L-1,其愈伤组织结构松散,易碎,呈颗粒状,为胚性愈伤组织,种子外植体的最佳出愈率比心叶外植体最佳出愈率高于15百分点。一般2,4-D、NAA对细胞分裂、愈伤组织生长表现为促进作用,6-BA对细胞分裂、愈伤组织生长表现为抑制作用[10],单独使用6-BA 时诱导率较低甚至不能出愈[11],本研究结合高浓度2,4-D 和低浓度6-BA 设计处理,取得较为理想的出愈效果。
植物组织培养中至关重要的一步是选择合适的外植体。在愈伤组织诱导过程中,外植体本身所含的内源激素种类、浓度水平差异和对外源激素的反应灵敏度不同是可能导致不同外植体对激素种类和浓度反应不同的因素[12],也可能是不同外植体出愈能力不同的原因之一。同时,生理状态不同、处于不同生长发育阶段的植物材料也会直接影响愈伤组织的 形态发 生[13-14]。韩 超 和 方 正[15]提 出 中 度 成 熟 器官无论从成活率或分化率上均优于幼嫩器官,因后者在表面消毒过程中极易死亡,与本研究中种子作为成熟器官出愈率、分化率均高于心叶,心叶褐化率较高的结果一致。
本研究对外植体种子和心叶进行愈伤组织的诱导,设置相应的植物激素配比,出愈过程和结果表明,杂交狼尾草的成熟种子与心叶相比,其种子更容易在短时间内诱导出高质量的胚性愈伤组织,芽的脱分化能力比心叶强,生长迅速,有报道称[16],种子的内源激素和营养物比心叶高,由于心叶被手术刀划伤,对其伤害较大,很大程度上影响出愈率。同时心叶污染率普遍高于种子,可能与心叶含较多内生菌有关。综上,在杂交狼尾草的组培快繁中,种子外植体的出愈诱导比心叶更佳。这与杨茹等[17]研究在相同培养条件下,黑麦草(Loliu m perenne)外植体芽尖的愈伤组织诱导效果比种子差的结果相符。
生长激素和细胞分裂素常用来诱导细胞脱分化并控制植物生长发育。2,4-D 被普遍用作牧草类植物组织培养时的生长素[18],Bhaskaran等指出2,4-D 对植物 愈 伤 组 织 诱 导 起 决 定 作 用[19-20],且2,4-D的浓度对愈伤组织的诱导有明显的影响[21],即过高或过低的2,4-D 不利于胚性愈伤组织的形成和分化[22],在沙打旺(Astr agal us adsur gens)愈伤组织诱导的培养基中,高浓度(高于3 mg·L-1)的2,4-D 结合低浓度(低于0.1 mg·L-1)的6-BA 有利于诱导胚 性 愈 伤 组 织 的 发 生[23],与 本 研 究 中5.0 mg·L-1的2,4-D 对杂交狼尾草种子的愈伤组织诱导率最高,而8.0 mg·L-1的2,4-D 诱导率较低结果一致。
4 结论
合适质量浓度的2,4-D 与6-BA 组合能够促进杂交狼尾草种子和心叶愈伤组织的诱导。其中,种子最佳的胚性诱导培养基为MS+5.0 mg·L-12,4-D+0.4 mg·L-16-BA,诱导率为75%,心叶最佳的胚性诱导培养基为MS+3.0 mg·L-12,4-D+0.5 mg·L-16-BA,诱导率为60%;种子愈伤组织诱导率高于心叶,为较好外植体。最优分化培养基为MS+0.5 mg·L-1NAA+3.0 mg·L-16-BA,分化率为62.5%。
[1] 陈钟佃,张丽梅,黄秀声,刘明香,黄勤楼.杂交狼尾草茎叶解剖结构及其与主要生物学特性的联系[J].中国草地学报,2009,31(6):39-43.
[2] 刘逸泠,祝建波.杂交狼尾草胚性愈伤组织的诱导与植株再生[J].植物生理学报,2015,51(1):136-140.
[3] 谢妤,张子雯.杂交狼尾草离体培养植株再生体系的建立[J].宜春学院学报,2012,34(12):97-99.
[4] 姚娜,赖志强.象草腋芽外植体消毒方法的筛选[J].基因组学与应用生物学,2010,29(5),943-946.
[5] 郑建铃.红色狼尾草的离体培养及产业化生产[J].防护林科技,2013(9):10-23.
[6] 缪珊,范继红.绒毛狼尾草幼穗的愈伤组织诱导与植株再生[J].安徽农业大学学报,2011,38(2):255-258.
[7] 王凭青,段传人,王伯初,周兴龙,谢伟伟.杂交狼尾草不同外植体材料组织培养实验[J].重庆大学学报(自然科学版),2005,28(6):118-120.
[8] 张艺,李达旭,张杰,赵建,杨志荣.披碱草组织培养体系的建立[J].四川大学学报(自然科学版),2008,45(1):205-208.
[9] 刘芳,周翠红,李丽雅,侯文卓,王强,郭蔼光,刘香利.不同遗传背景小麦成熟胚再生体系的初步研究[J].麦类作物学报,2010,30(1):39-42.
[10] 李小雷,于卓,马艳红,谢芳利,李造哲,周亚星.加拿大披碱草×肥披碱草杂种F1幼穗组培再生体系的研究[J].安徽农业科学,2008,36(6):2235-2237.
[11] 张磊,吴殿星,胡繁荣,王海秋,马传喜.结缕草组织培养及农杆菌介导转化的主要因子优化[J].草业学报,2004,13(4):100-105.
[12] 戴云新,张健,李敏,李玉娟.不同外植体和激素对非洲菊愈伤组织诱导及芽分化的影响[J].浙江农业科学,2009(4):695-696.
[13] 周丽丽,王晶,闫俊芳,郑必平,张树初,谈建中.不同外植体对红掌初代培养及愈伤组织诱导的影响[J].安徽农业科学,2012,40(28):13720-13724.
[14] 许来俊,王成章,严学兵,张森浩,李佳.苜蓿植株再生体系研究进展[J].草业科学,2012,29(8):1294-1301.
[15] 韩超,方正.外植体和激素对丽格海棠组培不定芽分化的影响[J].河北农业大学学报,2005,28(3):38-41.
[16] 王铖,李青,辛燕.高羊茅种子愈伤组织诱导及植株再生研究[J].北京林业大学学报,2004,26(1):66-69.
[17] 杨茹,袁庆华,曹致中,王锁民.2,4-D 和6-BA 对黑麦草不同外植体愈伤组织诱导与分化的影响[J].中国草地学报,2008,30(4):34-39.
[18] 张小红,赵雪晶,李波,黎飞飞,闵东红.小麦成熟胚离体培养及植株再生技术优化[J].草业学报,2013,22(4):334-339.
[19] Bhaskaran S,Smith B H.Regeneration in cereal tissue culture:a review[J].Crop Science,1990,30(6):1328-1336.
[20] Bai Y,Qu R.Factors influencing tissue culture responses of mature seeds and i mmature embr yos in turf-type tall rescue[J].Plant Breeding,2001,120(3):230-242.
[21] Mucciarelli M,Gallino M,Scannerini S,Maffei M.Callus induction and plant regeneration of a non-flowering vetiver fr om Java[J].Plant Cell,Tissue and Or gan Culture,2000,62:115-123.
[22] Linacero R,Vazquez A M.So matic embryogenesis fro m i mmature inflorescences of rye[J].Plant Science,1990,72:253-268.
[23] 瞿丽华.植物生长调节物质对组织培养中不定芽不定根的作用[J].辽宁师专学报,2000,2(2):97-99.
