地被菊‘紫妍’和‘纽9722’的再生体系建立
2015-04-08刘晨旭董凤丽周蕴薇
刘晨旭,马 欣,董凤丽,周蕴薇
(东北林业大学园林学院,黑龙江 哈尔滨150040)
地被菊(Chr ysanthemum morifolium)是菊科菊属多年生草本花卉,是菊花的一个新品种群。具有植株低矮、株型紧凑、花色丰富、抗性强等优点。近年来,植物基因工程的发展为加快培养具有优良特性的菊花品种提供了可能,特别是在分子育种方面,可以利用现代分子生物学技术和方法定向修饰菊花的某些目标性状,使其在抗逆性、花色、花期等方面具有更强的优势[1]。利用农杆菌介导法将抗性基因转入到菊花的研究已取得了很大成功[2-4]。但基因转化需要建立良好的植物受体系统,其中外植体的选择以及能产生较高再生能力的培养体系的确立是转化体系建立的关键[5]。目前,菊花的再生体系研究已经普遍展开。通过调节不同的激素种类和浓度配比,利用茎段[6]、叶 片[7-8]、叶 柄[1]、花 瓣[9]、花 蕾[10]等 作 为 外植体,建立起高效、快捷的再生体系已经成为了可能。但由于菊花受基因型影响较大,不同品种之间存在一定差异,所以再生体系一般不具有普遍性。吕 晋 慧 等[11]对 地 被 菊 品 种 ‘紫 妍’(C.morif olium cv.ziyan)进行了叶片不定芽的再生研究,初步研究了‘紫妍’的最适叶片分化培养基。本研究以地被菊‘紫妍’和‘纽9722’(C.morif olium cv.niu 9722)为研究对象,探索叶片愈伤组织的诱导、芽的分化、茎的增殖以及继代生根的最适宜条件,旨在筛选出高效、稳定的再生体系,以期为今后的地被菊转基因研究奠定基础,加快分子育种进程。
1 材料与方法
1.1 供试材料
选择东北林业大学园林学院花卉研究所内地被菊‘紫妍’、‘纽9722’的带腋芽茎段为外植体。
1.2 试验方法
1.2.1 无菌苗的获得及最佳消毒时间的筛选 将采集到的‘紫妍’、‘纽9722’带腋芽茎段去除底部和中部的大叶子,用洗衣粉浸泡5 min后,洗去表面泥土,再在流水下冲泡1~2 h,彻底洗净。放入超净工作台,75%酒精消毒30 s,无菌水冲洗两次后放入配好的2% NaCl O 溶液中分别浸泡2、4、6、8、10 min,期间不停摇晃,使之与茎段充分接触,无菌水彻底冲洗4~5 次,取出后用无菌滤纸吸净表面水分,接入MS培养基上。10 d 后统计死亡率、污染率、萌发率。
1.2.2 叶片愈伤组织的诱导及芽的分化 待植株正常生长后,选择继代20 d左右生长状况良好的植株,将其中部及上部发育状况基本一致的叶片剪下,切成5 mm×5 mm 的叶盘,近轴面接触培养基,接种于MS培养基添加不同浓度6-BA(1.0、1.5、2.0 mg·L-1)和NAA(0.2、0.5、0.8、1.0、1.2、1.5 mg·L-1)中,诱导叶片愈伤组织的形成及芽的分化。每个处理接种30个叶片,3次重复。12 d更换一次培养基,15 d统计愈伤组织诱导率,40 d统计芽的分化率和出芽数。
1.2.3 茎段的增殖 选择继代20 d左右生长状况良好的‘纽9722’无菌苗,切取带两个腋芽的茎段,接入到MS培养基添加不同浓度6-BA(0、1.0、2.0、3.0 mg·L-1)和NAA(0、0.2、0.5、1.0 mg·L-1)中,观察‘纽9722’茎段的增殖情况。每个处理接种20个茎段,3 次重复。12 d更换一次培养基,观察植株生长及增殖情况,30 d统计茎段增殖系数。
1.2.4 继代生根诱导 待分化出的不定芽生长健康后,切取约2 c m 不定芽接入MS培养基添加不同浓度NAA(0、0.1、0.2、0.3、0.4、0.5 mg·L-1)和1/2 MS培养基添加不同浓度NAA(0、0.1、0.2、0.3、0.4、0.5 mg·L-1)中诱导生根。每个处理接种10个不定芽,3次重复,观察根及植株生长情况,20 d时计生根数和生根率。
1.2.5 炼苗和移栽 生根的组培苗约20 d时,选择根系发达且生长健壮的组培苗,将其去膜放置2 d进行炼苗,然后拿出并洗净根部的残余培养基,将其移栽至提前高温灭菌后的土中(土∶蛭石=1∶1),放至适当环境下培养,30 d后统计成活率。
1.3 培养条件
以MS为基本培养基,含蔗糖30 mg·L-1、琼脂7~8 g·L-1,p H 5.8;1/2 MS 培养基中大量元素减半,p H 值不变。121 ℃高压灭菌20 min。培养温度是(25±2)℃,光照强度是2 000 l x,光照时间是12 h·d-1。
1.4 数据分析
参照汪晓沙等[12]的计算方法:
污染率=(污染个数/接种个数)×100%;
萌发率=(萌发个数/存活个数)×100%;
诱导率=(形成愈伤组织的外植体数/接种外植体数)×100%;
再生频率=(再生出不定芽的外植体数/接种外植体数)×100%;
外植体平均再生芽数=外植体再生不定芽总数/接种外植体数;
茎段外植体增殖系数=外植体增殖不定芽总数/接种外植体数;
生根率=(生根幼苗数/接种幼苗数)×100%;
生根系数=生根总数/生根幼苗数。
数据处理采用EXCEL、SPSS 17.0 软件进行ANOVA 显著性分析。
2 结果与分析
2.1 不同消毒时间对外植体消毒及出芽状况的影响
两个品种的污染率均随着消毒时间的增加而减小(表1),表明2%的Na Cl O 溶液对茎段的消毒效果明显。萌发率也随着消毒时间的增加而减小,过高浓度Na Cl O 溶液可能伤害幼嫩茎段,影响其萌发。对于‘紫妍’品种,6 min及以上的消毒时间对污染率的影响差异不显著(P>0.05),而6 min及以内的消毒时间对萌发率影响差异不显著,综合两个因素,6 min是对于品种‘紫妍’最适宜的消毒时间。品种‘纽9722’在8 min时污染率较低,虽然与10 min处理的污染率差异不显著,但萌发率显著高于10 min的处理(P<0.05),所以8 min是最好的消毒时间。
2.2 不同激素浓度对叶片分化的影响
添加不同浓度6-BA 和NAA 的培养基对于地被菊叶片的分化起着较大的作用(表2)。通过试验观察,叶片接触分化培养基7 d左右时,在切口处开始形成嫩绿的愈伤组织。愈伤组织逐渐增大,15 d后出现大量嫩绿色芽点,3~4周芽点开始长成小芽丛,并逐渐增多、长大。选择的激素浓度配比对于两个品种均能诱导出愈伤组织,诱导率均为100%。品种‘紫妍’总体分化率较高,6-BA 浓度不变时,1.0 mg·L-1的NAA 最能促进分化,且出芽数较高,过低和过高的NAA 都会使分化率下降;当6-BA 浓度为1.5和2.0 mg·L-1时,1.0 mg·L-1NAA 下,分化率都很高,显著高于其他浓度(P<0.05)且二者差异不显著(P>0.05),但6-BA 为2.0 mg·L-1时的出芽数显著高于1.5 mg·L-1时的出芽数(P<0.05),所以品种‘紫妍’的最适叶片分化培养基是MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1。品种‘纽9722’的最高分化率出现在MS+6-BA 2.0 mg·L-1+NAA 0.5 mg·L-1时,但仅为45.59%。

表1 不同消毒时间对两个地被菊品种外植体污染和萌发的影响Table 1 Effects of sterilization ti me on explants’contamination and ger mination efficiency of t wo C.morif olium cultivars
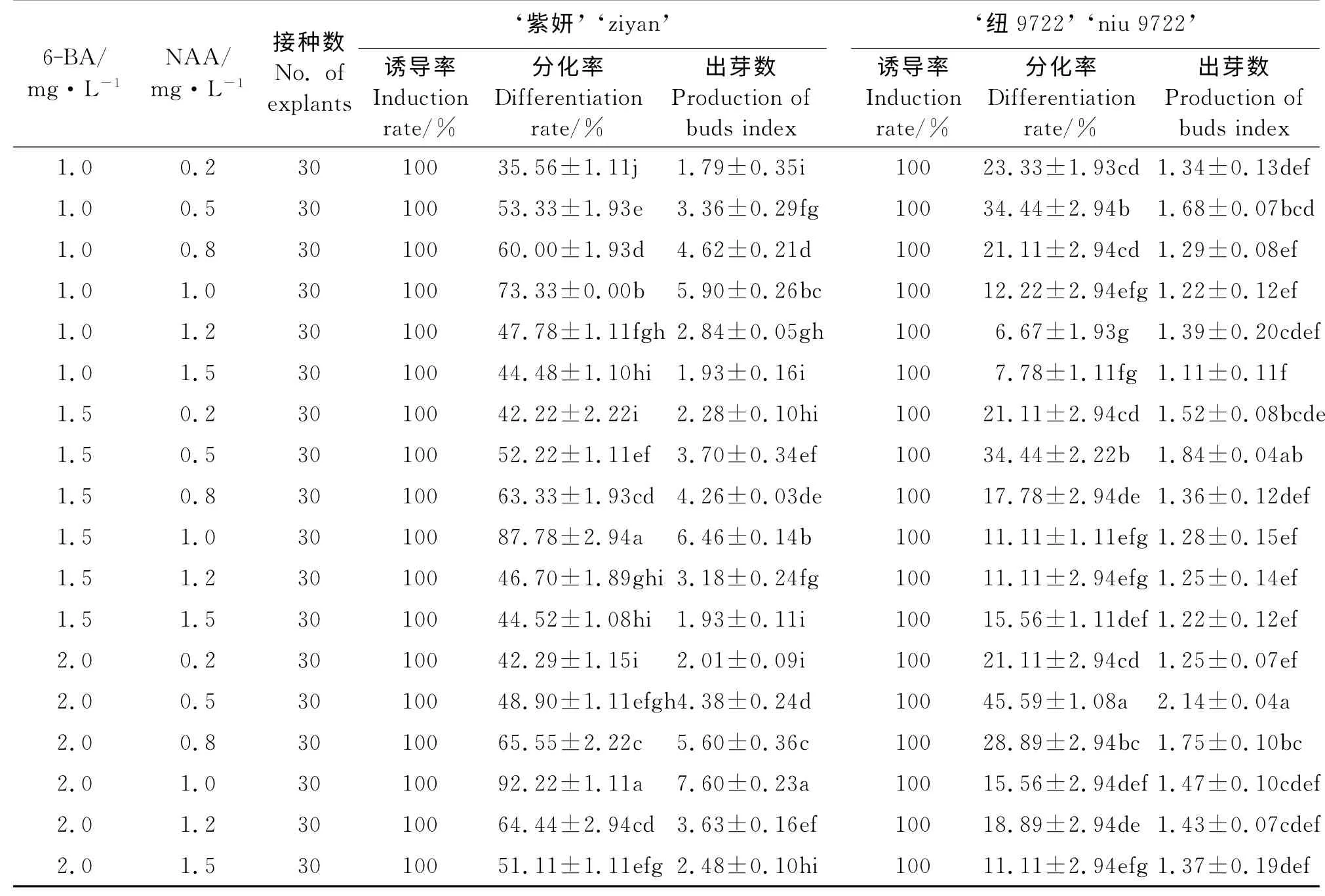
表2 不同浓度的6-BA和NAA对两个地被菊品种叶片分化的影响Table 2 Effects of 6-BA and NAA on the differentiation capability of leaf blades of t wo C.morif olium cultivars

表3 不同6-BA和NAA浓度对‘纽9722’茎段增殖的影响Table 3 Effects of 6-BA and NAA on the proliferation of stem segments of C.morif olium ‘niu 9722’
2.3 不同激素浓度对‘纽9722’茎段增殖的影响
接种3 d时,茎段伤口处膨大,10 d时茎段腋芽处开始有丛生芽萌发,且丛生芽生长很快。总体而言,品种‘纽9722’的茎段增殖状况良好(表3),当6-BA 2.0 mg·L-1且NAA 0.5 mg·L-1时,增殖数最高,达到了10.05,与其他浓度处理相比差异显著(P<0.05),且生长状况良好,是其茎段增殖的最适培养基。
2.4 不同培养基对生根的影响
生根培养7 d时,基部开始生根,14 d后大量生根,生根率均为100%。在两种基本培养基中,随着添加NAA 浓度的增加,两个品种的生根系数均先增加后减少(表4、表5)。品种‘紫妍’在添加0.2 mg·L-1的NAA 的两种基本培养基中生根系数都很高,分别为13.53(MS)和15.50(1/2 MS),且根系多、粗、密集,但后者显著高于前者(P<0.05);品种‘纽9722’在添加0.3 mg·L-1NAA 的1/2 MS培养基中生根系数达到最高,为14.87,显著高于其他处理(P <0.05),根系多、粗、密集。所以,品种‘紫妍’的最适生根培养基为1/2 MS+NAA 0.2 mg·L-1;品种‘纽9722’的最适生根培养基为1/2MS+NAA 0.3 mg·L-1。

表4 基本培养基添加不同浓度NAA对两个地被菊品种生根的影响Table 4 Effects of NAA in basic mediu m on rooting of t wo C.morif olium cultivars
经过炼苗和移栽30 d 后,品种‘紫妍’、‘纽9722’成活率均为100%,且长势良好(图1、图2)。两个品种经过脱毒、叶片分化、茎段增殖、生根移栽过程,建立起完整的再生体系。
3 讨论与结论
菊花品种的外植体选择种类较多,多数研究以叶片和茎段为外植体,获得了再生率较高的再生体系。相比而言,利用茎段为外植体获取较为方便,且受强消毒剂影响程度较小,与叶片相比,茎段诱导无菌苗更快捷,周期更短。大量研究证明,0.1%升汞具有良好的消毒效果[13],但升汞对环境有一定的污染,用后必须回收处理,本研究采用2% Na Cl O 溶液进行外植体脱毒,效果良好,和马欣等[14]的研究结果基本符合,并且环保无污染。‘紫妍’、‘纽9722’茎段脱毒的最适时间分别是6、8 min,不同的品种基因型存在差异,植物体本身对于消毒剂的抗性也不同,叶片的薄厚、茎段的粗细也有可能是造成最适消毒时间差异的原因。
在诱导叶片分化不定芽时,以往多数研究表明[10,12],6-BA 和NAA 的组合对诱导愈伤组织效果明显。本研究中,品种‘紫妍’的叶片最适分化培养基 为 MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1,最高分化率为92.22%,出芽数为7.60。吕晋慧等[11]的研究也表明品种‘紫妍’在这一激素配比下的分化率最高,为93%,出芽数为12.4;‘紫妍’在 MS+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1时分化率也很高,本研究与之存在差异,可能是试验季节、试验环境条件的不同引起的。通过观察发现,当6-BA 浓 度 一 定,NAA 浓 度 较 低(0.2 mg·L-1)时,愈伤组织虽然出芽率不高,但较为致密、紧实(图3 A)。而NAA 浓度在0.5 mg·L-1时,愈伤组织容易成疏松水渍状,不定芽也容易玻璃化(图3B)。原因可能是低浓度NAA 有利于促进愈伤组织的形成。而对于品种‘纽9722’,叶片最高分化率仅为45.59%,没有成功建立稳定的再生体系,通过观察发现愈伤组织体积较大,但出芽率过低,而且褐化情况较严重(图3C),这一问题还需进一步研究解决。

图1 ‘紫妍’再生体系建立的过程Fig.1 The establishment process of‘ziyan’regeneration system
王丽华等[15]研究发现,过高的6-BA 浓度和过低的NAA 浓度会使植株的长势变弱;但吴月亮等[1]的研究表明,6-BA浓度与NAA浓度之比大于10时,增殖效果最好。本研究表明,‘纽9722’的最适茎段增殖培养 基 是MS+6-BA 2.0 mg·L-1+NAA 0.5 mg·L-1,增殖后的无菌苗生长良好,增殖系数为10.05,高于之前一些品种的增殖研究,表明不同品种同在最适增殖培养基下,增殖系数有差异。

图2 ‘纽9722’再生体系建立的过程Fig.2 The establishment process of‘niu 9722’regeneration system
地被菊较容易生根,多而粗壮的根系有利于植株的移栽成活,使得建立起来的再生体系更加完整。MS培养基是用来继代无菌苗的常用培养基,既能使幼苗地下部分生根,又能使地上部分健壮生长。但一般生根培养基为1/2 MS和1/2 MS添加低浓度NAA 或IBA。品种‘早小菊’的最适生根培养基为1/2 MS+IBA 3.0 mg·L-1[10],1/2 MS+NAA 0.1 mg·L-1最适宜品种‘神马’和‘绿鹦哥’生根[16-17]。可 见,IBA 和NAA 对 于 不 同 品 种 的 生 根有着不同的影响,主要与基因型有关。有的研究表明,少量活性炭的添加能够促进生根,如品种‘日本红’的最适生根培养基为1/2 MS+NAA 0.8 mg·L-1+活性炭1.0 g·L-1[18]。本研究表明,品种‘紫妍’最适生根培养基是1/2 MS+NAA 0.2 mg·L-1,生根系数为15.50;品种‘纽9722’最适生根培养基是1/2 MS+NAA 0.3 mg·L-1,生根系数为14.87,与大多数研究基本一致。在试验过程中发现,高浓度的NAA 会促进根的增粗,但同时影响了根的增多和伸长,当NAA 浓度大于0.4 mg·L-1时,能明显观察到无菌苗根部切口处褐化、粗大,抑制了根的生长,导致根发生畸形,同时观察到地上部分生长缓慢,可能的原因是过高的NAA使根部褐化,抑制了营养从根部向上的运输。

图3 NAA处理的‘紫妍’和‘纽9722’的愈伤组织形态Fig.3 The callus mor phological of‘niu 9722’and‘ziyan’treated with NAA
[1] 吴月亮,蒋细旺,孙磊,张启祥.菊花2个品种高效再生体系的建立[J].西南林学院学报,2007,27(2):50-52.
[2] 蒋细旺,包满珠,吴家和,张献龙,田颖川.农杆菌介导Cr y 1Ac 基因转化菊花[J].园艺学报,2005,32(1):65-69.
[3] 洪波,张长青,李邱华,Kasuga M,Shinozaki-Ya maguchi K.根癌农杆菌介导的转录因子DREB1A 基因在地被菊花中的遗传转化[J].农业生物技术学报,2005,13(3):304-309.
[4] 崔新利,陈发棣,陈素梅.地被菊雨花勋章再生和遗传转化体系的建立[J].南京农业大学学报,2009,32(2):40-46.
[5] 高亦珂,赵勃,丁国勋,张启祥.菊花茎叶外植体再生体系的研究[J].北京林业大学学报,2001,23(1):32-33.
[6] 蒋细旺,刘国峰,包满珠.菊花9 个品种叶片和茎段快速高效再生体系的建立[J].华中农业大学学报,2003,22(2):162-166.
[7] Yepes L M,Mittak V,Pang S Z,Gonsalves C,Slightom J L,Gonsalves D.Biolistic transf or mation of Chr ysanthemum with t he nucleocapsid gene of to mato spotted wilt vir us[J].Plant Cell Reports,1995,14:694-698.
[8] Urban L A,Sher man J M,Moyer J W,Daub M E.High frequency shoot regeneration and Agrobacterium-mediated transf or mation of Chr ysanthemu m(Dendr anthema gr andiflor a)[J].Plant Science,1994,98:69-79.
[9] 孙淑斌,徐文君,衣艳君,刘兆普.地被菊的再生与转化系统的建立[J].植物生理学通讯,2006,2(6):1032-1036.
[10] 张瑞麟,范敏.地被菊的组织培养及快速繁殖[J].植物生理学通讯,2001,37(6):531.
[11] 吕晋慧,吴月亮,孙磊,高亦珂,张启祥.菊花叶片不定芽再生体系的研究[J].北京林业大学学报,2005,27(4):97-100.
[12] 汪晓沙,曾丽,彭勇政,西村润,林登贵.不同菊花品种的组培扩繁技术[J].上海交通大学学报,2013,31(2):20-22.
[13] 李辛雷,陈发棣,王红,房伟民,管志勇.菊花外植体再生体系的研究[J].上海农业学报,2004,20(2):13-16.
[14] 马欣,董凤丽,刘杰,刘晨旭,周蕴薇.地被菊‘雪公主’的组织培养和快速繁殖[J].草业科学,2013,30(8):1194-1199.
[15] 王丽华,王永清,陈文德,彭培好.菊花组织培养技术体系研究[J].安徽农业科学,2005,33(8):1416-1417.
[16] 邱美欢,曲军远,覃和业,余雪标.‘神马’菊组织培养技术研究[J].热带农业科学,2008,28(1):30-33.
[17] 周洲,李永丽,姜玲,王沛,尹新明.菊花‘绿鹦哥’的组织培养和快速繁殖[J].北方园艺,2009(10):110-112.
[18] 王仁睿,李明福,李桂芬,马洁,韩林波.菊花品种‘日本红’的脱毒和组织培养[J].植物生理学通讯,2009,45(8):797-798.
