膝关节骨性关节炎氧化应激指标的临床分期检测及分析
2015-04-06杨声波王聪黄绍南毛瑜坤许子星李贵双陈鹏
杨声波 王聪 黄绍南 毛瑜坤 许子星 李贵双 陈鹏
作者单位: 362261福建省晋江市安海医院骨科(杨声波、王聪、黄绍南、毛瑜坤);福建医科大学附属第一医院骨科(许子星、李贵双、陈鹏)
膝关节骨性关节炎氧化应激指标的临床分期检测及分析
杨声波王聪黄绍南毛瑜坤许子星李贵双陈鹏
作者单位: 362261福建省晋江市安海医院骨科(杨声波、王聪、黄绍南、毛瑜坤);福建医科大学附属第一医院骨科(许子星、李贵双、陈鹏)
【摘要】目的检测不同临床分期膝关节骨性关节炎(OA)患者血清及关节液氧化应激指标水平,分析其临床应用价值。方法2011年7月至2013年6月,收集符合美国风湿病学会OA诊断标准(ACR2007)的患者49例(观察组),临床分期为Ⅰ期者10例,Ⅱ期15例,Ⅲ期13例,Ⅳ期11例。以同时期健康体检志愿者16例(无OA病史、X线检查排除OA诊断)作为对照(对照组),2组均抽取空腹静脉血和膝关节液。WST-1法测定过氧化物歧化酶(SOD)活性,化学法测总抗氧化能力(T-AOC)、丙二醛(MDA)和谷胱甘肽(GSH)水平,统计并分析各指标的波动。结果与对照组相比,观察组血清与关节液T-AOC,MDA均显著增高(P<0.01),SOD,GSH显著降低(P<0.01)。与对照组相比,观察组Ⅰ期OA患者血清及关节液T-AOC水平即显著升高,Ⅱ期两者均进一步升高,Ⅲ期与Ⅳ期之间差异无统计学意义(P>0.05),但均较Ⅱ期高。观察组血清MDA水平显著升高(P<0.01),各分期之间MDA差异无统计学意义(P>0.05);而关节液中,Ⅱ期OA患者较I期MDA水平显著升高,Ⅲ、Ⅳ期MDA水平进一步升高,而2期之间差异无统计学意义(P>0.05)。观察组OA患者血清SOD活力均明显降低(P<0.01),4期间SOD活力水平差异无统计学意义(P>0.05);而关节液中,Ⅰ~Ⅳ期SOD水平逐渐下降,Ⅰ期患者SOD水平较对照组即明显下降(P<0.01),Ⅱ期较Ⅰ期进一步下降,Ⅲ、Ⅳ期之间SOD水平差异无统计学意义(P>0.05),但均较Ⅱ期低(P<0.01)。对照组与观察组各分期血清GSH水平差异均无统计学意义(P>0.05);而关节液中,观察组Ⅰ期OA患者GSH水平较对照组升高(P<0.05),至Ⅱ期GSH水平达到顶点(P<0.05),Ⅲ、Ⅳ期GSH水平下降,均低于对照组(P<0.05)。结论不同临床分期OA患者血清及关节液氧化应激指标水平不同;关节液及血清氧化应激指标T-AOC、MDA、SOD和GSH可作为评估OA患者病情,判断预后的依据。
【关键词】膝关节;骨性关节炎;氧化应激;关节炎分期
项目来源:晋江市技术研究与开发项目(编号: 2011Z99)
膝关节骨性关节炎(osteoarthritis,OA)是最常见慢性疾病之一,主要表现为患者关节疼痛,运动功能缺失,其主要病理特点为软骨细胞修复不良和关节结构的破坏。研究证实,软骨细胞退行改变是由于机械损伤与生物化学因子共同作用的结果,生物化学因子活性氧簇(reactive oxygen species,ROS)在骨关节炎的发生发展中起了重要作用。我们通过检测及分析2011 年7月至2013年6月,49例不同临床分期的膝关节OA患者血清及关节液中脂质过氧化产物丙二醛(MDA),及抗氧化系统中总抗氧化能力T-AOC、氧化物歧化酶(SOD)和谷胱甘肽(GSH)的水平变化,评估氧化应激指标在临床膝关节OA诊治中的意义。
1 资料与方法
1.1一般资料2011年7月至2013年6月,收集安海医院和福建医科大学第一医院诊治的膝关节OA患者49例(观察组),所有患者均满足美国风湿病学会膝关节OA的诊断标准(ACR1995)[8],依据临床症状、体征及影像学表现分为四期。Ⅰ期:关节炎的发生前期,关节在活动后稍有不适,活动增加后伴有关节的疼痛及肿胀,在X线及CT检查上看不到明显软骨损害迹象。Ⅱ期:关节炎改变的早期,活动多后有明显的疼痛,休息后减轻,X线观察,改变较少,只有CT可见软骨轻度损害,同位素检查,被损关节可见凝聚现象。Ⅲ期:骨性关节炎的进展期,骨软骨进一步损害,造成关节畸形,功能部分丧失,X线可见关节间隙变窄,关节周围骨的囊性变,有时有游离体出现。Ⅳ期:骨关节炎的晚期,骨的增生、软骨的剥脱以及导致功能完全丧失,关节畸形明显,X线示关节间隙变窄,增生严重,关节变得粗大,甚至造成骨的塌陷。49例患者中,男24例,女41例;年龄47~85岁,平均年龄64岁;病程8~36个月,平均病程17.3个月;临床分期为Ⅰ期者10例,Ⅱ期15例,Ⅲ期13例,Ⅳ期11例。排除标准:凡有以下情形之一的患者均不予纳入本次观察: (1)有严重的心、肝、肾、肺等器官疾患; (2)恶性肿瘤患者; (3)诊断有炎性关节炎、痛风、骨结核、骨髓炎或急性膝关节创伤及血管神经损伤患者; (4)继发性膝骨性关节炎患者; (5)孕妇或哺乳期女性; (6)精神疾病患者。所有患者对实验方案均知情同意,且得到医院伦理道德委员会批准。另选择同时期我院16例健康体检志愿者作为对照组,其中男7例,女9例;平均年龄61岁,均无膝痛病史,X线片排除膝关节病变。
1.2主要试剂和仪器-80℃超低温冰箱(海尔),超速低温离心机(Allegra TM64R,Beckman),低速离心机(TDL-50C,上海安亭科学仪器厂),水浴恒温器仪(HHS,上海医疗器械五厂),752S分光光度仪(上海医疗器械六厂),移液器(Appendorf公司); T-AOC、MDA、SOD和GSH检测试剂盒均由南京建成公司提供,试剂盒变异系数<15%。
1.3检测方法血清标本的采集与保存:所有受检者均在安静状态下,清晨空腹抽取静脉血5 ml。在采集后2 h内,3 500 r/min,离心10 min,取上清液置于EP管中,-80℃冰箱保存待测。关节液标本的采集与保存:取髌下外侧入路行膝关节穿刺,首先注射0.9%氯化钠溶液5 ml,关节屈伸活动1 min后回抽2~3 ml于离心管中,3 500 r/min,离心10 min,取上清液置于EP管中,-80℃低温冰箱保存待测。WST-1法测定SOD活性,化学法测T-AOC、MDA和GSH水平。所有检测均按照检测试剂盒说明书进行。
1.4统计学分析应用SPSS 16.0统计软件,计量资料以±s表示,多组间的比较采用单因素方差分析(One-Way ANOVA),2组比较采用独立样本t检验,P <0.05为差异有统计学意义。
2 结果
2.1一般资料观察组与对照组之间年龄、性别构成差异无统计学意义(P>0.05);体重指数观察组明显大于对照组(P<0.01);与对照组相比,观察组血清与关节液T-AOC,MDA均显著增高(P<0.01),SOD、GSH显著降低(P<0.01)。见表1、2。

表1 2组基本临床资料比较
表2 OA患者血清及关节液T-AOC、MDA与SOD、GSH变化±s

表2 OA患者血清及关节液T-AOC、MDA与SOD、GSH变化±s
注:与对照组比较,*P<0.01
血清 关节液T-AOC 10.4±1.2 11.6±2.2 33.9±14.2* 40.0±16.6变量 对照组(n =16)OA组(n =49)血清 关节液* MDA(nmol/ml) 4.2±0.6 6.0±0.5 16.8±5.3* 11.6±4.5* SOD(U/ml) 125±13 176±21 67±8* 100±7* GSH(mg/ml)1 650±173 552±72 1 725±156 409±28
2.2血清及关节液T-AOC水平变化与对照组相比,观察组Ⅰ期OA患者血清及关节液T-AOC水平即显著升高,Ⅱ期两者均进一步升高,Ⅲ期与Ⅳ期之间差异无统计学意义(P>0.05),但均较Ⅱ期高。见图1、表3。
表3 5组血清和关节液观察指标比较±s

表3 5组血清和关节液观察指标比较±s
注:与正常对照比较,*P<0.05,#P<0.01;与Ⅰ期比较,△P<0.05,与Ⅱ期比较,☆P<0.05
血清 关节液正常对照(n =16) 10.4±1.2 11.6±2.2 4.2±0.6 6.0±0.5 125±13 17组别(分期) T-AOC(μmol/ml)MDA(nmol/ml)SOD(U/ml)GSH(mg/ml)血清 关节液 血清 关节液 血清 关节液6±21 1 650±173 552±72Ⅰ期(n =10) 18.6±4.2* 25.1±4.1* 16.4±0.7# 6.2±0.9 75±10# 126±15# 1 725±156 653±103Ⅱ期(n =15) 30.2±5.1#△ 31.6±6.4#△ 15.6±1.3# 7.6±0.8* 74±11# 105±14# 1 683±165 715±99*Ⅲ期(n =13) 34.3±6.2#△ 40.3±6.2#△ 16.6±3.0# 13.5±2.2#△ 68±14# 88±10#△ 1 542±144 482±84*☆Ⅳ期(n =11) 33.3±7.1#△ 41.1±7.4#△ 17.2±3.2# 12.6±2.4#△ 63±9# 95±11# 1 605±172 325±51☆
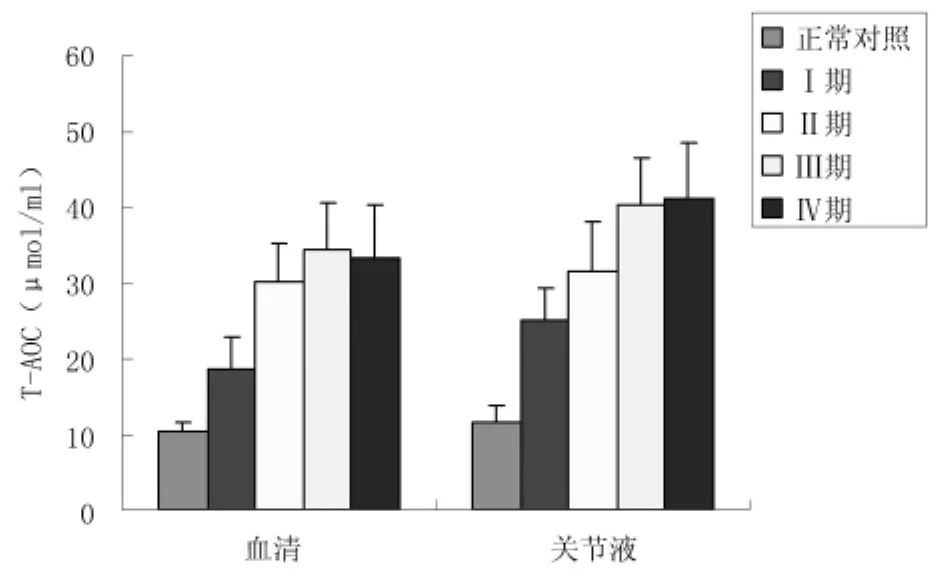
图1 不同临床分期OA患者血清及关节液T-AOC水平变化
2.3血清及关节液MDA水平变化与对照组相比,观察组血清MDA水平升高(P<0.01),各分期之间MDA差异无显著统计学意义(P>0.05);而关节液中,观察组MDA水平与临床分期显著相关,Ⅱ期OA患者较Ⅰ期MDA水平显著升高,Ⅲ、Ⅳ期MDA水平进一步升高,而两期之间差异无统计学意义(P>0.05)。见图2、表3。

图2 不同临床分期OA患者血清及关节液MDA水平比较
2.4血清及关节液SOD水平变化与对照组相比,观察组OA患者血清SOD活力均明显降低(P<0.01),各期间SOD活力水平差异无统计学意义(P>0.05);而关节液中,OA患者SOD水平与临床分期显著相关,Ⅰ~Ⅳ期SOD水平逐渐下降,Ⅰ期患者SOD水平较对照组即明显下降(P<0.01),Ⅱ期较Ⅰ期进一步下降,Ⅲ、Ⅳ期之间SOD水平差异无显著的统计学意义(P>0.05),但均较Ⅱ期低(P<0.01)。见图3、表3。
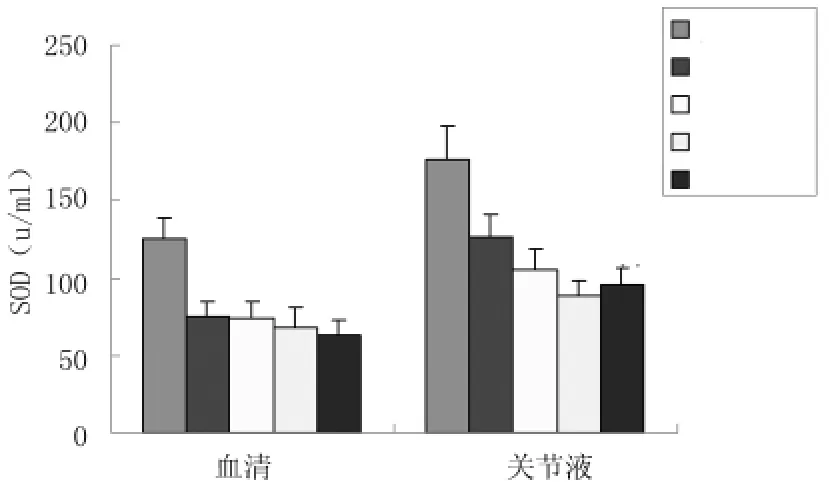
图3 不同临床分期OA患者血清及关节液SOD活力比较
2.5血清及关节液GSH水平变化对照组与观察组各分期血清GSH水平差异均无显著的统计学意义(P >0.05);而关节液中,观察组Ⅰ期OA患者GSH水平较对照组升高(P<0.05),至Ⅱ期GSH水平达到顶点(P<0.05),Ⅲ、Ⅳ期GSH水平下降,均低于对照组(P<0.05)。见图4、表3。
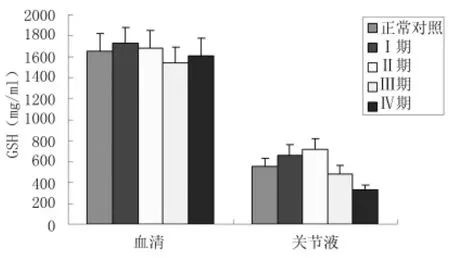
图4 不同临床分期OA患者血清及关节液SOD活力比较
3 讨论
ROS包括超氧化物,过氧化氢,羟自由基及其代谢活性产物,过量ROS可介导细胞损伤,并参与细胞脂质及蛋白氧化,DNA变性[1]; ROS参与OA的病理生理过程[2,3]。有研究报道,OA患者血清与关节液中ROS水平显著增加,软骨细胞脂质氧化增强,OA患者后期关节软骨细胞分泌与修复功能呈进行性退变;大量ROS主要攻击的靶点为细胞膜不饱和脂肪酸脂质氧化,促使细胞结构与功能改变,并进一步导致过氧化物沉积[4]; MDA作为脂质氧化的重要产物,已广泛应用并反映ROS脂质氧化水平,有报道证实在OA患者血清及关节液中ROS脂质氧化异常[5]; SOD是对抗ROS的第一道防线,将ROS超氧阴离子歧化反应成过氧化氢机体可减轻关节软骨的氧化损伤[6]; GSH系统是抗氧化的重要组成,GSH通过酶性或非酶性的机制破坏ROS和其他自由基,降低ROS水平,其系统包括谷胱甘肽过氧化酶,谷胱甘肽转移酶及谷胱甘肽[6]。Mccord等[7]认为在OA患者中抗氧化防御系统失常是导致关节氧化病理损伤重要因素,因而检测患者血液和关节液氧自由基及抗氧化应激指标变化可间接判断OA患者软骨病变程度、预后以及对疗效进行合理评价。
过度的氧化应激(oxidative stress)可促进炎症、诱导细胞凋亡及破坏免疫耐受从而在自身免疫病的发展中起重要作用。多个研究者报道,OA中ROS水平的增高可能导致过氧化脂质(LPO)反应,软骨细胞脂质氧化增强,使LPO过氧化,MDA水平升高。本研究中的OA患者血清及关节液MDA水平均显著升高;同时我们也观察到,OA患者血清与关节液T-AOC均高于正常组,表明MDA与ROS总氧化水平有关。Maneesh等[8]也观察到OA病人的血清MDA水平与T-AOC高于正常人群。因此,这些发现是OA中氧自由基产生关节软骨细胞损伤的可能证据。本研究又观察到在不同OA临床分期关节液T-AOC,MDA水平与临床分期有直接的关系,即OA患者后期,T-AOC,MDA水平越高。因此,该指标可用于临床估计OA病情进展或判定预后。但血清MDA无明显变化,表明关节液MDA及氧化水平更能反映OA患者病情。本研究中的OA患者SOD活性显著低于正常组。Karatas等[9]报道也证实抗氧化酶SOD活性在OA患者中显著低于正常人群,认为OA病人中SOD活性的降低可能与过量氧自由基有关。同样,Kalpakcioglu等[10]证实过量的过氧化氢抑制SOD活性,而在OA患者总氧化能力增强会导致过氧化氢过度积累最终抑制SOD活性; Ostalowska等[11]报道,在原发性和继发性膝OA患者的滑膜液中发现SOD活性增高;与此相反,Scott等[12]发现在OA关节中的滑膜液SOD没有活性;这种不一致的原因可能与OA患者关节病变程度有关。在我们结果中也发现这一现象,关节液SOD活性与OA病情有明显相关性。Pinto等[13]的研究表明,GSH在OA患者中没有显著的改变,而Scott等[12]发现OA患者关节液中的GSH水平增加。这种不一致的原因可能与对象来源不同有关。本结果显示,与对照组相比,观察组OA患者血清GSH水平无明显降低(P>0.05),而关节液中显著降低(P<0.05)。进一步分析发现,血清GSH水平在不同分期患者中均无差别。而在关节液中,OA发病早期GSH水平呈反应性增加,发病后期明显下降,这种现象从侧面上反映了不同临床分期OA患者之间,关节液中GSH水平存在差异。该结果可能解释了上述研究结果存在不同结论的现象。
总之,我们的研究揭示了不同临床分期OA患者血清及关节液中氧化应激指标的波动水平,这些指标的波动现象可作为临床评估OA病情、判断预后的依据。我们正进一步探索氧化应激指标作为判定关节置换指征及评估置换时机的可行性。
参考文献
1 Kotani K,Sakane N,Kamimoto M,et al.Levels of reactive oxygen metabolites in patients with knee osteoarthritis.Australas J Ageing,2011,30: 231-233.
2 Henrotin Y,Kurz B,Aigner T.Oxygen and reactive oxygen species in cartilage degradation: friends or foes? Osteoarthritis and Cartilage,2005,13: 643-654.
3 Salvemini D,Little J W,Doyle T,et al.Roles of reactive oxygen and nitrogen species in pain.Free Radical Biology and Medicine,2011,51: 951-966.
4 Lipinska J,Lipinska S,Stanczyk J,et al.Reactive oxygen species and serum antioxidant defense in juvenile idiopathic arthritis.Clin Rheumatol,2014.
5 Suantawee T,Tantavisut S,Adisakwattana S,et al.Oxidative stress,vitamin e,and antioxidant capacity in knee osteoarthritis.J Clin Diagn Res,2013,7: 1855-1859.
6 Regan EA,Bowler RP,Crapo JD.Joint fluid antioxidants are decreased in osteoarthritic joints compared to joints with macroscopically intact cartilage and subacute injury.Osteoarthritis Cartilage,2008,16: 515-521.
7 Mccord JM,Edeas MA.SOD,oxidative stress and human pathologies: a brief history and a future vision.Biomed Pharmacother,2005,59: 139-142.
8 Maneesh M,Jayalekshmi H,Suma T,et al.Evidence for oxidative stress in osteoarthritis.Indian J Clin Biochem,2005,20: 129-130.
9 Karatas F,Ozates I,Canatan H,et al.Antioxidant status&lipid peroxidation in patients with rheumatoid arthritis.Indian J Med Res,2003,118: 178-181.
10 Kalpakcioglu B,Senel K.The interrelation of glutathione reductase,catalase,glutathione peroxidase,superoxide dismutase,and glucose-6-phosphate in the pathogenesis of rheumatoid arthritis.Clin Rheumatol,2008,27: 141-145.
11 Ostalowska A,Birkner E,Wiecha M,et al.Lipid peroxidation and antioxidant enzymes in synovial fluid of patients with primary and secondary osteoarthritis of the knee joint.Osteoarthritis Cartilage,2006,14: 139-145.
12 Scott JL,Gabrielides C,Davidson RK,et al.Superoxide dismutase downregulation in osteoarthritis progression and end-stage disease.Ann Rheum Dis,2010,69: 1502-1510.
13 Pinto S,Rao AV,Rao A.Lipid peroxidation,erythrocyte antioxidants and plasma antioxidants in osteoarthritis before and after homeopathic treatment.Homeopathy,2008,97: 185-189.
(收稿日期:2014-10-13)
doi:10.3969/j.issn.1002-7386.2015.06.013
【文章编号】1002-7386(2015)06-0845-04
【文献标识码】A
【中图分类号】R 684.3
