紫茎泽兰多糖诱导烟草对烟草花叶病毒的抗性1)
2015-04-03厚凌宇田兆丰谢响明
厚凌宇 田兆丰 谢响明
(北京林业大学,北京,100083) (北京市农林科学院植物保护环境保护研究所) (北京林业大学)
紫茎泽兰(Eupatorium adenophrum)是一种严重危害环境的世界性恶性杂草。约在20 世纪40 年代传入我国,是国家环保局公布的我国首批16 种外来入侵性有害生物之一,其入侵性位居前列[1]。由于该外来入侵生物的抗逆性强,其体内含有多种生物活性物质;因此,利用其活性物质开发生物农药,既可以变废为宝,还可以减少环境污染,具有重大的社会、生态及经济效益[2]。
烟草花叶病毒(Tobacco mosaic virus,TMV)引起的烟草花叶病,是影响烟草生产的首要病害,染病烟草烟叶质量等级和产量下降严重。在我国南方烟草种植地区,田间发病率一般可达5%~20%,早期发病的损失可达50%~70%,甚至失收[3]。化学药剂,是目前防治烟草花叶病毒病的一种重要的措施,但化学药剂的滥用会造成环境污染以及严重影响产品安全。因此,筛选、研制对人畜安全,并且环境友好的生物农药,已成为当今社会人们关注的焦点。
植物拥有极其复杂的防御机制,以抵抗病原体侵害。在几分钟内病原体就会被寄主引发的一系列反应所识别,比如,离子流跨过细胞质膜、pH 的改变、细胞质膜的去极化、活性氧的产生[4-5]。在几小时之内,这些变化之后就会诱导寄主组织产生水杨酸、茉莉酸等次级代谢产物,与防御相关的基因会被激活且伴随着细胞壁的僵化,植物合成抗毒素并且可以激活病程相关蛋白[6-7]。病程相关基因的激活,可以诱导植物产生广谱抗性,保护植物没有被病害侵染的部位免受侵害[8]。这种抗性反应,同样可被一类称为激发子的物质所诱导[9]。
紫茎泽兰多糖(EAP),是本研究从紫茎泽兰叶中分离得到的一种植物多糖。经前期探究表明,紫茎泽兰总提取物具有对多种病原真菌的抑制作用[2]。该糖具有潜在的激发子活性,可诱导植物提高对烟草花叶病毒的抗性。本研究利用半叶枯斑法,确定了EPA 对TMV 侵染烟草叶片的预防作用,分析了紫茎泽兰多糖提高烟草抗TMV 的机理,旨在为开发安全、高效的抗植物病原病毒制剂提供参考。
1 材料和方法
1.1 材料
供试植物:试验用紫茎泽兰(Eupatorium adenophrum)样品采自云南省,由中国农业科学院植物保护研究所提供。鲜叶阴干处理后,60 ℃烘干至恒质量;粉碎机粉碎后过40 目筛,得到的粉末于4 ℃密封保存备用。
供试毒源:烟草花叶病毒(Tobacco mosaic virus,TMV),由北京市农林科学院植物保护研究所提供。称取1 g 感病叶片,加10 倍量0.01 mol·L-1磷酸缓冲液(pH=7.0),充分研磨,离心后取上清作为接种液。
供试寄主植物:三生烟(Nicotiana tabacum cv.Samsun NN)栽种于温室中,于25 ℃光照培养16 h;然后于16 ℃黑培养暗8 h;待幼苗长至8 叶期时(第七叶完全展开),选取生长一致的烟草进行试验。
1.2 主要试剂与仪器
试验仪器,主要包括UNIC UV-2102C 分光光度计、ABI 7500s 型荧光定量PCR 仪、SIGMA 3-30K高速冷冻离心机等。
半乳糖、葡萄糖、甘露糖、木糖、果糖,均为Sigma进口分装(分析纯);总RNA 提取TRIzol 试剂,为美国Invitogen 公司产品;合成第一链cDNA 反转录试剂盒、SYBR Green Super Mix,购自北京全式金公司。用于荧光定量检测引物,由北京奥科鼎盛生物科技有限公司合成。其他生化试剂均为国产分析纯。
1.3 紫茎泽兰多糖的制备
取紫茎泽兰水提取液200 mL,利用Sevage 法除蛋白3 次;上清液用2 mol·L-1氢氧化钠调至pH=7;加热回流用1%活性炭脱色;抽滤,滤液扎袋,流水透析48 h。透析液离心(3 000 r/min)10 min;上清于80 ℃水浴浓缩至原体积的1/3,然后加入3 倍体积的95%乙醇;搅拌均匀后,3 000 r/min 离心15 min;沉淀用无水乙醇洗涤2 次,乙醚洗涤1 次,真空干燥得到多糖粗品。
将上述粗品称量后,用其质量体积比为100 倍体积的热水复溶;离心去除不溶物后,加2%CTAB,至沉淀完全溶解;搅匀,静置4 h,于4 000 r/min 离心10 min,去清液。沉淀用热水洗3 次,收集沉淀并称质量。称量后的沉淀用其质量体积比为100 倍体积的2 mol·L-1NaCl 于60 ℃水浴解离4 h,解离后离心装袋透析,12 h 后放出透析液,于80 ℃浓缩后,加3 倍体积的95%乙醇,静置4 ~6 h,离心收集沉淀;沉淀用无水乙醇洗涤2 次,乙醚洗涤1 次。沉淀干燥存放[10]。
1.4 紫茎泽兰多糖的鉴定及总糖量测定
利用Molisch 反应(α-萘酚反应)鉴定紫茎泽兰多糖。糖类在浓酸作用下所形成的糠醛及其衍生物可以与α-萘酚作用,形成红紫色复合物。由于在糖溶液与浓硫酸两液面间出现红紫色的环,因此又称紫环反应。
紫茎泽兰多糖溶液1.0 mL 加入蒸馏水1.0 mL,再加苯酚试液1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL,摇匀后放置5 min,置沸水浴中加热15 min,取出后冷却至室温。先显示紫环,煮沸后显紫红色。
精密量取1 g·L-1的葡萄糖对照品溶液0.05、0.25、0.75、1.00、1.25 mL,分别置于10 mL 具塞试管中,加水稀释至10 mL。准确加入5%的苯酚溶液1 mL,混匀,冰水浴;再精密加入浓硫酸5 mL 后98 ℃水浴加热20 min,自来水水浴冷却5 min,室温放置10 min;以空白溶液为对照,于488 nm 处测吸光度。以吸光度(A)对葡萄糖质量浓度(C)进行线性回归。吸取10 mg·L-1的样品液1 mL,测定吸光度,多次测量取平均值,通过回归方程求得相应糖质量浓度值,计算总糖量。
1.5 利用薄层层析(TLC)法对紫茎泽兰多糖主要成分检测
精密称取多糖样品15 mg,置10 mL 具塞试管中,加水1 mL。加热溶解,再加入2 mol·L-1三氟乙酸溶液2 mL,摇匀,密封。将其放入烘箱中,100 ℃加热水解8 h[11];取出,冷却至室温,4 000 r/min 离心5 min,上清液转移至10 mL 量瓶中,用2 mol·L-1氧化钠中和至pH 约7.0。至刻度,摇匀,备用。展开剂选用V(正丁醇)∶V(丙酮)∶V(pH 为5 磷酸缓冲液)= 4 ∶5 ∶1 的溶液。显色剂选用“苯胺-二苯胺-磷酸”显色。
试验在密闭的层析缸中进行。首先,将展层剂倒入缸内,待缸内被展层剂蒸汽饱和;然后,将点好样的薄层板底边向下轻轻斜置缸内溶剂中,密封好层析缸即可。溶剂前沿距薄板上端约2 cm 处时,取出板并晾干。将显示剂倒入白色瓷盘中,把晾干的硅胶板浸入盘中,显示剂需没过硅胶板,约1 min后,取出置于烘箱中85 ℃烘20 min,取出冷却至室温。记录各斑点至原点的距离。
比移值(Rf)= 原点至组分斑点中心的距离/原点至溶剂前沿的距离。
1.6 半叶枯斑法检测紫茎泽兰多糖对TMV 侵染烟草叶片的预防作用
选长势一致的8 叶期三生烟,剪去从上往下数第4 至第6 片真叶,选取大小一致、叶片左右均匀的叶片,按顺序放在铺有湿润纱布的白磁盘中。取1 mL 提取物接种左半边叶片;取1 mL 蒸馏水接种右半边叶片;15 min 后沿叶脉喷适量的石英砂,造成叶面创伤;在两边分别接种1 mL 病毒。每处理接种8片叶片,在光照培养箱中培养,25 ℃、10 000 lx 下培养3~4 d 后观察,记录枯斑的数目,并计算抑制率。抑制率=((对照平均枯斑数-处理平均枯斑数)/对照平均枯斑数)×100%。
1.7 紫茎泽兰多糖对烟草防御性酶活性测定
选择长势一致8 叶期时(第七叶完全展开)的盆栽烟草。将5 g 粗多糖溶于50 mL 蒸馏水中,分别用5 mL 粗多糖进行叶面喷施;阴性对照和阳性对照烟草喷施蒸馏水;48 h 后重复处理1 次;处理后24 h后接种病毒,分别于接种病毒后的1、2、3、4、5、6 d取叶片进行酶活测定。称取烟草叶片约0.3 g,加入2 mL PBS 缓冲液(0.5 mol·L-1,pH=7)充分研磨成匀浆,再加入2 mL PBS 缓冲液清洗转入离心管中,4℃静置20 min,12 000 r·min-1离心25 min,取上清液作为酶提取液备用。
过氧化物酶(POD)的活性测定,参照乔富廉[12]的方法,以每分钟OD470变化0.01 的酶量定义为1个酶活性单位。多酚氧化酶(PPO)活性的测定,参考高勇等[13]的方法,以OD410每分钟内变化0.01 的酶量作为1 个酶活性单位。超氧化物歧化酶(SOD)活性测定,采用氮蓝四唑比色法。
1.8 紫茎泽兰多糖诱导烟草病程相关蛋白基因的表达检测
为探究PRs 在EAP 诱导烟草抗性反应中潜在的作用,用RT-qPCR 方法对EAP 诱导PRs 的表达进行研究。
取接种病毒后的1、2、3、4、5、6 d 的烟草叶片,在液氮中研磨粉碎后取50 ~100 mg 粉末,用TRIzol试剂提取总RNA;提取步骤,参照操作说明书进行。取1 μg 提取的总RNA,用反转录试剂盒合成第一链cDNA。利用Premier 5 软件设计基因特异片段扩增引物(见表1),引物由北京奥科鼎盛生物科技有限公司合成。RT-qPCR 反应体系为20 μL,反应程序为:94 ℃预变性3 min;94 ℃、30 s,55 ℃、30 s,72 ℃、30 s,40 个循环;72 ℃延伸10 min。并在全部循环结束后制作融解曲线,检测是否有引物二聚体生成。以EF-lα 基因作为内参基因,利用2-△△Ct法[14]计算基因的相对表达量,每个反应3 个重复。并且以未反转录RNA 样品作为对照,防止DNA 污染。

表1 RT-qPCR 扩增基因特异片段引物序列
1.9 数据分析
预防作用抑制率、酶活性、荧光实时定量PCR数据计算,基于非线性回归分析;原始数据,使用GraphPad PRISM®软件进行数据统计;用Duncan 氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 紫茎泽兰多糖质量浓度
紫茎泽兰多糖经过Molisch 反应,在试管中有紫环形成(见图1)。以吸光度(A)对紫茎泽兰多糖质量浓度(C)进行线性回归,方程为C=0.185A-0.008(R2=0.995)。结果表明,紫茎泽兰多糖的总糖质量浓度为21.53 g·L-1。

图1 紫茎泽兰多糖Molisch 反应
2.2 紫茎泽兰多糖的主要成分
如图2 所示,计算各个样品的比移值(Rf),结果如下:Rf半乳糖= 0.67;Rf木糖= 0.74;Rf果糖= 0.68;Rf葡萄糖=0.64;Rf甘露糖=0.71;RfA=0.70;RfB=0.65。
紫茎泽兰多糖经过三氟乙酸酸解后,经过薄层层析结果显示,有2 种主要的成分,经过对Rf值的计算得出,这2 种主要成分即为甘露糖(A)、葡萄糖(B)。

图2 紫茎泽兰多糖的薄层色谱图
2.3 紫茎泽兰多糖在烟草上对TMV 的预防效果
利用半叶枯斑法对烟草离体叶片进行摩擦接种后,可观察到施用紫茎泽兰多糖的左半叶枯斑数明显少于右半叶施用蒸馏水的(见图3),并且统计3个不同质量分数梯度的EPA 处理的烟草叶片枯斑数(见表2)。结果表明:紫茎泽兰多糖对TMV 侵染有良好的预防作用,尤其当EPA 质量分数为10%时,预防效果最佳(为82.79%)。

图3 紫茎泽兰多糖在烟草上对TMV 的预防效果

表2 紫茎泽兰多糖在烟草上对TMV 的预防效果
2.4 紫茎泽兰多糖对烟草中各防御酶活性的影响
由表3 可见:经测定,紫茎泽兰多糖处理过的烟草植株多酚氧化酶(PPO)酶活在第4 天达到最高,是水处理组(WT)的3.54 倍,而且水处理组PPO 酶活一直高于阴性对照组。过氧化物酶(POD)酶活在第3 天达到最高,分别是水处理组及阴性对照组的1.59、1.30 倍。紫茎泽兰多糖处理过的烟草植株,POD 酶活一直高于水处理组及阴性对照组。超氧化物歧化酶(SOD),是催化O2-歧化作用生成H2O2和O2[15],表3 中SOD 酶活性最高出现在第2 天,是水处理组的2.69 倍。研究结果显示,紫茎泽兰多糖可以有效的诱导寄主产生防御性酶,以抵抗植物病毒侵染。
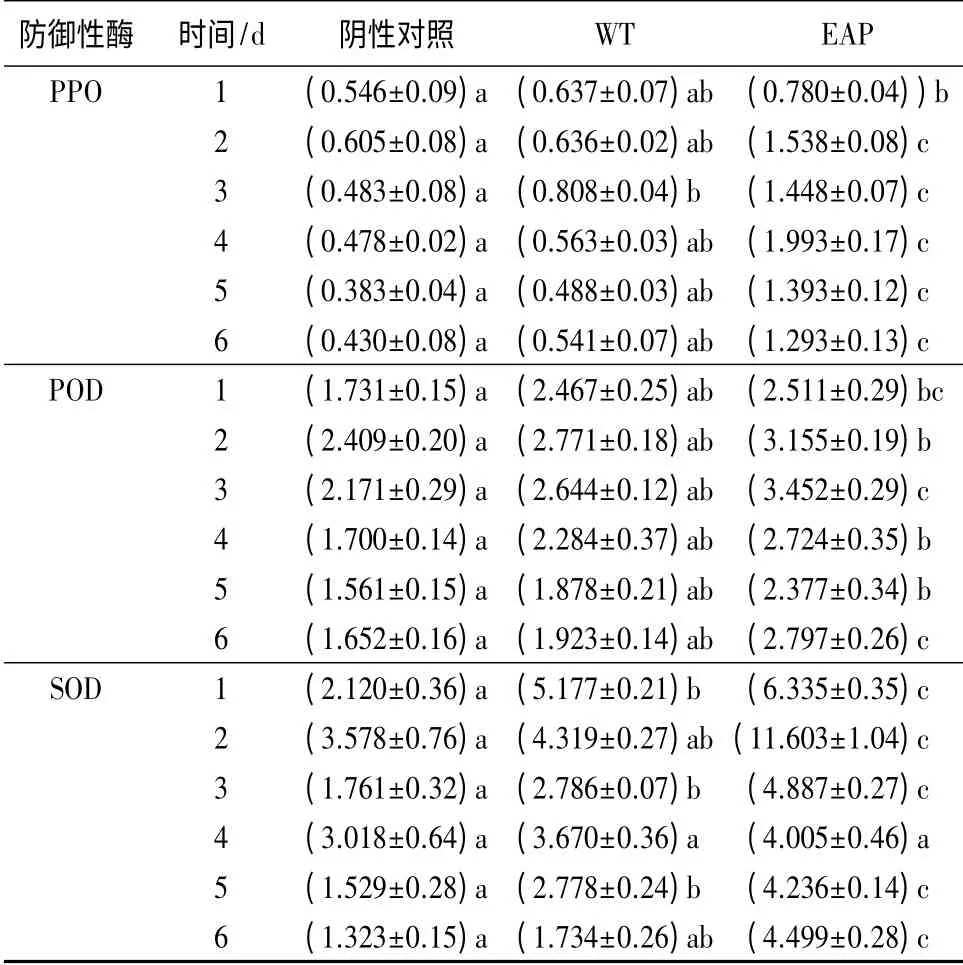
表3 紫茎泽兰多糖对系统宿主防御性酶的影响U·min-1·g-1
2.5 紫茎泽兰多糖诱导病程相关基因PR-1α、PR-3、PR-5 的表达
PRs 的表达是植物产生植株系统获得抗性的标志[16-19]。在植物体中PR 蛋白分为酸性和碱性2类;通常情况下,酸性PR 蛋白在细胞外累积,参与SA 信号途径介导的植物抗性。在本研究中,EAP能够诱导酸性PR 蛋白PR-1α、PR-3、PR-5 在烟草叶中表达(见表4),PR-1α、PR-3、PR-5 都在EAP处理后5 d 达到最高峰,PR-1α 是水处理组及阴性对照组的5.27、12.06 倍;PR-3 是水处理组及阴性对照组的7.93、26.31 倍;PR-5 是水处理组及阴性对照组的5.60、8.09 倍。
3 结论与讨论
植物病毒对植物属专性寄生,植物病毒一旦侵入植物,很难将其铲除[18],所以需采用预防为主、综合防治的策略进行植物病毒的防治工作。在实际生产中,可以通过一些激发子(如水杨酸、香菇多糖等)诱导植物自身产生抗病性[20]。
当植物遭受病原体侵染后,在病原体的侵染位点常会发生过敏反应形成枯斑;而在非侵染部位,通常会诱导系统获得抗性的发生。EAP 处理后的烟草植株,当侵染TMV 后,可以明显抑制TMV 在烟草体内的增殖,提高处理烟草对TMV 的抗性。
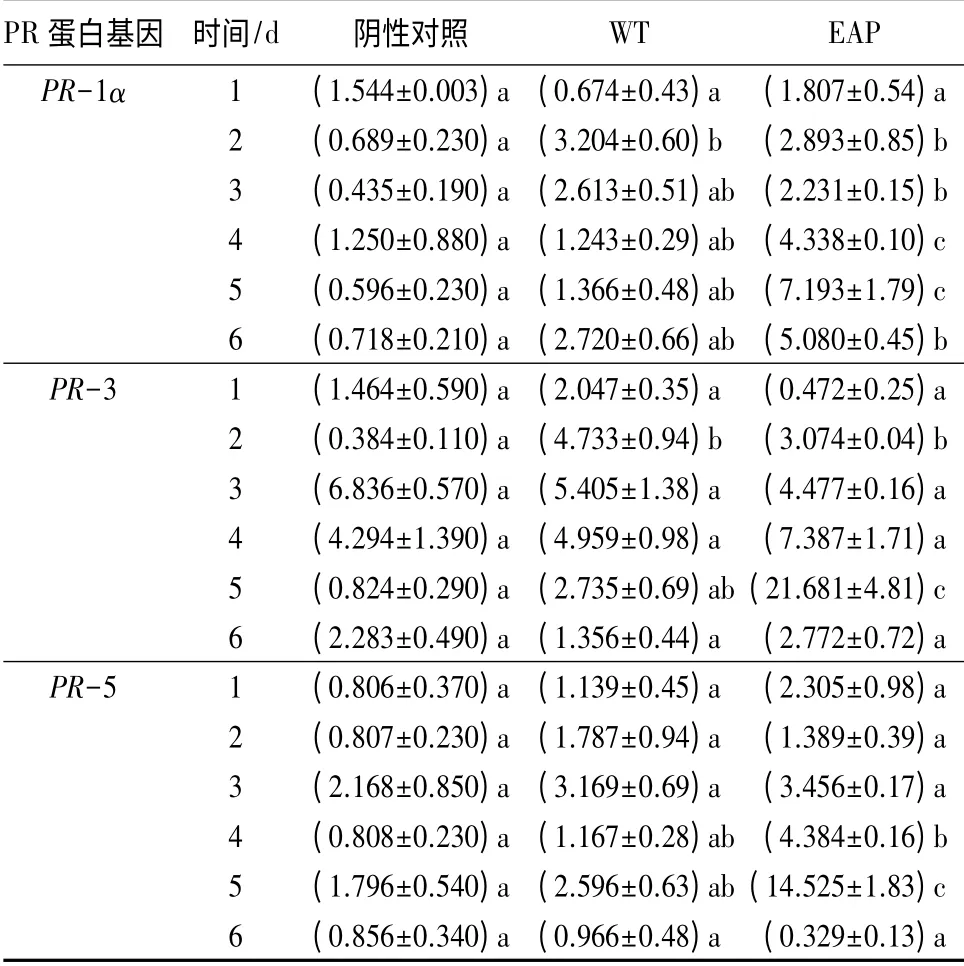
表4 紫茎泽兰多糖处理后烟草PR 蛋白基因的表达
植物拥有极其复杂的防御机制,以抵抗病原体侵害。在植物受到病原体侵染后会激发系统获得抗性,这一过程可以在短时间之内诱导烟草体内防御性的酶(CAT、PAL、SOD)活性显著增强[21]。酸性PR 基因的表达,常被视作可以诱导系统获得抗性发生的标志。
本研究结果证明:EAP 可以激发烟草体内防御性的酶(CAT、PAL、SOD)活性显著增强,以及促进抗病相关蛋白基因(PR-1α、PR-3、PR-5)在烟草叶片中的转录表达。证明EAP 可诱导提高植物对TMV 的抗性,其诱导提高植物抗病性机制,在于EPA 通过水杨酸信号转导途径诱导了植物系统获得抗性的发生,由此为EAP 在农业生产上的应用提供参考,为进一步研究烟草抗TMV 奠定了基础。
[1] 侯太平,刘世贵.有毒植物紫茎泽兰研究进展[J].国外畜牧学:草原与牧草,1999(4):6-8.
[2] 张妙直,田兆丰,刘佳磊,等.紫茎泽兰提取物对几种植物病原真菌的抑制作用[J].安徽农业科学,2010,38(12):6090-6091,6105.
[3] 吴艳兵,颜振敏,谢荔岩,等.天然抗烟草花叶病毒大分子物质研究进展[J].微生物学通报,2008,35(7):1096-1101.
[4] Grant M,Mansfield J. Early events in host-pathogen interactions[J]. Current Opinion in Plant Biology,1999,2(4):312-319.
[5] Nürnberger T,Scheel D. Signal transmission in the plant immune response[J]. Trends in Plant Science,2001,6(8):372-379.
[6] Blumwald E,Aharon G S,Lam B C H. Early signal transduction pathways in plant-pathogen interactions[J]. Trends in Plant Science,1998,3(9):342-346.
[7] Kombrink E,Somssich I E. Defense responses of plants to pathogens[J]. Advances in Botanical Research,1995,21(8):1-34.
[8] Lochman J,Mikes V. Ergosterol treatment leads to the expression of a specific set of defence-related genes in tobacco[J]. Plant Molecular Biology,2006,62(1):43-51.
[9] 王凤德,陈靠山.牛蒡低聚果糖诱导烟草对烟草花叶病毒的抗性[J].中国生物防治,2010,26(1):53-59.
[10] 许激扬.生物化学实验与指导[M].2 版.北京:中国医药科技出版社,2009:186-188.
[11] 韩威,姜瑞芝,陈英红,等.银耳多糖单糖组成分析的三种色谱方法比较[J].天然产物研究与开发,2012,24(3):359-361,302.
[12] 乔富廉.植物生理学实验分析测定技术[M].北京:中国农业科学技术出版社,2002.
[13] 高勇,门兴元,于毅,等.绿盲蝽危害对枣树叶片生化指标的影响[J].生态学报,2012,32(17):5330-5336.
[14] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct[J]. Methods,2002,25(4):402-408.
[15] Bowler C,Montagu M V,Inzé D. Superoxide dismutase and stress tolerance[J]. Annual Review of Plant Biology,2003,43(4):83-116.
[16] Edreva A. Pathogenesis-related proteins:research progress in the last 15 years[J]. General Applied Plant Physiology,2005,31(1/2):105-124.
[17] van Loon L C,Rep M,Pieterse C M J. Significance of inducible defense-related proteins in infected plants[J]. Annual Review of Phytopathology,2006,44(1):135-162.
[18] 申莉莉,王凤龙,钱玉梅,等.拮抗细菌对烟草花叶病毒(TMV)的抑制作用研究[J].中国烟草科学,2007,28(5):9-11.
[19] 苏杭,王春梅,陈浩,等.丁香酚对烟草抗烟草花叶病毒的诱导作用初探[J].农药学学报,2012,14(1):24-29.
[20] Wang F D,Feng G H,Chen K S. Burdock fructoo1igosaccharide induces resistance to tobacco mosaic virus in tobacco seedlings[J]. Physiological and Molecular Plant Pathology,2009,74(1):34-40.
[21] Chen Y F,Zhao X M,Zhan Y,et al. Functions of o1igochitosan induced protein kinase in tobacco mosaic virus resistance and pathogenesis related proteins in tobacco[J]. Plant Physiology Biochemistry,2009,47(8):724-731.
