假松口蘑的SCAR 特异性分子标记
2015-04-02吴松权金美玉全雪丽
兰 西, 吴松权, 金美玉, 全雪丽
( 延边大学农学院,吉林 延吉133000)
松口蘑( Tricholoma matsutake) 被誉为菌中之王[1-2],目前还不能实现人工栽培[3]。松口蘑营养丰富,据不完全的资料数据显示它含有17 种氨基酸和多种维生素。除了可食用外,松口蘑还具有很高的药用价值。它具有增强机体免疫力、平喘祛痰、镇咳、抗氧化、抗过敏等疗效。现代医学研究证明松口蘑还可治疗糖尿病,并具有抗癌作用[4]。假松口蘑( Tricholoma bakamatsutake) 又称傻松口蘑、青红松茸、栎松口蘑、傻松茸、栎松茸或青冈菌等,与松口蘑同为口蘑属,属于典型的营养共生型外生菌根菌[5],主要分布在中国四川、云南、吉林等地[6]。假松口蘑个体与松口蘑比较相对较小,但形态、风味十分相近。常被混入松口蘑中销售,影响中国松口蘑品质。近几年用于区分两者的分子标记如基于ITS 的ISSR 标记[6-8]以及基于RAPD 转换的SCAR 标记[9]陆续被开发,但基于SRAP 的假松口蘑的SCAR 特异性标记的尚未见到报道。SRAP 具有设计简单,中等产量,在基因组中分布均匀等特点,广泛应用于种质资源遗传评价、遗传图谱构建、基因转录图谱绘制[10]。SCAR 标记技术是在序列未知的DNA 标记基础上,对特异PCR 片段扩增产物进行回收、克隆和测序,根据扩增产物的碱基序列重新设计引物,使得扩增位点单一[11]。SCAR 用了1 对互补到专一基因组位点上的长引物和严格的PCR 条件,排除了引物结合位点之间的竞争,因而得到可靠、可重复的条带[12]。
本研究拟基于SRAP 标记构建假松口蘑的SCAR 特异性分子标记,以便在分子水平上快速、准确地鉴定出假松口蘑。
1 材料与方法
1.1 材料
从黑龙江省牡丹江市、吉林省汪清县、吉林省安图县采集的松口蘑和假松口蘑子实体经吉林省松口蘑专家傅伟杰教授鉴定之后,放入-75 ℃超低保温冰箱中保存备用。
1.2 基因组总DNA 提取
采用CTAB 法提取松口蘑和假松口蘑子实体的DNA[13]。
1.3 SRAP 分析
1.3.1 松口蘑和假松口蘑基因池的建立 采用BSA 方法[14],选取5 个松口蘑子实体和5 个假松口蘑子实体,分别按每个样品500 ng 等量混合成松口蘑池和假松口蘑基因池。松口蘑与假松口蘑来源如表1 所示。

表1 试验材料及来源Table 1 Samples and their origins
1.3.2 SRAP 反应体系 总体积为20.0 μl,包括模板5 ng/μl DNA 2.0 μl,2 μmol 引物各2.0 μl,2 mmol dNTP 2.0 μl,2.5 U/μl B Taq DNA 聚合酶0.4 μl( Toyobo 公司) ,10 ×B Taq buffer 2.0 μl,剩余用双重蒸馏水补足。PCR 扩增条件: 预变性94 ℃,5 min; 变性94 ℃1 min,退火35 ℃1 min,延伸72℃1 min,5 个循环;变性94 ℃1 min,退火50 ℃1 min; 延伸72 ℃1 min,36 个循环;最后延伸72 ℃5 min。PCR 产物放在1%的琼脂糖凝胶上电泳,用Dolphin 凝胶成像仪拍照保存。
1.3.3 特异性片断的回收、克隆和测序 将目的DNA 片断切下后,按照康为世纪公司胶回收试剂盒说明书回收。提取质粒DNA 后,用M13 引物进行鉴定。鉴定的阳性克隆委托上海英潍捷基贸易有限公司进行测序。
1.4 假松口蘑的SCAR 特异引物设计和PCR 扩增
根据测序结果和引物设计原则用Primer premier 5 设计假松口蘑的SCAR 特异性上游引物Tb-1(5'-TAAGCTGTGATGAGGGTGTC-3') ,下游引物Tb-2(5'-TGAGTGTCGTCGTATGTAAGTAA-3') 。引物由上海英潍捷基贸易有限公司合成。PCR 反应总体积为20 μl,除上、下游引物(2 μmol) 各2 μl,其余成分与方法1.3.2 PCR 反应体系相同。
假松口蘑的SCAR 特异性PCR 程序为: 预变性94 ℃5 min;变性94 ℃30 s,退火60 ℃30 s,延伸72 ℃30 s,循环30 次;最后延伸72 ℃5 min。
2 结果与分析
2.1 SRAP 标记
以松口蘑和假松口蘑基因池DNA 为模板从300 对引物组合中( ME1 ~ME10 和EM1 ~EM30) ,筛选出1 对对假松口蘑具有特异性的引物,即ME1( 5'-TGAGTCCAAACCGGATA-3') 、EM10( 5'-TGTGGTCCG CAAATTTAG-3') 。用这对引物对构成松口蘑和假松口蘑基因池DNA 的每个单株进行扩增,结果( 图1) 显示,在假松口蘑中每个单株均能扩增出1 条1 100 bp 左右的条带,在松口蘑的单株中却没有扩增出这一条带。

图1 引物对ME1/EM10 对松口蘑、假松口蘑的单株PCR 图Fig.1 PCR results of T. matsutake and T.bakamatsutake with the primer pair of ME1/EM10
2.2 目的片段的测序与分析
将目的条带回收克隆并经PCR 鉴定的阳性克隆委托上海英潍捷基贸易有限公司测序。假松口蘑特异性目的片段序列长度为1 168 bp( 图2) ,与预测的长度相近,表明假松口蘑特异性标记正确。
2.3 假松口蘑的SCAR 特异性分子标记的建立
根据测序结果设计了1 对假松口蘑特异性引物Tb-1 和Tb-2 ( 图2) ,对松口蘑和假松口蘑基因池DNA 的每个单株重新扩增。在Tb-1 和Tb-2 引物扩增中,假松口蘑均能扩增出502 bp 特征条带,而松口蘑未能扩增出任何条带( 图3) ,与预测的结果相同。

图2 假松口蘑目的片段的碱基序列Fig.2 The base sequence of target fragment of T.bakamatsutake
2.4 假松口蘑SCAR 特异性分子标记的验证
为了进一步验证假松口蘑的SCAR 特异性分子标记,我们用假松口蘑的SCAR 特异性引物( Tb-1、Tb-2) 对源自吉林省龙井市、云南省昆明市、日本、云南省宝山镇等不同地区的松口蘑和源自云南省丽江市、吉林省安图县、吉林省龙井市等不同地区的假松口蘑进行了PCR 扩增,结果( 图4) 显示,假松口蘑的SCAR 特异引物在所检测的来源不同地区的假松口蘑中均扩增出502 bp 特异片段,而松口蘑未扩增出任何条带,表明假松口蘑的SCAR 特异性分子标记的可靠性。
3 讨论

图3 特异引物对Tb-1/Tb-2 对松口蘑、假松口蘑基因池DNA的每个单株的PCR 图Fig.3 PCR of individuals of T. matsutake and T. bakamatsutake with primer pairs of Tb-1/Tb-2
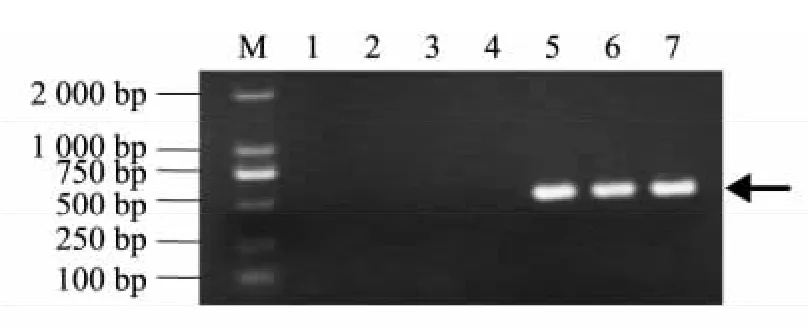
图4 特异引物对Tb-1/Tb-2 对松口蘑和假松口蘑的PCR 图Fig.4 PCR of T.matsutake and T. bakamatsutake with primer pairs of Tb-1/Tb-2
松口蘑的营养价值远高于假松口蘑,由于不能进行人工栽培,目前出售的松口蘑都是野生的,是一种纯天然的食用菌,价格是假松口蘑的10 倍。从形态上很难鉴定出松口蘑和假松口蘑,分子标记经常用于鉴定物种的真伪,分子标记技术能够提供大量的遗传信息,是研究种质资源遗传多样性、植物进化和近缘种亲缘关系的有效工具。分子标记能有效地确定群体的起源和系统关系,可以准确地反应出该种群或个体的本质特征[15],在表型难以区分的分类群的遗传关系的确定方面尤为重要[11]。分子标记鉴定结果准确且成本低,实验操作方便,可以在实验室操作,不需要等待生物生长的周期,也不受外界环境条件的影响[16]。目前区别不同物种的分子标记的方法很多,如RAPD、ITS、SRAP、SCAR 等。
沙涛等[4]利用松口蘑与假松口蘑已有的基因,根据其长度的大小将松口蘑与假松口蘑区别开,而本试验是基于特异基因序列的有无来鉴别松口蘑与假松口蘑,相比之下本试验结果更可靠。吴松权等[9]在RAPD 分子标记的基础上根据序列的有无建立了松口蘑特异性SCAR 标记,但本试验应用的SRAP 方法比RAPD 方法可获得更多的多态性条带,试验的准确性大大提高。张微思等[7]和李强等[8]利用ISSR 方法分析松口蘑的多态性条带,确定其遗传多态性及近缘种的同源性,但没有对松口蘑与假松口蘑进行区分。本研究在SRAP 分子标记基础上根据基因序列的有无,发现了假松口蘑的特异序列,同时根据其特异序列分别设计了1 对特异引物,建立了假松口蘑的SCAR 特异性的分子标记。
目前在区别松口蘑与假松口蘑的试验中,大部分是针对松口蘑而建立的特异性标记,而针对假松口蘑标记的报道还未见到。因此,本试验首次建立了假松口蘑的特异性标记。
[1] 臧 穆. 松茸群及其近缘种的分类地理研究[J]. 真菌学报,1990,9(2) : 113-127.
[2] 张微思,罗孝坤,张丽英,等. 松茸菌丝体的纯培养及其鉴定[J]. 中国食用菌,2010,29(3) : 34-36.
[3] 吴松权,全雪丽,傅伟杰,等. RAPD 标记在松口蘑菌丝体鉴定中的应用[J]. 中国食用菌,2006,25(4) :41-43.
[4] 沙 涛,丁骅孙,李 觅,等. 松口蘑与假松口蘑ITS 序列测定和分析比较[J]. 菌物学报,2005,24 (1) : 48-52.
[5] 全雪丽,石铁源,张美淑. 长白山区栎松口蘑的分布及生态环境调查初探[J]. 食用菌,2009(6) :14-21.
[6] 吴松权,刘继生,全雪丽. 长白山区栎松口蘑母种培养基优化试验[J]. 食用菌,2009 (2) : 32.
[7] 张微思,王 浚,李宗菊,等. 云南松口蘑的ISSR 遗传多样性研究[J]. 云南农业大学学报,2011,26(5) : 593-597.
[8] 李 强,李小林,黄文丽,等. 基于rDNA ITS 和ISSR 标记研究四川松茸遗传多样性[J]. 应用与环境生物学报,2014,20(4) : 578-583.
[9] 吴松权,管清杰,全雪丽,等. 松茸SCAR 标记的建立[J]. 林业科学,2007,43(10) : 150-153.
[10] 王国泽,左福元,增 兵. SRAP 分子标记的研究进展及在植物上的应用[J]. 畜牧与兽医,2013,45(9) : 92-94.
[11] 毕 波,王 瑜,袁庆华,等. SCAR 分子标记在植物抗病育种中的应用[J]. 安徽农业科学,2010,38( 30) : 16778-16780,16957.
[12] 曾东方,罗信昌,傅伟杰. 松口蘑菌丝体的分离和RAPD-PCR分析[J]. 微生物报,2001,41(3) : 278-286.
[13] 邹喻苹,葛 颂,王晓东. 系统与进化植物学中的分子标记[M]. 北京: 科学出版社,2001.
[14] 方宣钧,刘思衡,江树业. 品种纯度和真伪的DNA 分子标定及其用[J]. 农业生物技术学报,2000,8 (2) : 106-110.
[15] 张 婷,王元忠,张晓东,等. 分子标记在食( 药) 用真菌遗传多样性研究中的应用[J]. 生命科学,2013,25( 10) : 1000-1007 .
[16] 曹 辉,刘玉萍. 分子标记技术在药品种鉴别中的应用[J].中国药学杂志,1998,33(5) : 269-273.
