茶园土壤中拟除虫菊酯类农药残留检测
2015-04-13刘腾飞杨代凤董明辉顾俊荣
刘腾飞, 张 丽, 杨代凤, 董明辉, 顾俊荣
(1.江苏太湖地区农业科学研究所,江苏 苏州215155; 2.苏州市职业大学,江苏 苏州215104)
拟除虫菊酯类农药是一类以神经钠离子通道为作用靶标的仿生性杀虫剂,具有广谱、高效、用量少、成本低等特点,在农业生产和卫生领域广泛使用[1]。但此类农药对环境非靶生物蜜蜂、家蚕和鱼类等水生生物高毒[2-3],有些品种具有“三致”作用[4],长期接触可造成慢性蓄积中毒[5],并诱发慢性疾病[6-7]。此外,它具有潜在的环境雌激素活性[8]和一定的生殖毒性[9-10],可损害哺乳动物的生殖系统和影响生殖激素水平,并对免疫、心血管、神经系统存在毒副作用[11-12]。世界上许多国家对拟除虫菊酯类农药的残留限量都作了严格的规定。虽然拟除虫菊酯类农药残留期较短[13],但有些品种对光热稳定,在自然条件下降解慢,进入土壤环境会产生一定累积,造成土壤拟除虫菊酯类农药污染,并通过径流、淋溶等途径污染水体,最终危害人体健康。因此建立快速、简便的方法来准确测定土壤中此类农药,对保护土壤环境和人畜健康具有重要意义。
目前,对于土壤中拟除虫菊酯类农药的残留分析,采用的样品提取方法主要为传统的索氏提取法[14]、振荡提取法[15-17]和加速溶剂萃取法[18]; 净化方法多采用液液分配净化[17]、固相萃取净化[19-20]和柱层析净化[14,16,21],也有采用磺化法净化[22]。这些前处理方法溶剂用量大、操作繁琐、耗费时间,有的萃取过程需要昂贵的仪器设备,检测成本高,难以在普通实验室推广使用。分散固相萃取( Dispersive solid phase extraction,DSPE) 是2003 年美国农业部Anastassiades 等人[23]开发的一种新型农药残留样品制备技术,该技术利用在样品提取液中充分涡旋地分散吸附填料,将基质中的色素、脂肪、糖类、有机酸等杂质除去,从而实现复杂样品中农药残留快速、高效、经济的测定,目前已广泛应用于水果、蔬菜农药残留的检测[24-25],但在土壤中的应用报道较少。本研究拟将DSPE 方法用于土壤样品前处理,结合气相色谱-电子捕获法( GC-ECD) ,以期建立土壤中甲氰菊酯、高效氯氟氰菊酯、氯菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯7 种拟除虫菊酯类农药残留量的分析方法。
1 材料与方法
1.1 仪器与设备
7890A 气相色谱仪,配有电子捕获检测器( ECD) 、7693 自动进样器和Chemstation 色谱工作站( 美国Agilent 公司生产) ;KQ-500DE 超声波清洗器( 昆山超声仪器公司生产) ;TG16-WS 台式高速离心机( 湖南湘仪实验仪器公司生产) ;HSC-24 B 氮吹仪( 天津恒奥科技公司生产) ; VM-10 涡旋振荡器( 韩国Daihan Scientific 公司) ; SX2-4-10 马弗炉( 上海跃进医疗器械公司生产) ; Direct-Q 5 UV 型超纯水机( 美国Millipore 公司生产) 。
1.2 药品与试剂
甲氰菊酯、高效氯氟氰菊酯、氯菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯,质量浓度均为1 000 mg/L,购于农业部环境保护科研监测所;正己烷,HPLC 级( 瑞典Oceanpak 公司生产) ; 乙二胺-N-丙基硅烷( PSA) ,粒度40 ~60 μm( 美国Agela Technologies 公司生产) ;十八烷基硅烷键合硅胶( C18) ,粒度40 ~60 μm( 美国Sepax Technologies 公司生产) ;乙腈、乙酸、无水乙酸钠、无水硫酸镁(620 ℃灼烧4 h) 均为分析纯( 上海国药集团化学试剂有限公司生产) ;实验用水为超纯水(18.4 MΩ) 。
1.3 供试土壤
供试土壤为黄壤土,采自苏州东洞庭山茶园,每个土样采取多点取样法(5 ~10 点) 采集表层(0 ~15 cm) 土壤。将土样除去草根、石块等杂物,捣碎,充分混合均匀,用四分法取一定量备用。
1.4 试验方法
1.4.1 样品前处理 提取:准确称取5.00 g 土壤样品,置于50.00 ml 聚四氟乙烯离心管中,加入2.00 ml超纯水,涡旋混匀,浸润15.0 min,加入10.00 ml 乙酸-乙腈溶液( 体积比1∶ 99) ,混匀,超声提取15.0 min,加入2.00 g 无水乙酸钠和2.00 g 无水硫酸镁,涡旋2.0 min,以9 000 r/min转速离心4 min,取上清液待用。净化:采用DSPE 方法净化,另取一支10.00 ml 聚四氟乙烯离心管,加入0.15 g C18、0.15 g PSA和0.30 g 无水硫酸镁,加入4.00 ml 上清液,涡旋2.0 min,以9 000 r/min转速离心5.0 min。移取2.00 ml上清液,在50 ℃水浴下用氮气缓慢吹至近干,定量加入1.00 ml 正己烷溶解,在混合器上混匀,过0.22 μm有机系滤膜,净化液待测。
1.4.2 GC-ECD 色谱条件 毛细管色谱柱: HP-5(30 m×0.32 mm× 0.25 μm) ; 柱升温程序: 初温80 ℃,保持0.3 min,30 ℃/min 升至180 ℃,保持5.0 min,20 ℃/min升至260 ℃,保持23.0 min;检测器温度: 300 ℃; 进样口温度: 220 ℃,隔垫吹扫3 ml/min; 载气: 氮气,纯度≥99.999%,流速1 ml/min;尾吹气: 高纯氮气,60 ml/min; 进样量:1.0 μl,不分流进样。
1.4.3 线性试验 分别移取1 000 mg/L 的7 种菊酯类农药标准品1.00 ml 置于10.00 ml 容量瓶中,用正己烷定容,配成质量浓度为100 mg/L的单标溶液。根据各农药在ECD 检测器上的峰高响应,取高效氯氟氰菊酯单标溶液0.10 ml,甲氰菊酯、氟氯氰菊酯单标溶液各0.25 ml,其余拟除虫菊酯类农药单标溶液各0.50 ml 于10.00 ml 容量瓶中,用正己烷定容至刻度,得7 种拟除虫菊酯类农药混合标准储备液,保存于4 ℃冰箱中。
取空白土壤试样的净化液作为溶剂,配制基质匹配系列标准溶液,高效氯氟氰菊酯质量浓度为0.004 mg/L、0.010 mg/L、0.020 mg/L、0.100 mg/L、0.200 mg/L、0.400 mg/L,甲氰菊酯、氟氯氰菊酯质量浓度分别为0.010 mg/L、0.025 mg/L、0.050 mg/L、0.250 mg/L、0.500 mg/L、1.000 mg/L,氯菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯质量浓度分别为0.020 mg/L、0.050 mg/L、0.100 mg/L、0.500 mg/L、1.000 mg/L、2.000 mg/L。采用GC-ECD 测定各待测农药的峰面积,以标准溶液的质量浓度( x) 为横坐标,峰面积响应值( Y) 为纵坐标,绘制各拟除虫菊酯类农药的基质标准曲线,得出回归方程。
1.4.4 添加回收试验 称取5.0 g 空白土壤样品3份,分别加入50.0 μl、200.0 μl、500.0 μl 上述7 种拟除虫菊酯类农药混合标准储备液( 高效氯氟氰菊酯的添加水平分别相当于0.100 mg/kg、0.040 mg/kg、0.010 mg/kg,甲氰菊酯、氟氯氰菊酯的添加水平分别相当于0.250 mg/kg、0.100 mg/kg、0.025 mg/kg,氯菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯的添加水平分别相当于0.500 mg/kg、0.200 mg/kg、0.050 mg/kg) ,充分混匀,静置1 h,按照方法1.4.1提取与净化后采用GC-ECD 法测定各农药的峰面积,对每个添加水平作3 个平行,计算回收率及相对标准偏差。
1.4.5 定性和定量 准确吸取1.0 μl 样品溶液进样,记录色谱峰保留时间和峰面积。再吸取1.0 μl基质匹配标准液进样,记录保留时间和峰面积,以保留时间定性,基质外标法定量,对含有2 个及2 个以上异构体的拟除虫菊酯类农药,以各异构体的峰面积之和计算农药残留量( ω) 。
计算公式:ω=( ρ ×v ×f) /m,式中ω 为待测样品中农药残留量( mg/kg) ,ρ 为样液中待测农药残留量( mg/L) ,m 为称取的样品量( g) ,v 为定容体积( ml) ,f 为稀释倍数。
1.4.6 样品测定 用建立的方法检测16 份采自苏州东洞庭山茶园土壤样品。
2 结果与分析
2.1 7 种拟除虫菊酯类农药的GC-ECD 色谱图
7 种拟除虫菊酯类农药的溶剂标准溶液、基质匹配标准溶液色谱图见图1,空白样品及样品加标色谱图见图2。从图中可以看出,7 种拟除虫菊酯类农药的色谱分离效果较好,在标准组分出峰处无明显的干扰杂峰,说明本研究设置的前处理条件及色谱条件合适。
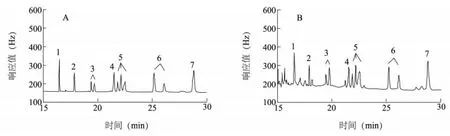
图1 标准溶液色谱图Fig.1 Gas chromatogram of standard solution(A) and matrix-matehed standard solution(B) of seven pyrethroid pesticides
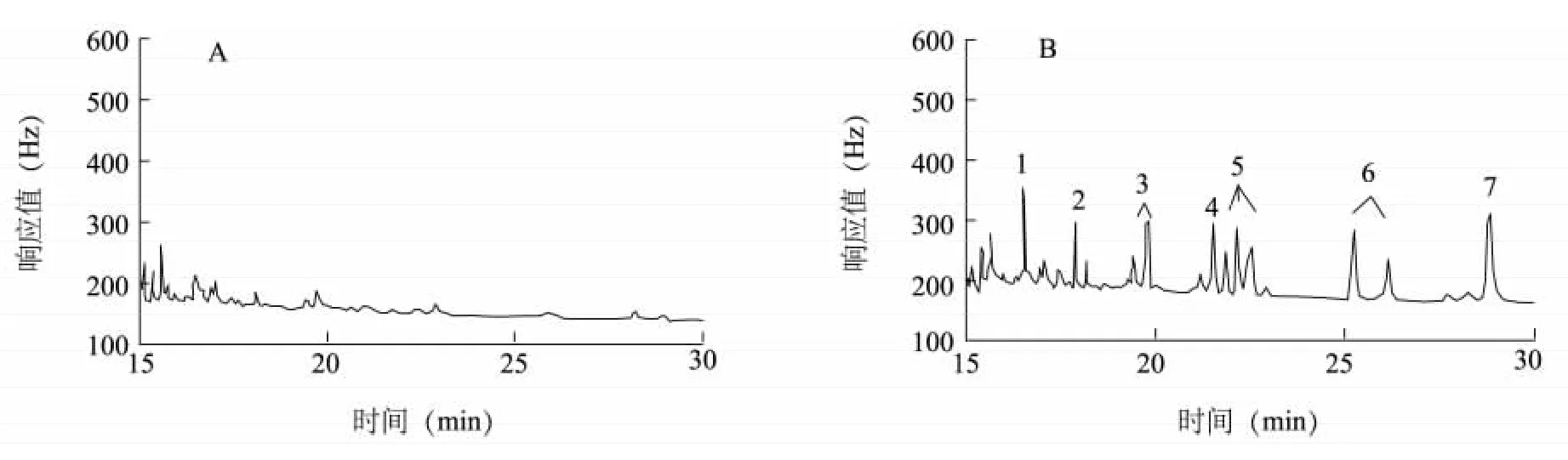
图2 样品色谱图Fig.2 Gas chromatogram of blank soil sample(A) and spiked soil sample(B)
2.2 7 种拟除虫菊酯类农药的线性回归方程
对质量浓度为0.004 ~2.000 mg/L的7 种拟除虫菊酯类农药基质匹配标准溶液进行GC-ECD 测定,以峰面积( Y) 对质量浓度( x) 进行回归,结果见表1。可以看出,各农药浓度与峰面积均呈良好的线性关系,相关系数均大于0.999,表明DSPE 结合GC-ECD 法适用于土壤中7 种菊酯类农药的定量分析。
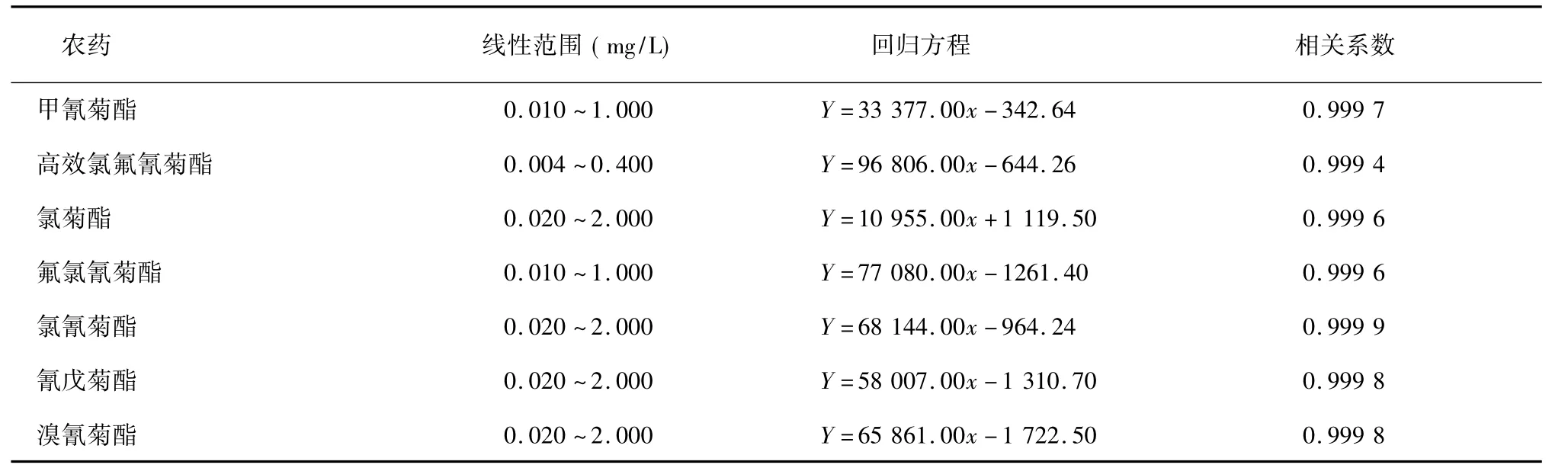
表1 7 种拟除虫菊酯类农药的线性回归方程和相关系数Table 1 Linear regression equations and correlation coefficients for seven pyrethroid pesticides
2.3 7 种拟除虫菊酯类农药的回收率
从表2 可以看出,当添加水平为0.01 ~0.50 mg/kg时,7 种拟除虫菊酯类农药在土壤中的平均回收率为91.6% ~100.3%,相对标准偏差( RSD) 为1.3% ~9.8%,表明该方法具有很好的准确性和重复性,符合农药残留检测的要求。
2.4 7 种拟除虫菊酯类农药的检出限与定量限
对7 种拟除虫菊酯类农药最低添加水平的土壤样品进行测定,得到色谱图。分别以色谱图中噪音信号的3 倍和10 倍计算出甲氰菊酯、高效氯氟氰菊酯、氯菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯的检出限( LOD) 分别为0.003 1 mg/kg、0.001 8 mg/kg、0.008 8 mg/kg、0.004 3 mg/kg、0.008 7 mg/kg、0.008 1 mg/kg、0.006 6 mg/kg,定 量 限( LOQ) 分 别 为0.010 0 mg/kg、0.005 8 mg/kg、0.029 0 mg/kg、0.015 0 mg/kg、0.029 0 mg/kg、0.027 0 mg/kg、0.022 0 mg/kg。
2.5 样品测定
将建立的分析方法应用于苏州东洞庭山茶园土壤样品检测。结果显示,在16 份土壤样品中,共检出4 份土壤样品含有高效氯氟氰菊酯,含量分别为0.010 7 mg/kg、0.007 5 mg/kg、0.013 4 mg/kg、0.008 6 mg/kg;1 份土壤样品含有氟氯氰菊酯,含量为0.038 0 mg/kg。其他样品未检测到7 种拟除虫菊酯类农药。

表2 7 种拟除虫菊酯类农药在土壤样品中的加标回收率和相对标准偏差(n=3)Table 2 Spiked recoveries and relative standard deviations of seven pyrethroid pesticides in soil samples(n=3)
3 讨论
3.1 提取条件的选择
由于土壤水分含量低,本研究试验前在5.0 g土壤中加入2.00 ml 超纯水浸润,增大样品的孔径,从而易于提取溶剂的渗入,提高提取效率。目前从土壤中提取拟除虫菊酯类农药残留,常用的溶剂主要有乙腈、丙酮、乙酸乙酯以及不同溶剂的组合等[14-22]。与丙酮、乙酸乙酯等相比,乙腈渗透性强,对各种极性农药溶解度大[26],提取效率高,且对基质中的蜡类、脂肪等非极性成分提取能力弱,能够有效减少提取液中杂质,因此选择乙腈作为提取溶剂。由于拟除虫菊酯类农药在酸性条件下比较稳定,在提取溶剂中添加适量乙酸,能够提高目标农药在提取剂中的溶解度和稳定性,使用乙酸-乙腈溶液( 体积比1∶ 99) 提取的农药平均回收率高,且平行性较好。另外,确定乙酸-乙腈溶液( 体积比1∶ 99) 用量为10 ml,即体积相当于2 倍量的样品质量,既能保证农药的充分提取,又节省试剂,减少环境污染。
超声波提取操作简单,所需时间短,可实现批量样品的同时处理,但超声波在提取过程中会产生热量,过长的超声时间可能会造成拟除虫菊酯类农药分解,降低灵敏度,影响回收率,因此试验前期比较了5 ~20 min 的超声时间对土壤添加7 种拟除虫菊酯类农药的提取效果。结果显示,超声时间为10 ~20 min 时7 种拟除虫菊酯类农药的平均回收率均在87%以上,为确保提取充分,本试验选择超声时间为15 min。
3.2 净化条件的选择
采用DSPE 净化方法,简单、快速、经济,既可以省去装柱、过柱及大量溶剂洗脱等步骤,实现样品的快速制备,同时也降低了待测农药损失的可能性,使检测结果更接近真实值。PSA 可以有效去除土壤中糖类、脂肪酸、金属离子、极性色素等干扰物质,而C18 去除土壤中维生素、甾醇、油脂和弱极性色素的能力较强,且对目标物质的吸附作用小,因此选用PSA 和C18 2 种混合吸附剂进行分散固相萃取净化。试验前期比较了20 ~250 mg PSA 和20 ~250 mg C18 的净化效果及对目标农药回收率的影响,发现当PSA 和C18 用量低于150 mg 时,对7 种拟除虫菊酯类农药几乎没有干扰,回收率均在90%以上。为最大程度地净化样品提取液并保证回收率,本试验选择PSA 和C18 用量均为150 mg。
3.3 基质效应
基质效应[27]是指样品基质中的某些共提取物组分对待测物测定值的影响。在农药残留的色谱分析中,大多数农药表现出不同程度的基质增强效应[28],即相同浓度的农药在基质中的响应值比其在纯溶剂中的高,一般认为是样品中基质成分的存在减少了色谱系统活性位点与待测物分子作用的机会,使得待测物检测信号增强。本试验结果显示,除了甲氰菊酯、高效氯氟氰菊酯的基质效应不明显外,其他5 种拟除虫菊酯类农药都存在不同程度的基质增强效应。故在用外标法定量时,采用空白土壤净化液配制待测农药的标样,以消除基质干扰,减少误差。
3.4 茶园土壤中菊酯类农药的残留状况
供试土壤样品的检测结果显示,被检茶园土壤中存在一定的拟除虫菊酯类农药残留,残留物主要为高效氯氟氰菊酯和氟氯氰菊酯。由于目前中国没有制定拟除虫菊酯类农药在土壤中的残留限量标准,因此,无法判定此类农药在土壤中的残留超标情况及土壤环境等级。如以《土壤环境质量标准》( GB15618-1995)[29]中有机氯农药残留量为参考,被检茶园土壤中的拟除虫菊酯类农药残留量不高,低于土壤环境质量一级标准( ≤0.05 mg/kg) 。但是,拟除虫菊酯类农药因其脂溶性强而长期吸附于土壤中,造成土壤环境污染,因此在环境中的残留问题应引起重视。同时,在茶园使用此类农药时,应遵守良好的农业操作规范,严格按照推荐剂量和次数使用,并注意其使用方法。
[1] 黄 臻,朱 庆.卫生用拟除虫菊酯杀虫剂的开发与应用[J].上海农业学报,2003,19(1) :71-75.
[2] 孙克坊,周 勤,周金钱,等.微量菊酯类农药对家蚕毒性的调查初报[J].蚕桑通报,2002,33(3) :27-29.
[3] 谢 涛,熊 丽,王 奎,等.拟除虫菊酯类杀虫剂对鱼类的毒性研究[J].生物学教学,2005,30(7) :47-49.
[4] 徐 斐,赵 洁,曹 慧,等.拟除虫菊酯类农药的酶水解研究进展[J].东北农业大学学报,2012,43(7) :1-5.
[5] 柳荣军,孙建辉.拟除虫菊酯类农药中毒61 例[J]. 实用医药杂志,2014,31(8) :766.
[6] SINHA G,AGRAWAL A K,ISLAM F,et al. Mosquito repellent( pyrethroid-based) induced dysfunction of blood-brain barrier permeability in developing brain[J]. International Journal of Developmental Neuroscience,2004,22 (1) : 31-37.
[7] KOLACZINSKI J H,CURTIS C F. Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides: a review of the debate[J]. Food and Chemical Toxicology,2004,42 ( 5) :697-706.
[8] 邴 欣,汝少国.四种拟除虫菊酯类农药的环境雌激素活性研究[J].中国环境科学,2009,29(2) :152-156.
[9] FARAG A T,GODA N F,SHAABAN N A,et al. Effects of oral exposure of synthetic pyrethroid,cypermethrin on the behavior of F1-progeny in mice[J]. Reproductive Toxicology,2007,23( 4) :560-567.
[10] RODRIGUEZA H,TAMAYOA C,INOSTROZA J,et al. Cypermethrin effects on the adult mice seminal glands[J]. Ecotoxicology and Environmental Safety,2009,72(2) : 658-662.
[11] 秦文秀,颜冬云,刘艳秦,等.卤素拟除虫菊酯毒理学研究进展[J].农药,2009,48(6) :394-398.
[12] BABINA K,DOLLARD M,PILOTTO L,et al. Environmental exposure to organophosphorus and pyrethroid pesticides in South Australian preschool children: a cross sectional study[J]. Environment International,2012,48(1) :109-120.
[13] 李玲玉,刘 艳,颜冬云,等.拟除虫菊酯类农药的降解与代谢研究进展[J].环境科学与技术,2010,33(4) :65-71.
[14] 何基伍,杨婷婷,杨云秋,等.土壤中联苯菊酯样品不同制备方法比较研究[J].现代农业科技,2014 (21) :119-120.
[15] 谢湘云,沈爱斯,叶江雷,等.固相萃取小柱净化-气相色谱法测定土壤和沉积物中有机氯和拟除虫菊酯农药残留[J].环境化学,2006,25(3) :347-350.
[16] 陈 莉,章钢娅,靳 伟,等.土壤中拟除虫菊酯类残留农药的气相色谱测定方法研究[J].土壤学报,2006,43(5) :764-771.
[17] 赵 亮,龚道新,方 平,等.菜地土壤中3 种拟除虫菊酯类农药的多残留分析[J].农药,2013,52(2) :114-115.
[18] 李 俊,肖雅雯,王 震,等.加速溶剂萃取-气相色谱/质谱法同时测定土壤中拟除虫菊酯类等18 种农药残留[J]. 岩矿测试,2011,30 (5) :590-595.
[19] 买光熙,李卫建,刘潇威,等.土壤中有机氯及拟除虫菊酯类农药的多残留分析技术[J].农业环境与发展,2006(6) :63-66.
[20] 张志勇,余向阳,王冬兰,等.水和土壤中3 种拟除虫菊酯类农药残留的分析方法[J].江苏农业学报,2009,25(2) :416-420.
[21] 尹可锁,张雪燕,徐汉虹,等.滇池周边农田中拟除虫菊酯农药残留研究[J].西南农业学报,2011,24(4) :1367-1371.
[22] 吴 萍,施海燕,韩志华,等.浓硫酸纯化-气相色谱法测定土壤中拟除虫菊酯农药残留[J].土壤,2008,40(5) :744-749.
[23] ANASTASSIADES M,LEHOTAY S J,STAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and‘dispersive solid-phase extraction’for the determination of pesticide residues in produce[J]. Journal of AOAC International,2003,86(2) : 412-431.
[24] CIES'LIK E,SADOWSKA-ROCIEK A,RUIZ J M M,et al. Evaluation of QuEChERS method for the determination of organochlorine pesticide residues in selected groups of fruits[J]. Food Chemistry,2011,125(2) : 773-778.
[25] 易江华,段振娟,方国臻,等. QuEChERS 方法在食品农兽药残留检测中的应用[J].中国食品学报,2013,13(2) :153-158.
[26] MAŠTOVSKÁ K,LEHOTAY S J. Evaluation of common organic solvents for gas chromatographic analysis and stability of multiclass pesticide residues[J]. Journal of Chromatography A,2004,1040(2) : 259-272.
[27] POOLE C F. Matrix-induced response enhancement in pesticide residue analysis by gas chromatography[J]. Journal of Chromatography A,2007,1158(1-2) : 241-250.
[28] 贺利民,刘祥国,曾振灵. 气相色谱分析农药残留的基质效应及其解决方法[J].色谱,2008,26(1) :98-104.
[29] GB15618-1995 土壤环境质量标准[S].
