对教学中几个疑问的探讨与思考
2015-04-01黄金泉
黄金泉
摘要:对化学教学中的4个案例提出了质疑。运用化学原理和实验探究,分别剖析了这4个教学案例中产生疑问的原由,并提出了一些有益于教学的思考和建议,以期与同行交流,共同提高。
关键词:教学案例;疑问探究;中学化学教学
文章编号:1005–6629(2015)3–0082–04 中图分类号:G633.8 文献标识码:B
我们知道,教材是不可或缺的重要的文本。在读懂、读透、读活教材的同时,融入自己的教学智慧,灵活地对教材内容进行整合和拓展,是我们每个教师所追求的高境界。然而实际教学过程中,有些教师缺乏对教材内容深入研究和思考,甚至曲解了教材编写的意图,对在教学中遇到的一些教学实际问题,常常想当然地进行所谓的“合理”解释,结果不经意间导致了一些科学性错误,对学生产生了误导。下面笔者就几个常见的化学教学实际问题,浅谈自己的一些思考。但愿这些思考能给同行们带来一些启示。
1 工业上用焦炭在高温下还原二氧化硅制粗硅时,产物生成CO是因为焦炭过量吗?
在实际教学过程中,笔者经常听到同行关于碳与二氧化硅反应为什么生成CO而不是CO2是这样解释的:由于反应过程中,焦炭过量,而过量的焦炭在高温下会把CO2还原为CO,所以产物是CO。这样的解释对学生而言看似“合情合理”、“令人信服”,因为初中阶段学生就已经熟悉碳可以在高温下还原CO2生成CO的事实,果真如此吗?笔者在江苏“教学新时空”名师课堂高中化学,有幸听到金陵中学江敏老师开设的一节“化学反应进行的方向[1]”的公开课,授课中江老师从学生已有的认知出发定性地解释了高温条件下,碳与SiO2反应为什么是生成CO而不是CO2的问题。她是从熵拉动反应的因素考虑的:焦炭在高温下还原二氧化硅制粗硅是一个置换反应,由于C的金属性比Si的金属性弱,不利于该置换反应的发生,因此需要熵来拉动。虽然生成1mol CO2的熵比生成1mol CO的熵要大,看似有利于反应向生成CO2的方向进行,但对比SiO2+2C=Si+2CO和SiO2+C=Si+CO2这两个反应,很容易看出前者可以得到2mol CO,而后者只能得到1mol CO2,可见生成CO的熵值更大,更有利于“拉动”该反应的进行,所以是生成CO而不是生成CO2。笔者听后很受启发,围绕该反应重新进行了审视和研究,查阅相关文献,尝试通过近似计算从定量的角度来进行解释。有文献[2]记载,可以利用热力学参数,分别计算出碳与二氧化硅在高温下反应生成CO、碳与二氧化硅在高温下反应生成CO2时反应自发进行所需的温度。具体计算过程如下:
若反应生成CO2,即发生反应SiO2+C=Si+ CO2则:ΔrGθ=[ΔfGθ(CO2)+ΔfGθ(Si)]-[ΔfGθ(SiO2)+ΔfGθ(C)]=(-394.4 kJ·mol-1+0)-(-805.0 kJ·mol-1+0)=410.6 kJ·mol-1>0 kJ·mol-1,常温下该反应不能自发发生。经近似计算:ΔrHθ=465.89 kJ·mol-1;ΔrSθ=184.79 J·K-1·mol-1,根据ΔrG=ΔH-TΔS<0反应才能自发进行,推出只有T>2521.18K时,该反应才可能发生。
若反应生成CO,即发生反应SiO2+2C=Si+ 2CO,则:ΔrGθ=[ΔfGθ(CO)×2+ΔfGθ(Si)]-(ΔfGθ(SiO2)+ΔfGθ(C))=[(-137.3 kJ·mol-1)×2+0]-(-805.0 kJ·mol-1+0 kJ·mol-1×2)=530.4 kJ·mol-1>0 kJ·mol-1,常温下该反应也不能自发进行。同理,根据ΔrG=ΔHTΔS<0反应才能自发进行,近似计算推出只有T>1766.88K时,该反应才可能发生。
经以上近似计算,在高温条件下这两个反应都能发生,但生成Si和CO的反应比生成Si和CO2的反应更容易进行,因生成Si和CO的温度较生成Si和CO2低754.3K,从工业化生产角度来看SiO2与C在高温下反应生成CO才符合生产实际。由此可见,工业上用焦炭在高温下还原二氧化硅制粗硅时,产物生成CO并非是因为焦炭过量,而主要是因为生成CO时所需的温度低的缘故。当然,对高一学生,笔者认为课堂上没有必要就该反应向学生解释为什么。但作为教师,要是非明确,清楚原由,切不可想当然地进行随意解释。否则,易对学生造成科学性误导。
2 粗盐中含有的Ca2+、Mg2+、SO42-等杂质,能否加入Ba(OH)2正好达到既除去Mg2+,同时又除去SO42-的目的?

3 室温下,向饱和的Na2CO3溶液中通入足量的CO2气体,没有晶体析出是因为CO2气体中混有HCl气体的缘故吗?
笔者在一次课堂教学展示活动中,听取了一节课题为“Na2CO3与NaHCO3”的高三复习课。授课者在讲授Na2CO3在一定条件下可以转化为NaHCO3时,设计了这样一个教学环节:首先,PPT投影思考题:室温下,向饱和Na2CO3溶液中通入足量的CO2气体,会有晶体析出,此晶体是什么(请用化学方程式表示)?析出晶体的主要原因是什么?然后引导学生相互交流讨论,得出此晶体是NaHCO3,发生反应的化学方程式为CO2+H2O+ Na2CO3=2NaHCO3。析出晶体的主要原因是(1)生成的NaHCO3溶解度较Na2CO3小[注:Na2CO3的溶解度(20℃,21.5g);NaHCO3的溶解度(20℃,9.6g)];(2)Na2CO3转化为NaHCO3后,生成的NaHCO3质量增加了。同时指出反应消耗了水,溶剂水变少了也是晶体析出的原因之一,但不是主要原因。为帮助学生加深理解和记忆,他还特意将该反应过程在课堂上进行实验演示,具体步骤如下:向事先配好的饱和Na2CO3溶液(注:其配制方法是:向烧杯中加入一定量的蒸馏水,然后加入Na2CO3固体粉末,不断地搅拌,直至烧杯底部有固体粉末剩余为止)中通入由大理石和稀盐酸反应产生的CO2气体,结果出乎学生们的意料,通了很长时间也没有观察到晶体的析出。于是他趁势让学生讨论实验出现异常现象的原因。最后大家一致认为是通入的CO2气体中混有HCl气体,HCl气体与溶液中的Na2CO3反应生成了NaCl,因而没有NaHCO3晶体析出。由于课堂时间的关系,教师当时也赞成了这种说法,没有将异常现象的原因再深入探究下去。真实情况果真如此吗?是因为CO2气体中混有HCl气体造成的干扰吗?听课过程中笔者产生了疑惑,课后就在实验室里进行实验验证。
笔者先将大理石和稀盐酸反应产生的CO2气体,通过装有饱和NaHCO3溶液的洗气瓶,以除去可能混有的HCl气体,然后再将净化后的CO2气体通入到事先配制好的饱和Na2CO3溶液(注:配制方法同上)中,大约通了20多分钟,结果还是没能看到晶体的析出!这样就排除了HCl气体的干扰。既然不是HCl气体的干扰,那究竟是何原因导致了实验的异常?笔者阅读到了由游梅老师撰写的“一个大胆的猜想赢来的成功[5]”一文,从中受到启示,原来真正的“罪魁祸首”并非是CO2气体中混有的HCl气体,而是室温下配制的所谓的“饱和”Na2CO3溶液,在很大程度上并不是真正的饱和溶液的缘故!为此,笔者按照游老师介绍的方法,先把较多量的Na2CO3固体粉末在煮沸状态下的蒸馏水中进行溶解,配成较高温度下Na2CO3的浓溶液,然后将溶液静置,冷却至室温后过滤,在滤液中通入CO2,结果发现在15min左右有较多量的白色细小晶体析出(注:若事先在饱和Na2CO3溶液中加入少量的75%的酒精,析出效果会更好些)。将该白色细小晶体滤出、小心烘干并放入试管中加热(试管用带玻璃管的单孔橡皮塞封闭),将产生的气体通入澄清石灰水中,结果溶液变浑浊,证明该晶体中确实有NaHCO3。笔者后来分析该实验之所以难以成功,除了饱和Na2CO3溶液的因素外,还有一个主要的原因是CO2在水中的溶解度不大,导致通入的CO2只有很少一部分与饱和碳酸钠溶液反应,其余大部分CO2都跑掉了。因此,要想顺利获得成功,必须注意以下几个细节:一是要配制真正的饱和Na2CO3溶液;二是通入的CO2气流要大且连续;三是通入CO2气体的导管最好要插到试管底部,使CO2气泡破碎成更细小的气泡,以增大CO2气体与饱和碳酸钠溶液的接触时间,使其能被Na2CO3溶液充分吸收。
4 NH3与CH4何者更稳定?
实际教学过程中,笔者在一些教辅资料中经常看到:“比较NH3与CH4稳定性的强弱?”这一类问题,没有任何前提和背景。这种说法妥当吗?在苏教版《必修2》[6]“元素周期律”这部分教材内容上,以信息提示的方式出现了这样一段话:“元素的非金属性越强,它的单质越容易与氢气反应形成气态氢化物,气态氢化物越稳定”。由于N和C这两种非金属元素位于元素周期表第二周期相邻位置,且C排在N的前面,根据同周期非金属元素变化规律可知:N的非金属性大于C,则NH3的稳定性大于CH4,这也是大多数教辅资料中提供的参考答案;但分子内部的键能也能反映出分子的稳定性。“通常,键能愈大,键愈牢固,由该键构成的分子也就愈稳定[7]。”笔者查阅了教材[8]上给出的键能数据,H-N键的键能为393 kJ·mol-1,H-C键的键能为413 kJ·mol-1,显然H-C键的键能比H-N键的键能大,所以NH3的稳定性小于CH4;再从热力学方面看,NH3和CH4的热分解反应的热力学数据如表2。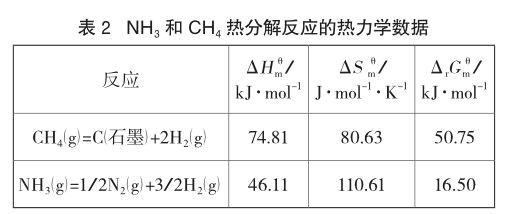
从热力学数据中可以看出,NH3分解进行的趋势比CH4分解趋势大,NH3分解反应的熵变比CH4大,说明NH3比CH4分解所需的温度低,因而NH3的稳定性小于CH4。NH3的稳定性不如CH4可以从物质结构方面加以解释:CH4分子的形状是正四面体形,具有高度的空间对称性,使得CH4分子具有空间结构的对称稳定性;而NH3分子中存在一个非键孤电子对,对成键电子具有排斥作用,使得NH3分子的形状为三角锥形。NH3分子的对称性不如CH4分子,导致NH3分子的稳定性较差,这也正符合物质结构决定物质性质这一化学思想。可见,NH3和CH4何者更稳定的比较问题较为特殊,它是一个违反元素周期律和电负性规则的特殊现象。因此,笔者以为不能仅从元素周期律的角度来对它进行考量。否则,易引起歧义,尤其是在试题创作时更应加以注意。
综上所述,教学中在整合和拓展教材内容时,对一些看似简单的问题,切不可想当然人云亦云,而要进行深入研究,探讨问题的本质与内涵,做到真正把握教材编写的意图,以免产生一些科学性误导。而这一误导不仅仅是知识的误导,更重要的是科学方法和科学思维的误导,应该极力避免。
参考文献:
[1][名师课堂高中化学]江敏.化学反应进行的方向[EB/OL].(2012-10-12)[2014-09-25]. http://hx.jssjys.com/ Html/Article/2140/.
[2]白涛,魏群,陈荣.对“硅”教学中几个疑问的探讨[J].化学教学,2008,(3):72~73.
[3]王祖浩主编.普通高中课程标准实验教科·化学1(必修) [M].南京:江苏教育出版社,2014.
[4]郭琨编著.海洋手册[M].北京:海洋出版社,1984.
[5]游梅.一个大胆的猜想赢来的成功[J].中学化学教学参考,2014,(7):36~37.
[6]王祖浩主编.普通高中课程标准实验教科·化学2(必修)[M].南京:江苏教育出版社,2013:5.
[7]北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学(上册)(第3版)[M].北京:高等教育出版社,1995:255.
[8]王祖浩主编.普通高中课程标准实验教科书·化学.物质结构与性质(选修)[M].南京:江苏教育出版社,2014:49.
