CPG寡核苷酸对卵清蛋白致敏幼鼠血清中Th1/Th2细胞因子及肥大细胞趋化蛋白1的影响
2015-04-01王本贞郑成中
王本贞,郑成中
1安徽医科大学解放军第306医院临床学院 儿科,北京 100101;2安徽医科大学解放军第306医院 儿科,北京 100101
CPG寡核苷酸对卵清蛋白致敏幼鼠血清中Th1/Th2细胞因子及肥大细胞趋化蛋白1的影响
王本贞1,郑成中2
1安徽医科大学解放军第306医院临床学院 儿科,北京 100101;2安徽医科大学解放军第306医院 儿科,北京 100101
目的利用卵清蛋白(ovalbumin,OVA)建立幼鼠食物过敏模型,观察非甲基化胞嘧啶鸟嘌呤寡核苷酸(CPG oligodeoxynucleotide,CPG-ODN)对OVA致敏的干预作用。方法选用2~3周龄BALB/c雌性幼鼠40只建立幼鼠食物过敏模型,分为对照组、不同剂量OVA致敏组(20μg、50μg和100μg组)及CPG-ODN干预组(50μg OVA + CPG-ODN),每组8只。观察过敏症状并评分;眼球取血,检测血清中OVA-IgE、肥大细胞趋化蛋白1(mast cell chemotactic protein 1,mMCP-1)及Th1/Th2相关细胞因子IFN-γ、IL-4的水平;空肠组织行病理学检测。结果除对照组外,致敏组小鼠均出现不同程度过敏症状,空肠表现为Ⅰ型变态反应病理特点,Th2细胞因子、OVA-IgE、mMCP-1水平升高,20μg、50μg致敏组Th1水平降低,50μg致敏组指标改变最显著;与致敏组相比,干预组小鼠过敏症状及病理改变明显减轻,Th2细胞因子、IgE及mMCP-1水平降低,Th1水平升高。结论用50μg OVA建立的BALB/c幼鼠食物过敏模型致敏效果最好,CPG-ODN通过改善Th1/Th2失衡状态,抑制幼鼠食物过敏反应。mMCP-1在过敏性疾病的发生、发展中起重要作用,有望成为食物过敏临床检测指标之一。
食物过敏;幼鼠;Th1/Th2;肥大细胞趋化蛋白1;卵清蛋白;CPG寡核苷酸
食物介导的过敏反应(食物过敏)发病率日益攀升,已成为一个严重的健康问题,是儿童尤其是婴幼儿常见的变态反应性疾病之一。在过敏反应中存在Th1/Th2细胞比例和功能失衡,Th2反应占优势。研究发现,非甲基化胞嘧啶鸟嘌呤寡核苷酸(CPG oligodeoxynucleotide,CPG-ODN)作为免疫调节剂,能够诱导Th1反应,抑制Th2反应,进而在过敏反应中起调节作用[1]。在哮喘模型中发现,CPGODN在致敏及激发前早期干预均可逆转Th1/Th2失衡,对过敏发生、发展起调节作用。过敏反应中特异性IgE与其受体在肥大细胞等细胞表面特异性结合,介导肥大细胞脱颗粒,引起肥大细胞合成和分泌各种炎性介质,形成一个级联放大反应。肥大细胞趋化蛋白1(mast cell chemotactic protein 1,mMCP-1)是小鼠肥大细胞释放的趋化因子,主要对单核巨噬细胞起趋化作用,既然它是肥大细胞分泌的蛋白成分,其是否也参与了过敏性疾病呢?国内对于mMCP-1与过敏相关的文献报道较少。因啮齿动物免疫调节与人类相似[2],本研究以2 ~ 3周龄BALB/ c幼鼠模拟人类婴幼儿期,通过卵清蛋白(ovalbumin,OVA)基础和激发致敏建立食物过敏幼鼠动物模型,于激发致敏前予CPG-ODN干预,观察过敏幼鼠血清细胞因子、特异性IgE及mMCP-1变化及mMCP-1作为过敏性疾病新指标的意义,探讨CPG-ODN在幼鼠食物过敏中的免疫调节作用,进而为婴幼儿食物过敏免疫治疗提供一种新的思路。
资料和方法
1实验动物 2 ~ 3周龄BALB/c雌性幼鼠40只,体质量8 ~ 11 g(购自北京维通利华实验动物技术有限公司),饲养于中国科学院动物研究所,条件为清洁级环境,室温为22℃ ~ 26℃,湿度40% ~70%,自由饮水,以不含卵清蛋白的饲料自由进食,实验前所有小鼠均适应性饲养1周。
2药品、试剂与仪器 卵清蛋白(美国Sigma公司),OVA-IgE试剂盒(Biolegend公司),氢氧化铝[Al(OH)3美国Sigma公司],IL-4、IFN-γ、mMCP-1检测试剂盒(BD Biosciences公司),CPGODN1826(上海生工生物工程股份有限公司北京合成部)。灌胃针(中科院赠送),低温高速离心机(德国KENDRO公司),漩涡混匀器(IKA公司),流式细胞仪(美国BD公司),无菌操作台(sw-cj-2FD日本),虑菌器0.22 μm(赠送),-80℃超低温冰箱。
3OVA致敏液配制 取10 mg OVA干混物加20 mg氢氧化铝颗粒物于烧杯中,加入不同剂量0.9%氯化钠注射液,分别制备500 μg/ml、250 μg/ml、100μg/ml OVA液。
4食物过敏模型分组及制备 将40只小鼠随机分为5组,每组8只。对照组、20μg组、50μg组、100μg组及CPG-ODN干预组(50μg OVA+CPGODN),预实验中初步发现50μg组致敏效果最好。食物过敏动物模型制作方法参照文献[3-5]。各致敏组于实验后即刻、14 d时腹腔注射相应剂量OVA致敏液0.2 ml行基础致敏。自17 d起,各致敏组以OVA液0.3ml(OVA浓度为2 mg/ml)每隔2 d灌胃激发,CPG-ODN组小鼠在每次灌胃激发前1 h均腹腔注射CPG-ODN溶液(40μg/只,约0.08 ml),直至第29天,在基础致敏和激发致敏阶段,对照组小鼠以0.9%氯化钠注射液替代。观察致敏前后各组小鼠过敏症状。于最后一次激发3 h后摘眼球,取血约0.8 ml,离心血清于-80℃冰箱保存待测。取空肠0.5 cm做常规HE染色病理观察。
5过敏症状评分方法及标准 症状评分参照李秀明等[6]报道的评分系统:0分:没有症状;1分:抓,挠头和鼻子;2分:眼睛和嘴水肿,腹泻,活动减少和或活动减少的同时呼吸急促;3分:哮喘,呼吸缓慢,嘴和尾巴紫绀;4分:刺激或震动时没有活动;5分:死亡。
6血清中OVA-IgE含量测定及细胞因子检测 采用ELISA试剂盒检测小鼠血清OVA-IgE含量,具体步骤按照说明书操作。同时采用CBA方法(小鼠血清CBA检测试剂盒)检测小鼠血清中IL-4、IFN-γ、mMCP-1含量,具体步骤按照说明书操作。
7统计学处理 数据均采用SPSS17.0软件进行处理,计量资料数据采用表示,对各组先行正态分布和方差齐性检验,若方差齐,各组间的比较采用单因素方差分析(one-way ANOVA);若方差不齐,各组间比较采用非参数比较。P < 0.05为差异有统计学意义。
结 果
1OVA致敏幼鼠模型成功标志 致敏后,各实验组均出现不同程度过敏症状,3个剂量实验组平均评分分别为22±2.75、31±3.88、19±2.38,CPGODN干预组20±2.50分(图1)。实验组小鼠在末次激发后行OVA点刺,皮丘>3 mm,视为皮肤点刺阳性。实验组小鼠均为阳性结果。
2小鼠空肠病理组织形态学 实验组小鼠空肠HE染色表现为Ⅰ型过敏反应病理特点。20 μg组:嗜酸性粒细胞及炎性细胞浸润,血管扩张不明显;50 μg组:淋巴细胞及少量嗜酸性粒细胞浸润,血管扩张明显;100 μg组:少量炎性细胞浸润,血管扩张不明显;CPG-ODN组:绒毛结构较完整,炎性细胞浸润少;对照组小鼠肠黏膜完整,无明显炎性细胞浸润。见图2。
3血清OVA-IgE测定 致敏组小鼠血清OVA-IgE含量≥对照组-x+3s作为致敏成功的阳性判断值。3个剂量组血清OVA-IgE含量均较对照组明显升高(P<0.05)。50μg组含量最高,20 μg组次之。见表1。
43剂量组小鼠血清中Th1/Th2及mMCP-1含量3剂量组IL-4及mMCP-1含量均较对照组明显升高(P<0.05),IFN-γ含量:20 μg、50 μg较对照组降低(P<0.05),100 μg组与对照组无统计学差异(P>0.05)。各组间比较,无论是mMCP-1、IL-4还是IFN-γ,都存在一个剂量组优势。mMCP-1含量:50 μg组最高,20 μg组与100 μg组无统计学差异(P>0.05)。IL-4含量:20 μg组高于100 μg(P<0.05),50 μg组高于20 μg组(P<0.05)。IFN-γ含量:20 μg组与50 μg、100 μg组间均无统计学差异(P > 0.05),但100 μg组高于50 μg组(P<0.05)。见表1。
5CPG-ODN对小鼠血清中IgE及Th1/Th2、mMCP-1水平影响 与50 μg组比较,CPG-ODN组血清中OVA-IgE、IL-4及mMCP-1均显著降低(P=0.001、P=0.002、P=0.016),IFN-γ则与此相反(P=0.031)。提示,CPG-ODN可促进Th1细胞因子产生,抑制Th2细胞因子及mMCP-1、OVA-IgE分泌。见表2。
表1 幼鼠致敏后血清OVA-IgE、Th1/Th2细胞因子及mMCP-1水平Tab. 1 Serum levels of OVA-IgE, Th1/Th2 cytokines,mMCP-1 in different groups (, pg/ml)

表1 幼鼠致敏后血清OVA-IgE、Th1/Th2细胞因子及mMCP-1水平Tab. 1 Serum levels of OVA-IgE, Th1/Th2 cytokines,mMCP-1 in different groups (, pg/ml)
表2 注射CPG-ODN后血清中OVA-IgE及细胞因子、趋化因子变化Tab. 2 Changes of serum OVA-IgE, cytokines, chemokines after injection of CPG-ODN (, pg/ml)

表2 注射CPG-ODN后血清中OVA-IgE及细胞因子、趋化因子变化Tab. 2 Changes of serum OVA-IgE, cytokines, chemokines after injection of CPG-ODN (, pg/ml)
GroupOVA-IgEIL-4IFN-γmMCP-1 50μg (n=8)17.09±6.3911.57±5.79 11.34±1.16 57.92±26.73 CPG-ODN (n=8)7.62±0.96 6.33±0.68 13.03±1.60 32.83±8.66 Z 3.3613.0482.1552.415 P 0.0010.0020.0310.016
讨 论
食物过敏是指由摄入的食物过敏原扰乱机体免疫系统,造成免疫失调引起的高敏状态,可引起皮疹、腹痛、腹泻甚至致命性休克等临床表现[7]。大多数人对环境中过敏原的免疫反应在生命早期已开启[8],婴幼儿期是食物过敏发病高峰期,蛋白食物(牛奶、鸡蛋等)是最常见的过敏原[9]。对于日益攀升的食物过敏发病率,目前仍然缺乏安全、特效的根治方法。严格避免暴露于致敏食物或营养替代在临床实施困难。近年来,免疫调节剂在过敏性疾病中的作用越来越受到重视,具有免疫刺激作用的CPG-ODN作为一种新型免疫佐剂诱导以Th1型为主的免疫应答,在6 ~ 8周龄成年鼠哮喘模型研究中已有报道。本实验采用OVA对2 ~ 3周龄幼鼠致敏制备过敏模型来模拟婴幼儿期,研究不同剂量OVA对2 ~ 3周龄幼鼠模型制备效果及给予CPG-ODN后其在过敏幼鼠体内的免疫调节作用,探索其在临床治疗中应用的可能性。
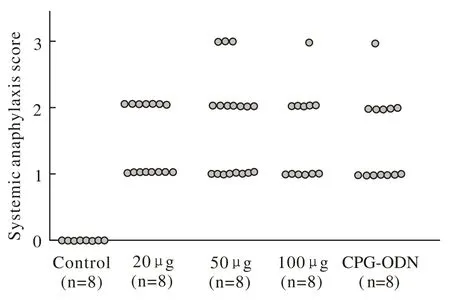
图 1 小鼠腹腔注射及经口灌服后过敏症状评分Fig. 1 Symptoms scores of mice with oral administration and intraperitoneal
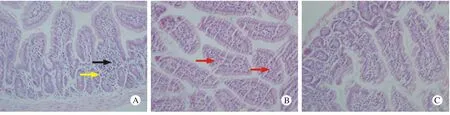
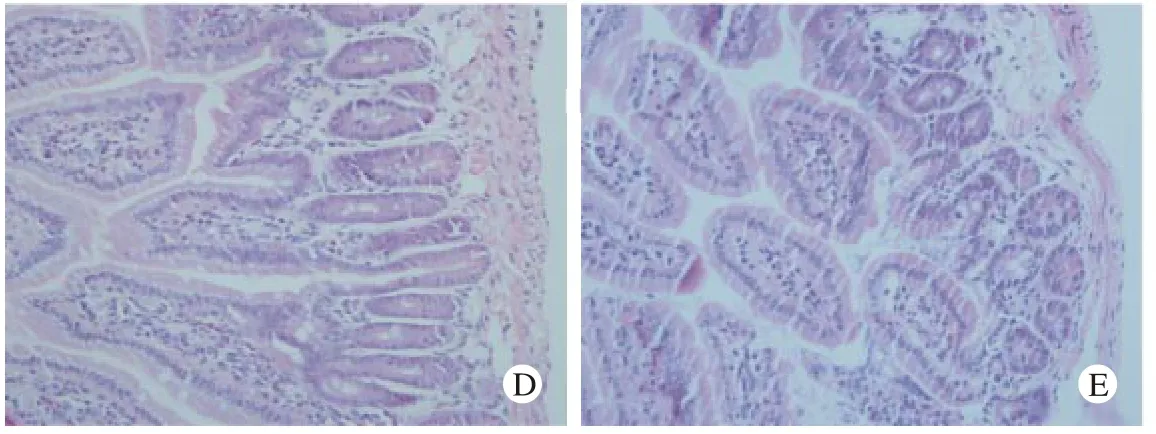
图 2 小鼠空肠HE染色 (×400),A:20μg组; B:50μg组; C:100μg组; D:CPG-ODN干预组; E:对照组红箭头:血管扩张;黄箭头:嗜酸性粒细胞;黑箭头:淋巴细胞Fig. 2 HE staining of jejunal tissue in mice (×400) A: 20μg group; B:50μg group; C: 100μg group; D: CPG-ODN intervention group; E: control group Red arrow: Hemangiectasis; Yellow arrow: Eosinophilic granulocyte; Black arrow: Leukomonocyte
以往食物过敏动物模型研究采用6 ~ 8周龄成年鼠,本实验采用2~3周龄幼鼠来模拟人类婴幼儿期,同时给予不同剂量致敏液观察小鼠致敏情况。本实验结果显示,此模型制备成功,且以50 μg剂量致敏效果最显著。在剂量设计中,参照了Chen等[3]、湛孝东等[5]及Clausen等[10]研究中成年鼠(BALB/c)剂量,同时依据小鼠的周龄及体质量进行调整,分别为20 μg、50 μg、100 μg,造模方法上在Shin等[4]基础上进行改进创新,基础致敏阶段除在致敏即刻腹腔注射致敏液外,在致敏第14天也腹腔注射1次,而Shin等仅在致敏即刻予基础致敏,且在口服剂量上我们综合国内外剂量同时结合幼鼠自身体质采用小剂量经口灌服,模拟食物过敏变应原经口摄入的自然途径。在同为3周龄的BALB/c小鼠致敏中,本实验采用卵清蛋白与氢氧化铝作为过敏原,无霍乱毒素使得实验更安全。在3个不同剂量组中,发现50 μg组的致敏效果最好,100 μg组最差,这一结果与成年鼠低浓度OVA连续致敏造成的过敏性哮喘病理改变更明显的结论稍有不同[5],可能与小鼠周龄差异、致敏方式方法及致敏物质不同有关。我们发现,在一定剂量范围内随着致敏剂量的增加,血清IgE水平升高;超过此范围,剂量越高,致敏效果越不显著,甚至免疫耐受,似乎存在致敏原剂量越高越易出现免疫耐受的趋势,对于大剂量的概念目前还没有一个确定的数值或确切的计算方法,有待进一步深入探讨。
传统观点认为,Th1/Th2平衡向Th2偏移是产生过敏的关键免疫机制,并且在致敏和激发阶段都发挥着重要作用。Th2相关细胞因子如IL-4、IL-5等分泌增多,而Th1型细胞因子分泌减少。且IL-4可促使Th0细胞分化为Th2细胞,刺激B细胞分化为浆细胞诱导IgE的产生[11],引起过敏反应。Mathias等[12]实验表明,IL-4在食物过敏中起着重要的作用,能促进肥大细胞扩增和增强过敏反应敏感性,该实验中IL-4水平与过敏反应程度一致,验证了上述的观点。有学者在食物过敏动物模型研究中指出,mMCP-1作为肥大细胞脱颗粒释放活性介质引起过敏反应中的一种因子,可能参与了食物过敏的发生[13]。本实验采用CBA法检测到过敏幼鼠血清中IL-4及mMCP-1水平同步升高,提示mMCP-1可能参与了食物过敏反应的发生。Leng等[14]报道在食物过敏小鼠中肠黏膜肥大细胞mMCP-1显著增加。Bartnikas等[15]用卵清蛋白100μg暴露于胶带剥离后的皮肤致皮肤过敏,7周后予100 mg OVA口服激发致敏或100μg OVA静脉注射致敏1次诱导全身炎症反应,于激发前1 d及激发后1 h检测发现激发后致敏小鼠核心温度下降及血清mMCP-1显著升高。此模型显著增加的mMCP-1水平获得相似结果。此外,模型中Th1相关细胞因子IFN-γ水平3个剂量组与对照组比较,100μg组与对照组无统计学差异,3组间比较仅50μg与100μg间有统计学差异,这可能与样本量少或者过敏反应中存在Th1/Th2混合的细胞因子反应有关[16-17],并非由严格的Th2反应介导。尤其在过敏程度不同时,Th1、Th2各自参与的程度可能有所不同。
CPG-ODN作为细胞内TLR9配体,与益生菌有着相似的作用,两者特异性结合后能够启动细胞信号通路,最终激活κB 与NF- κB而发挥作用[18],可刺激浆树突状细胞诱导抗原特异性Th1和细胞毒T淋巴细胞产生[19],激活单核/巨噬细胞、自然杀伤细胞及B、T细胞活化,诱导分泌多种细胞因子、趋化因子、黏附分子等[20],作为强有力的Th1型免疫应答增强剂,不仅可以降低Th2型免疫应答的发生,同时可以将已经发生的Th2型反应转向Th1型,具有特异性免疫记忆效应。本实验中,CPG-ODN干预组较50μg组显著降低了血清OVA-IgE、IL-4及mMCP-1水平,诱导Th1型免疫反应,使失衡的Th1/Th2得以纠正。对于mMCP-1降低可能与激活共同NF-κB途径相关,具体机制还需进一步研究。
综上所述,应用OVA可建立2 ~ 3周龄幼鼠食物过敏模型,且以50μg致敏效果最显著,超大剂量OVA可能有免疫耐受倾向,同时实验中mMCP-1升高可作为过敏反应的新检测指标应用于临床。CPG-ODN在2 ~ 3周龄幼鼠过敏模型中可诱导Th1型免疫应答,扭转Th1/Th2紊乱,减轻过敏反应。这一研究可能为临床过敏的治疗提供一条途径。
参考文献
1 Pali-Schöll I, Szöllösi H, Starkl P, et al. Protamine nanoparticles with CpG-oligodeoxynucleotide prevent an allergen-induced Th2-response in BALB/c mice[J]. Eur J Pharm Biopharm, 2013, 85(3 Pt A):656-664.
2 Oyoshi MK, Oettgen HC, Chatila TA, et al. Food allergy: Insights into etiology, prevention, and treatment provided by murine models[J]. J Allergy Clin Immunol, 2014, 133(2): 309-317.
3 Chen C, Sun NA, Li YN, et al. A BALB/c mouse model for assessing the potential allergenicity of proteins: Comparison of allergen dose,sensitization frequency, timepoint and sex[J]. Food Chem Toxicol,2013, 62(62): 41-47.
4 Shin HS, Bae MJ, Jung SY, et al. Preventive effects of skullcap(Scutellaria baicalensis) extract in a mouse model of food allergy[J]. J Ethnopharmacol, 2014, 153(3):667-673.
5 湛孝东,姜玉新,李良怿,等.不同浓度卵蛋白变应原对小鼠哮喘模型建立的影响[J].中国实验动物学报,2012,20(4):16-20.
6 Li XM, Schofield BH, Huang CK, et al. A murine model of IgE-mediated cow's milk hypersensitivity[J]. J Allergy Clin Immunol,1999, 103(2, 1): 206-214.
7 Ben-Shoshan M, Clarke AE. Anaphylaxis: past, present and future[J]. Allergy, 2011, 66(1):1-14.
8 Toomer OT, Ferguson M, Pereira M, et al. Maternal and postnatal dietary probiotic supplementation enhances splenic regulatory T helper cell population and reduces ovalbumin allergen-induced hypersensitivity responses in mice[J]. Immunobiology, 2014, 219(5):367-376.
9 Lin YT, Wu CT, Huang JL, et al. Correlation of ovalbumin of egg white components with allergic diseases in children[J/OL]. http:// www.sciencedirect.com/science/article/pii/S168411821400005X.
10 Clausen SK, Bergqvist M, Poulsen LK, et al. Development of sensitisation or tolerance following repeated OVA inhalation in BALB/ cJ mice. Dose-dependency and modulation by the Al(OH)3 adjuvant[J]. Toxicology, 2003, 184(1):51-68.
11 Sicherer SH, Sampson HA. Food allergy[J]. J Allergy Clin Immunol, 2010, 125(2S2):S116-S125.
12 Mathias CB, Hobson SA, Garcia-Lloret M, et al. IgE-mediated systemic anaphylaxis and impaired tolerance to food antigens in mice with enhanced IL-4 receptor signaling[J]. J Allergy Clin Immunol,2011, 127(3):795-805.
13 黄建芳,王彩霞,向军俭,等.食物过敏动物模型的研究进展[J].食品科学,2014,35(3):280-284.
14 Leng YX, Yamamoto T, Kadowaki M. Alteration of cholinergic,purinergic and sensory neurotransmission in the mouse colon of food allergy model[J]. Neurosci Lett, 2008, 445(3): 195-198.
15 Bartnikas LM, Gurish MF, Burton OT, et al. Epicutaneous sensitization results in IgE-dependent intestinal mast cell expansion and food-induced anaphylaxis[J]. J Allergy Clin Immunol, 2013,131(2): 451.
16 Smart JM, Kemp AS. Increased Th1 and Th2 allergen-induced cytokine responses in children with atopic disease[J]. Clin Exp Allergy, 2002, 32(5):796-802.
17 Ng TW, Holt PG, Prescott SL. Cellular immune responses to ovalbumin and house dust mite in egg-allergic children[J]. Allergy, 2002, 57(3): 207-214.
18 Jassies-van der Lee A, Rutten V, Spiering R, et al. The immunostimulatory effect of CpG oligodeoxynucleotides on peripheral blood mononuclear cells of healthy dogs and dogs with atopic dermatitis[J]. Vet J, 2014, 200(1):103-108.
19 Asanuma H, Zamri NB, Sekine SA, et al. A novel combined adjuvant for nasal delivery elicits mucosal immunity to influenza in aging[J]. Vaccine, 2012, 30(4): 803-812.
20 谢成彬, 王跃. 细菌CpG DNA的免疫激活作用研究进展[J]. 国外医学(临床生物化学与检验学分册), 2004, 25(4): 330-332.
Effect of CPG oligodeoxynucleotides on Th1/Th2 and mast cell chemotactic protein1 in serum with OVA induced food allergy in young mice
WANG Benzhen1, ZHENG Chengzhong2
1Department of Pediatric, Clinical College of The 306th Hospital of PLA of Anhui Medical University, Beijing 100101, China;2Department of Pediatric, The 306th Hospital of PLA of Anhui Medical University, Beijing 100101, China
ZHENG Chengzhong. Email: zcz3066@126.com
ObjectiveTo establish a food allergy animal model in young mice with OVA and observe the intervention effect of CPG oligodeoxynucleotides (CPG-ODN) on food allergy in the animal model.MethodsForty female BALB/c mice (2-3 week) were used to establish the food allergy animal model. They were randomly divided into five groups: Control group, OVA induced food allergy groups (20 μg group; 50 μg group; 100 μg group) and CPG-ODN intervention group (50μg OVA+CPG-ODN) (n=8). The allergic symptoms were observed and scored. Blood samples were collected from each mouse. Serum Th1/Th2 cytokine, OVA-IgE and mMCP-1 levels were determined. Jejunal tissue was taken for histopathological examination.ResultsSome allergic symptoms appeared, the pathological characteristics of I type allergic reaction were shown in jejunal tissue, Th2 cells and levels of serum OVA-IgE and mMCP-1 were increased in all mice except the control group. Mice in 20μg or 50μg of OVA induced food allergy group also showed a decrease in Th1 cells. All these allergic reactions were most obvious in mice with food allergy induced by 50μg of OVA. However, these changes were significantly reduced in mice of intervention group, while the levels of Th1 increased.ConclusionThe best sensitization effect is shown in food allergy animal model of young mice with 50μg of OVA injection. CPGODN can inhibit the allergic reactions in these mice through improving the levels of imbalanced Th1/Th2. The mMCP-1 plays an important role in immune pathogenesis and it may be a detecting indicator of allergic disease.
food hypersensitivity; young mice; Th1/Th2; mast cell chemotactic protein 1; ovalbumin; CPG-oligodeoxynucleotide
R 593
A
2095-5227(2015)05-0505-05
10.3969/j.issn.2095-5227.2015.05.025
时间:2015-04-03 09:31
http://www.cnki.net/kcms/detail/11.3275.R.20150403.0931.002.html
2015-02-04
王本贞,女,在读硕士。研究方向:儿童感染性疾病与儿童过敏性疾病诊治。Email: wangbenzhen87@163.com
郑成中,男,硕士,主任医师,教授,硕士生导师。Email: zcz3066@126.com
