也木勒白羊基因的克隆表达及其多克隆抗体的制备
2015-03-30黄增文阿曼太木尔扎提吾热力哈孜哈孜汗
黄增文,阿曼太,木尔扎提,吾热力哈孜·哈孜汗*
(1.石河子大学动物科技学院,新疆石河子832003;2.四川省达川区畜牧食品局,四川达州 635000; 3.新疆塔城区畜牧兽医站,新疆塔城834700)
黄增文1,2,阿曼太2,木尔扎提1,吾热力哈孜·哈孜汗1*
(1.石河子大学动物科技学院,新疆石河子832003;2.四川省达川区畜牧食品局,四川达州 635000; 3.新疆塔城区畜牧兽医站,新疆塔城834700)
实验旨在验证基因真核表达载体的表达、纯化以及多克隆抗体的制备。利用基因重组技术构建也木勒白羊基因的真核表达载体(pEGFP-INH),并将质粒(pEGFP-INH)作为抗原免疫,制备抗INH的多克隆抗体。结果表明:成功构建了基因的真核表达载体(pEGFP-INH);该抗体能特异性地与INH的抗原以及卵巢组织产生明显免疫亲和反应,说明(pEGFP-INH)能够有效提高家兔的排卵率。本研究建立了高效稳定的INH真核表达系统,获得具有生物学活性的蛋白,为进一步获得高特异性的抗体奠定基础。
基因;真核表达载体;多克隆抗体;也木勒白羊
卵泡抑制素(inhibin,INH)是睾丸支持细胞和卵巢颗粒细胞分泌的一类糖蛋白激素,由和β 2个亚基通过二硫键连接而成的二聚体[1],其α亚基上有糖基化位点,β亚基有A、B 2种类型,故INH存在2种形式,即INHβA和INHβB[2]。由于抑制素基因疫苗因其制备简单、构建成本低、纯度高,因此关于抑制素基因免疫近年来受到了大家的关注。抑制素基因免疫是通过注射外源抑制素基因,使其在机体内表达,刺激机体产生抗抑制素抗体,中和内源性抑制素,促使垂体分泌更多促卵泡素,进而促进卵巢发育[3]。有大量研究表明,抑制素基因通过不同方式和动物的免疫能够产生抗抑制素抗体,并对被免疫的动物的排卵和胚胎及胚胎质量也有一定影响,如抑制素与GFP融合基因PEGISI免疫大鼠可产生抗抑制素抗体[4],抑制素基因疫苗PCIS和免疫佐剂共同作用于大鼠可诱导大鼠产生抗抑制素抗体[5],抑制素基因疫苗免疫能诱导产后奶牛产生免疫应答[6],用INH免疫奶牛能进一步提高超排效果,且能增加胚胎数,提高胚胎质量[7-8],抑制素主动免疫山羊,可以有效提高山羊的排卵率[9]并且抑制素基因工程苗可有效提高山羊排卵率[10]。主动和被动免疫抑制素可以提高羊的排卵数和产羔数[11],以及提高猪和牛的排卵数和产仔数[12]。本实验以新疆也木勒白羊作为研究对象,克隆其抑制素亚基基因(INH),并构建该基因的真核表达载体,将表达载体质粒与脂质体2000按一定比例混合后注射成年家兔,发现能够有效提高试验兔的排卵率,为研究具有特异性免疫效果抑制素基因疫苗提供了必要的参考数据。
1 材料与方法
1.1 菌体、细胞与载体 pGenesi10-3PVector试剂盒购自武汉金赛生物技术有限公司;PMD18-T载体购自大连TaKaRa公司,pEGFP-N1载体、大肠杆菌DH5、豚鼠BHK-21细胞株均为本实验室保存。
1.2 实验动物 实验家兔购自石河子大学动物实验中心3月龄,雌性20只,体重3 kg左右。
1.3 主要试剂 DMEM培养基和小牛血清为GIBCO产品;质粒抽提与胶回收试剂盒购自天根生化科技有限公司;TurboFectTM inTransfection Reagent脂质体转染试剂盒购自Fermentas公司,Trizol购自Invitrogen公司,反转录酶M-MLV及内切酶等购自大连TaKaRa公司;无内毒素大提试剂盒购置于康为公司,生物素化抗体购于晶美生物工程有限公司;链霉亲合素-辣根过氧化物酶(HRP)购于Biotech生物技术有限公司,TMB购自Sigma生化有限公司,其他试剂为国产分析纯产品。
1.4 也木勒白羊卵巢组织的采集 从新疆额敏县哈拉也木勒乡牧区收集纯种也木勒白羊 (已正常产2~3胎的健康母羊)卵巢,将卵巢装入1.5 mL离心管后,放入纱布袋中置液氮速冻,之后置-80℃冰箱备用。
1.5 总RNA的提取与cDNA制备及引物的合成 将收集的卵巢组织于液氮中充分研磨后,按照总RNA提取试剂盒说明书抽提卵巢组织总RNA并逆转录合成cDNA。根据GenBank中绵羊INHα全长序列(XM_004004955.1)设计引物,预计扩增的产物片段大小约为1 100 bp,上游引物:5′-ATG TGG CTT CAG CTG CTC CTC TTC-3′,下游引物:5-′GAT GCA AGC ACA GTG CTG GGT G-3′,引物由上海生工生物工程有限公司合成。
1.6 目的基因的获取及鉴定 用所设计的引物进行PCR扩增,扩增体系为25 μL,其中2×Mix 12.5 μL、上、下游引物(100 μmol/L)各0.4 μL、cDNA 2 μL、补充去离子水至25 μL。反应条件:94℃预变性5 min后进入循环,循环参数94℃变性40 s,68℃退火40 s, 72℃延伸1 min 30 s,35个循环后,72℃延伸7 min。反应结束后,用1.0%琼脂糖凝胶对扩增产物进行电泳并观察。PCR产物经胶回收试剂盒回收纯化后与pMDl8-T载体在16℃下连接过夜。连接产物转化至DH5α感受态细胞中,涂布含50 μg/mL氨苄青霉素LB平板,过夜培养,筛选阳性克隆。随机挑取5个阳性克隆,用PCR法和双酶切法鉴定重组质粒。将鉴定为阳性的克隆株由上海生工生物工程有限公司进行DNA测序。
1.7 真核表达载体(pEGFP-INHα)的构建和鉴定 将(pEGFP-INHα)用(Ecol I)和(Sal I)双酶切后获得目的基因连接经相同酶切的PEGFP-N1载体中,转化至DH5α大肠杆菌菌株。挑取克隆,经PCR鉴定和抽提质粒用Sal I和EcoR I双酶切鉴定,获得阳性克隆送测序。将构建好的重组质粒PEGFP-INHα和空载体质粒PEGFP-N1纯化回收后,分别与转染试剂(脂质体2000)按一定比例混匀,在37℃含5%的CO2培养箱中,与BHK细胞共同孵育。48 h后,在倒置显微镜下,检测载体中绿色荧光表达,收获细胞,抽提总RNA,同时破碎细胞,离心,去上清,进行Western blotting检测试验。
1.8 免疫原制备 将OD260/OD280为2.0的真核表达载体(pEGFP-INHα)质粒与脂质体2000按照一定比例配比,最终浓度为1 mg/mL,对照组所用免疫原为等量的生理盐水。在腿部肌肉分点注射,两侧各注射0.2 mL。
1.8 免疫原注射方法 每次免疫前24 h于腿部两侧肌肉各注射盐酸普鲁卡因(0.5%)0.2 mL,在首次注射盐酸普鲁卡因20 h后再次在相同部位注射0.2 mL盐酸普鲁卡因。在注射首次注射普鲁卡因24 h后在相同部位注射质粒0.2 mL(浓度为1 mg/mL),10 d后用同样方法再次免疫一次,但第二次免疫剂量减半,共计免疫2次。
1.9 抗体水平测定 利用酶联免疫方法(ELISA)测定实验兔血清中抗体水平。向酶标板孔中加入100 μL含15 μg抗原的包被液4℃过。将血样用5%脱脂奶粉进行1∶12 800稀释后加100 μL到包被酶标板孔中,37℃孵育1 h;清洗后加100 μL稀释比为l∶l 000的生物素化抗体,37℃孵育1 h;再次清洗后加入100 μL稀释比为l∶1000的链霉亲合素-辣根过氧化物酶(HRP),37℃孵育1.0 h。清洗后进行TMB(购自Sigma生化有限公司)显色,终止反应后测定DB450nmB值。
1.10 激素测定 实验兔血清中FSH水平用放射免疫法测定,测定试剂盒购于北方生物技术研究所。测定方法在产品说明书的基础上作适当改进,使标准曲线的精度范围与正常动物激素水平范围相一致。
1.11 多抗与也木勒白羊卵巢组织的Western blot鉴定 新鲜也木勒白羊卵巢组织经液氮研磨后和INHα抗原分别加2×SDS上样缓冲液,沸水浴5 min, 10 000 r/min离心5 min,上样顺序为1为纯化的INHα抗原;2、3为也木勒白羊卵巢组织,12% SDS-PAGE电泳后转PVDF膜,用含5%脱脂奶粉的TBST于4℃封闭过夜,TBST洗膜3次 (10 min/次)后,一抗分别为兔多抗血清(1∶1/000)与正常兔血清(1∶1/000),室温孵育1 h,TBST洗膜3次(10 min/次),按1∶5 000加入二抗,二抗为辣根过氧化物酶标记的羊抗兔IgG;室温孵育1 h,TBST洗膜3次(10 min/次),加ECL显影。
2 结 果
2.1 总RNA的分离 所分离总RNA A260/A280为1.9,琼脂糖凝胶电泳后清晰可见18 S和28 S 2条核糖体RNA条带(见图1),卵巢组织总RNA提取过程中未发生降解。

图1 总RNA琼脂糖凝胶电泳

图2 也木勒白羊INHα PCR扩增产物
2.3 重组质粒的PCR、酶切和测序鉴定 将回收纯化的也木勒白羊抑制素亚基基因和线性化的PEGFP-N1连接转化到DH5,首先用含卡那霉素的培养基进行抗性筛选,经PCR和酶切鉴定。如图3,将确定为阳性的菌株送至上海生工生物工程有限责任公司测序,测序结果与克隆基因序列一致,说明本实验成功构建了PEGFP-INH真核表达质粒。
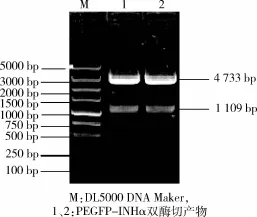
图3 重组质粒PEGFP-INHα酶切鉴定
2.4 血液中抗体滴度 本研究用OD值表示血液中抗体滴度。如表1所示,在初次免疫之前,2组血液的OD值显示,设均无抑制素抗体。在初次免疫后第10天及第1次加强免疫后第10天,免疫组血液中抗抑制素抗体水平逐步快速上升。均极显著高于对照组(<0.01)。结果说明在初次免疫抑制素刺激动物机体快速产生抗体,并在2次加强免疫后血液中抗体水平持续上升,而对照组在整个试验阶段比较分析无抗抑制素抗体产生。
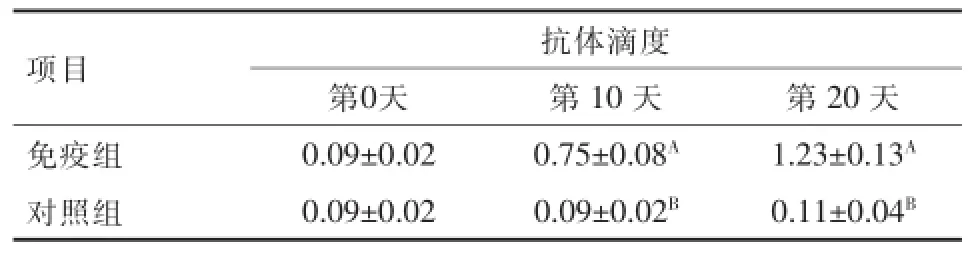
表1 实验兔血液中抑制素抗体滴度变化(X±SE)
2.5 血浆FSH水平 如表2所示,在初次免疫之前和初次免疫后20 d,2组试验兔血清中的FSH浓度无显著差异。虽然免疫组的血清中FSH水平在初次免疫后要比对照组高。第1次免疫后第10天和第2次加强免疫后第10天,免疫组的血清中FSH浓度均显著高于对照组。说明初次免疫抑制素使试验兔血清中的FSH水平略有提高。2次加强免疫显著提高了血浆FSH水平。

表2 免疫抑制素对血清中FSH的影响(X±SE) μg·L-1
2.6 多抗与卵巢组织的Western blot鉴定结果 如图4可见,以INH抗原为阳性对照,制备的多克隆抗体不仅可以与表达纯化的INH抗原有反应性而且与卵巢组织中天然的蛋白也可以发生特异性的反应。
3 讨 论

图4 多抗血清特异性分析
本研究中用抑制素主动免疫家兔,首次免疫后血液中可以检测到抑制素抗体,但抗体滴度较低,加强免疫后血液中的抗体逐渐增加,与初次免疫与加强免疫后,各组京白鸡卵黄抗体效价逐渐增加[13]与结果基本一致,但存在个体差异,应用也木勒白羊抑制素基因质粒作为抗原,目前在国内外报道较少。通过本实验的结果和数据为进一步研究抑制素基因工程疫苗提供了研究依据。现在利用基因重组技术获得有活性的目的蛋白已不再是难事,但是在实际应用中对一些特殊的大分子蛋白分子的获得往往需要分析其具体结构并选择适宜的载体与菌株才能还原其正确的表达形式,所以对抑制素亚基的结构、物理性质进行分析比较[14],构建了抑制素基因INH重组质粒,成功表达和纯化了也木勒白羊抑制素亚基基因并利用重组质粒制备了多克隆抗体。通过抑制素基因质粒主动免疫后卵巢活性和排卵率增加了,说明用抑制素基因质粒主动免疫家兔,可以有效提高家兔的排卵率,这种方法有望成为提高动物综合繁殖力的新技术。同时对其特异性进行了鉴定,证明所制备的多抗血清不仅能与INH基因抗原发生反应而且还能与新鲜的卵巢组织发生特异性反应。这为建立更特异的单克隆抗体奠定了基础。
[1] Medan M S,Arai K Y,Watanabe G,et al.Inhibin;Regulation of reproductive function and practical use in females[J].Anim Sci J,2007,78(1):16-27.
[2] Meldi K M,Gaconnet G A,Mayo K E.DNA Methylation and histone modifications are associated with repression of the inhibin a promoterin the rat corpus luteum[J].Endocrinology, 2013,153(10):4905.
[3]Li H,Mao D G,Zhang D K,et al.Development and evualuation of a novel DNA vaccine expressing inhibin,a (1-32)fragment for improving the fertility in ratsand sheep[J].Anim Reprod Sci, 2008,109:251-265.
[4] 王水莲,薛立群,刑朝芳,等.卵泡抑制素与GFP融合基因疫苗免疫对大鼠卵巢和生殖激素的影响[J].中国兽医学报, 2012,32(2):309-313.
[5] 茆达干,杨利国,叶荣,等.抑制素(1~32)基因免疫对大鼠卵泡发育和生殖激素的影响 [J].中国农业科学,2003,36 (12):1554-1559.
[6] 王水莲,冯建忠,李文平,等.非抗性筛选抑制素基因疫苗免疫对奶牛产后子宫复旧的影响[J].湖南农业大学学报(自然科学版),2014,40(4):395-398.
[7] Li C,Zhu Y L,Xue J H,et al.Immunization against inhibin enhances both embryo quantity and quality in Holstein heifers after superovulation and insemination with sex-sorted semen[J]. Theriogenology,2009,71(6):1011-1017.
[8] Mei C,Li M Y,Zhong S Q,et al.Enhancing embryo yield in superovulated holstein heifers by immunization against inhibin[J].Reprod Domest Anim,2009,44(5):735-739.
[9] 刘桂琼,姜勋平,丁家桐,等.猪卵泡抑制素主动免疫对山羊生殖的影响[J].畜牧兽医学报,2003,34(1):37-39.
[10]田允波,黄运茂.主动免疫抑制素对山羊繁殖性能的影响[J].广东农业科学,2010,(12):122-123.
[11]Kusina N T,Meyer R L,Carlson K M,et al.Passive immunization of ewes against an inhibin like peptide increases follicle stimulating hormone concentrations,ovulation rate,and proliflcacy in spring-mated ewes[J].J Anim Sci,1995,73(5):1433-1439.
[12]Wheaton J E,Meyer R L,Jones R H,et al.Effectsofpas.sive immunization using antibody against an alpha-inhibin peptide on follicle—stimulating hormone concentrations and litter size in sows[J].Theriogenology,1998,49(4):813-822.
[13]张红琳,周红霞,周业飞,等.抑制素质粒(pCISI)DNA卵黄抗体的制备[J].江苏农业学报,2010,26(4):891-893.
[14]闫琳,陈凤仪,田萍,等.降钙素原对新生儿败血症早期诊断的意义[J].中国实用儿科杂志,2003,18(12):763-764.
S827.2
A文献标识码:0258-7033(2015)11-0074-04
2014-12-16;
2015-03-05
石河子大学科学技术研究发展计划项目(gxjs2011-yz09)作者简介:黄增文(1984-),男,重庆荣昌人,硕士研究生,E-mail:xndaxue@126.com
*通讯作者:吾热力哈孜·哈孜汗 (1965-),男,新疆乌苏人,博士,副教授,研究方向为动物生殖生理与繁殖技术,E-mail: 1508217366@qq.com
