褪黑素在牛卵母细胞体外受精中的抗氧化作用*
2015-03-29李晓霞曹平华韩文霞姚昱君禹学礼
李晓霞,刘 燕,曹平华,韩文霞,姚昱君,祝 蕊,禹学礼
(1.河南科技大学动物科技学院,河南洛阳471003;2.河南农业职业学院牧业工程学院,河南中牟451450)
胚胎体外生产技术的关键在于胚胎发育质量的优劣[1]。相较体内培养来说,体外生产胚胎质量差,在形态学、生理学和生物化学方面均与体内胚胎存在明显差异。原因在于体外生产胚胎处于高氧浓度条件下,导致活性氧(Reactive Oxygen Species,ROS)产生过多[2]。ROS是体外胚胎发育效率低的重要原因,同时高水平的ROS会降低精子活力[3]、使糖酵解酶失活、顶体膜损伤[4]、DNA氧化,最终影响体外受精率和体外胚胎发育潜能。添加抗氧化剂可减少ROS产生、阻止氧化应激效应。
褪黑素(Melatonin,MLT)化学名为N-乙酰-5-甲氧基-色胺,是一种由松果腺合成和分泌的神经内分泌激素,具有高度亲脂性和部分亲水性,可弥散穿透各种生理屏障,发挥强大的抗氧化作用[5]。褪黑素及其代谢物可直接清除ROS、激活抗氧化酶、增加GSH水平、抑制细胞氧化酶产生[6]。尤其在减少细胞氧化损伤方面,褪黑素是最有效的抗氧化剂[21-23]。褪黑素保护作用在许多繁殖生物技术研究中已证实,如促进牛[7-8]和水牛[9]卵母细胞体外成熟,提高猪[10]、老鼠[11]、仓鼠[12]、人[13]、水牛[14]和羊[15]的精子功能,刺激老鼠[16]、牛[17]和绵羊[18]胚胎发育。然而,关于牛精子功能研究报道很少,尤其在牛精子获能方面研究还未见报道。为此,本研究将探讨在体外成熟液、获能液和胚胎培养液中添加MLT对牛卵母细胞成熟、获能后精子质量和早期胚胎发育的影响。
1 材料与方法
1.1 主要试剂药品
褪黑素(MLT)(Sigma M5250),TCM3-199(GIBCO公司),促卵泡素FSH、促黄体素LH(中科院动物所),胎牛血清FCS(四季青生物工程有限公司),考马斯亮蓝G-250(BLOSHARP),其他试剂除特别注明外均购自Sigma Chemical Co。
1.2 卵母细胞收集和体外成熟
1.2.1 卵巢收集 从屠宰场收集牛卵巢置于35℃含有青霉素、链霉素的生理盐水中,于6h内运送回实验室。再用上述生理盐水洗涤3次备用。
1.2.2 卵母细胞采集 用带有12号针头的10mL一次性注射器抽吸卵巢表面直径为2~8mm卵泡内的卵母细胞,用体视镜捡出卵母细胞,除去蜘蛛网状卵、透明带变形卵和裸卵,余下的用于成熟培养。
1.2.3 卵母细胞体外成熟培养 挑选卵丘细胞包裹两层以上的COCs经成熟培养液清洗2~3遍后,放入预先平衡过的10-9M MLT[19]的成熟培养液中,其对照组(未添加MLT)采用基础培养液,然后置于39℃、5%CO2和最大饱和湿度的培养箱中进行体外成熟培养。基础培养液为TCM199中加入0.5μg/mL FSH、5μg/mL LH和100μM Cysteamine。培养方式为微滴培养法,在30mm培养皿中作6~10个滴(50μL/滴),每滴放25~35枚卵丘-卵母细胞复合体,后覆盖石蜡油静置培养。
1.2.4 核成熟评估 成熟培养24h后取出牛卵母细胞,用0.1%的透明质酸酶去掉卵丘细胞,在体视显微镜下观察是否排出PB1,排出PB1则为核成熟的卵母细胞(图1)。
1.3 体外受精
1.3.1 精液的处理 将牛细管冻精从液氮罐取出,立即置于38℃水浴中解冻约30s,用润湿酒精的纸巾擦拭冻精细管,而后剪开冻精细管进行精液的处理。采用上游法处理精子,将精子分别缓缓加入预热好的内含10-3M、10-4M和10-5M MLT的2 mL受精液(含肝素、咖啡因的获能液)的试管底部,放入39℃、5%CO2和最大饱和湿度的培养箱中孵育45min后,取上清液置于10mL离心管中,离心(1 500rpm)5min后去除上层悬液,留下层大约50 μL的活精子滴,随后进行精液品质相关参数的评定,筛选最适MLT浓度。
1.3.1.1 活力评定 采用目测法评估精子活力,精子活力是指精液中呈直线前进运动精子占总精子的百分率。
1.3.1.2 质膜完整性检测 低渗肿胀法检测精子质膜的完整性,参照李晓霞[5]的方法操作。最后,滴片后在200×相差显微镜下观察精子尾部形态,精子尾部形成一个圆环的为精子质膜完整的精子,没有形成圆环的则为质膜损伤的精子,每次计数至少200条精子。
1.3.1.3 顶体完整性检测 采用考马斯亮蓝G-250染色法检测精子顶体完整性,方法参照李晓霞[5]。染色完毕后用自来水冲洗,自然干燥后,在1000×油镜下统计顶体膜完整率及破损率。顶体区为蓝色且顶体边缘光滑的精子为具有完整顶体的精子,顶体区不着色或着色较淡的精子为顶体破损的精子,至少观察200条精子。
1.3.1.4 线粒体活性检测 用线粒体膜电位检测试剂盒(JC-1)(Beyotime)检测精子的线粒体膜电位,精子的染色程序按照试剂盒说明进行。(1)按照每50μL JC-1(200×)加入8mL超纯水混匀后,再加入2mL JC-1染色缓冲液(5×)混匀即为JC-1染色工作液。每1mL JC-1染色缓冲液(5×)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1 ×)。取100μL精子密度大约为107个/mL精液,加入100μL JC-1染色工作液,37℃下孵育30 min。然后用JC-1染色缓冲液(1×)离心洗涤,再重悬于JC-1染色缓冲液(1×),使精子密度达到107个/mL。(2)取5μL染色后的精子悬液滴在载玻片上,然后盖上盖玻片,于荧光显微镜的蓝光下观察且记录有线粒体活性(高膜电位)的精子数(在精子尾部中段有微黄或桔红色荧光)和无线粒体活性(低膜电位)的精子数(精子尾部中段产生绿色荧光)(图2),至少观察200个精子。

图1 排出PB1的牛卵母细胞Fig.1 Bovine oocyte educing PB1

图2 牛精子JC-1染色Fig.2 Bovine spermatozoa stained by JC-1
1.3.2 受 精 将成熟培养后的牛卵母细胞用受精液清洗3遍后,将卵母细胞移入已平衡好的受精滴(50μL/滴)中,每滴一般放入15~20个卵母细胞。随后将处理后的精子分别加入到各受精滴中,使其终浓度达到1~2×106个/mL,最后放置于39℃、5%CO2且最大饱和湿度条件下进行孵育。
1.4 体外培养

图3 胚胎发育A.卵裂时期;B.囊胚时期(黑色箭头所指为囊胚)Fig.3 Embryo developmentA.Cleavage stage;B.Blastocyst stage(black arrow pointing at the blastocyst)
受精8h后,将假定受精卵用含培养液(C液)清洗3遍后移入预先用10-9M MLT[19]培养液制备好的细胞单层(20μL/个)中或直接移入未含有10-9M MLT(对照组)单层中培养,每个细胞单层通常放入15~25枚受精卵,置于39℃、5%CO2及最大饱和湿度条件下继续培养,每隔48h进行半量换液。且在受精后48h统计其分裂率,在受精后第6~9d统计其囊胚率(图3)。
1.5 统计分析
所有试验重复6次,每个试验组至少计数200条精子或20枚卵母细胞。用SPSS11.5统计软件,对试验数据进行单因素方差分析。显著水平为P<0.05。
2 结果与分析
2.1 添加褪黑素对牛卵母细胞体外成熟的影响
牛卵母细胞在添加0M(对照组)或10-9M MLT的成熟培养液中体外成熟培养24h后,其成熟率见表1。结果表明,成熟液中添加10-9M MLT牛卵母细胞的成熟率显著高于对照组(77.8%vs 62.5%,P<0.05)。因此,在牛卵母细胞体外成熟液中添加MLT可提高牛卵母细胞体外成熟率。
2.2 添加褪黑素对牛精子获能效果的影响
牛冻精分别在添加0M(对照组)、10-3M、10-4M、10-5M MLT的获能液中经上游法处理45min后,检测各个处理组精子的活力、质膜完整率、顶体完整率和线粒体高膜电位百分率(如图4)。结果表明,获能液中添加10-4M MLT牛精子处理后的活力(84.6%vs 71.6%)、质膜完整率(88.8%vs 75.2%)、顶体完整率(87.0%vs 74.4%)和线粒体高膜电位百分率(83.0%vs 70.2%)均显著高于对照组(P<0.05);且获能液中添加10-3M与10-4M MLT牛精子处理后的各个参数间均差异不显著(P>0.05),但添加10-3M MLT牛精子处理后的各个参数与对照组均差异显著(P<0.05)。由此说明,在获能液中添加MLT可提高处理后精子的活力、质膜完整性、顶体完整性和线粒体活性;添加MLT的最适浓度为10-4M。
2.3 添加褪黑素对牛早期胚胎发育的影响
牛卵母细胞受精后在添加0M(对照组)或10-9M MLT的体外培养液中培养48h后,统计其卵裂率,培养6~9d统计其囊胚率(见表2)。结果表明,体外培养液中添加10-9M MLT牛卵母细胞体外受精后的卵裂率(67.6%vs 53.2%,P<0.05)和囊胚率(35.4%vs 20.3%,P<0.05)均显著高于对照组。由此可见,在体外培养液中添加MLT可显著提高体外受精后的卵裂率和早期胚胎发育的囊胚率。

表1 添加10-9 M褪黑素对牛卵母细胞体外成熟的影响Table 1 Effect of 10-9 M MLT on bovine oocyte maturation in vitro

表2 添加10-9 M MLT对牛早期胚胎发育的影响Table 2 Effect of 10-9 M MLT on early embryos development of bovine
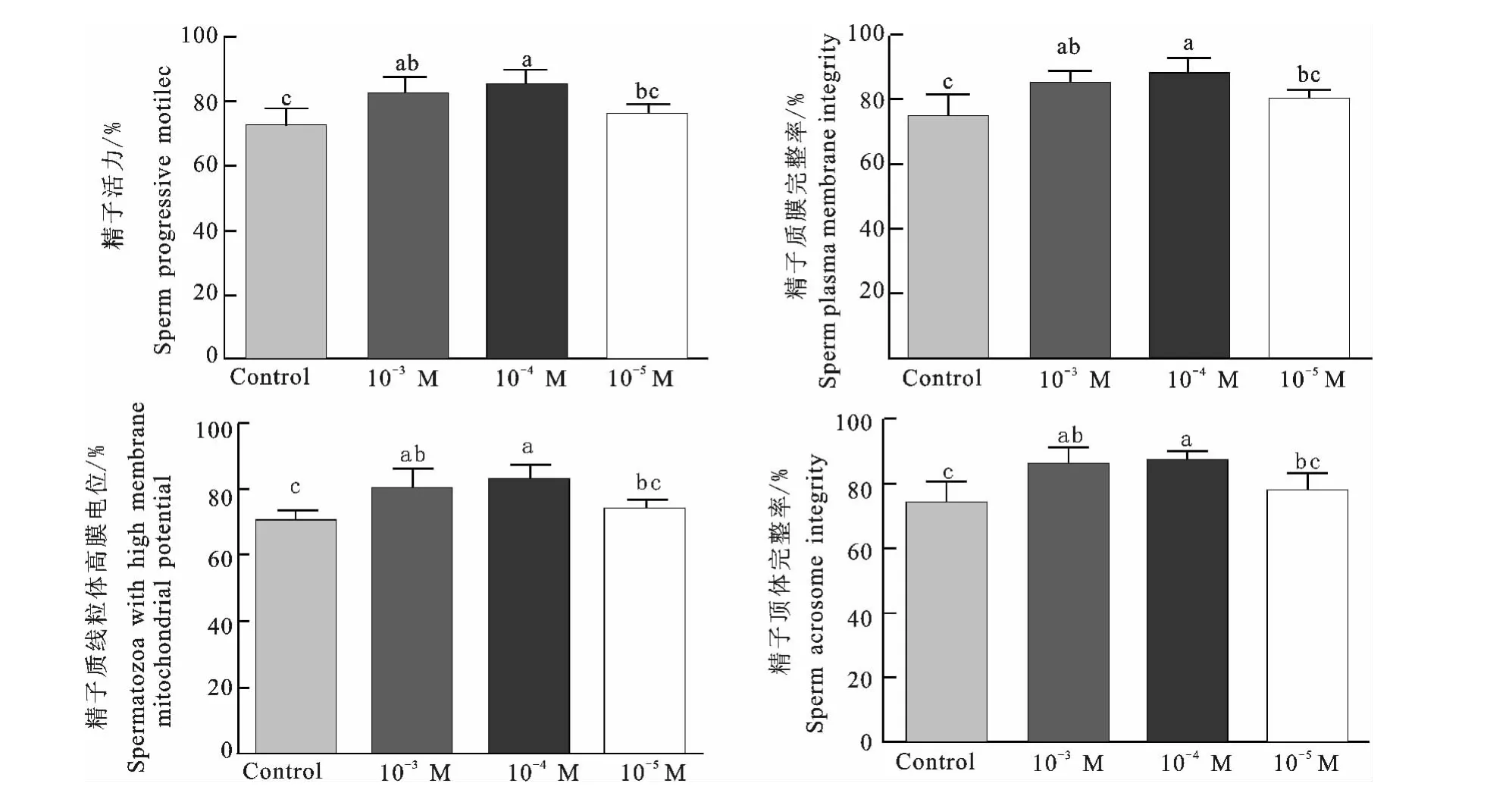
图4 添加不同浓度褪黑素在牛精子获能液中对精液品质的影响Fig.4 Effect of different concentrations of MLT on bovine semen quality in vitro capacitation
3 讨 论
体外受精及体外培养过程中,氧化应激会直接影响卵母细胞成熟、精子获能和早期胚胎发育[20]的效果。配子、胚胎易受到ROS攻击,源于其在体外操作中常处于超生理水平的ROS环境[21]。而过多的ROS会导致线粒体功能紊乱、ATP消耗、细胞凋亡发生和胚胎发育阻滞[20]。因此,添加抗氧化剂于体外培养液可提高卵母细胞成熟[22]、精子质量[14]和胚胎体外发育[19]的效率,代表性地有Vc[23]、白藜芦醇[24]、褪黑素[22-25]等。关于褪黑素在繁殖系统方面的作用,尤其在提高卵母细胞成熟和早期胚胎发育方面,已成为快速发展的研究领域之一。
褪黑素被发现存在于牛卵泡液中,卵泡液中的褪黑素可能是由卵母细胞合成的[26],它可以保护细胞免受氧化应激,减少由环境因素损伤造成大分子物质遭受氧化作用[16],从而提高卵母细胞质量。在临床治疗中,褪黑素可以改善人卵母细胞质量[27]。除此之外,褪黑素也提高了猪、牛、小鼠卵母细胞体外成熟效率[22],本研究也得到相似结果。另外,褪黑素可通过减少ROS的浓度,显著提高卵母细胞成熟、孤雌激活囊胚及正常囊胚的细胞数目[28]。牛胚胎体外培养过程中,添加褪黑素可抑制自由基形成,且能促进牛胚胎发育[17]。Dehghani-Mohammadabadi等[29]也发现了同样的结果,添加10-12M褪黑素可明显提高鼠卵母细胞体外发育的卵裂率和囊胚形成率,而添加10-9M褪黑素则可明显增加滋养层和内细胞团数目,两种处理浓度均可显著减少凋亡指数。Manjunatha等[9]分别在水牛卵母细胞成熟液和胚胎培养液中添加10、50μM褪黑素可明显提高卵母细胞成熟率和可移植胚胎率。为检测褪黑素在牛胚胎发育中的保护作用,Wang等[19]在体外培养液中分别添加10-11、10-9、10-7、10-5、10-3M褪黑素,发现添加10-11~10-5M在前2d和3~8d的不同培养液中,均可明显促进胚胎发育;尤其是10-9、10-7M的褪黑素效果最佳,此结果与本研究结果基本一致。本研究尝试添加10-9M的褪黑素于胚胎培养液中,相比对照组来说,MLT组可明显提高早期胚胎发育的卵裂率和囊胚率。说明添加适宜浓度的MLT在IVF培养液,可减少ROS的产生,抑制氧自由基的损伤,从而保护牛卵母细胞免受氧化应激,提高牛卵母细胞体外发育效率。
ROS超生理水平的产生会对精子质量和体外保存的精子功能产生毒副作用[30],还能诱使凋亡细胞死亡[31]。褪黑素作为一种非酶类的强抗氧化剂,它在保护精子功能和清除NO、ROS的作用已有相关研究报道[32]。然而,在牛精子获能处理液中添加褪黑素对牛精子质量功能作用的研究还不充分。因此,本研究尝试在含肝素、咖啡因的获能液中分别添加0M(对照组)、10-3M、10-4M、10-5M MLT,经上游法处理后评估精液品质各参数。结果发现,添加10-4M MLT处理后的牛精子活力、质膜完整率、顶体完整率和线粒体高膜电位百分率均显著高于对照组。du Plessis等[33]添加2mM MLT与处理后人精液在37℃、5%CO2培养箱中共孵育2h后,MLT组可明显提高精子活力、减少不能存活精子数目和内源NO含量。Kaya等[15]研究发现,植入MLT的公羊在繁殖或非繁殖季节均可显著提高精子冷冻-解冻后的顶体完整率,在繁殖季节植入MLT还可以减少磷酸酶释放,从而减少超低温冷冻过程中酶的泄露,以利于提高羊精液冷冻效率。同样地,Li等[14]研究也发现,相较其它处理组(0 M、10-5M和10-6M),在水牛精液稀释液中添加10-4M MLT可显著提高精子线粒体活性。本试验结果与这些结果基本一致,说明褪黑素在提高获能后精子质量方面也可以作为一种有效工具,利用其抗氧化性以延长精子寿命、减少精子过早老化,从而改善精子品质。
4 结 论
体外受精液中添加10-9M MLT可显著提高牛卵母细胞体外成熟率和随后胚胎发育效率,获能液中添加10-4M MLT可明显改善精子质量,说明褪黑素作为一种强抗氧化剂可保护两性配子和胚胎发育免受损伤。
[1] Besenfelder U,Havlicek V,Kuzmany A,et al.Endoscopic approaches to manage in vitro and in vivo embryo development:use of the bovine oviduct[J].Theriogenology,2010,73(6):768-776.
[2] Luvoni G C,Keskintepe L,Brackett B G.Improvement in bovine embryo production in vitro by glutathione-containing culture media[J].Mol Reprod Dev,1996,43(4):437-443.
[3] Alvarez J G,Storey B T.Spontaneous lipid peroxidation in rabbit epididymal spermatozoa:its effect on sperm motility[J].Biol Reprod,1982,27(5):1 102-1 108.
[4] Alvarez J G,Storey B T.Assessment of cell damage caused by spontaneous lipid peroxidation in rabbit spermatozoa[J].Biol Reprod,1984,30(2):323-331.
[5] 李晓霞,曹平华,禹学礼,等.添加褪黑素对牛精液品质的影响[J].中国畜牧兽医,2013,40(4):177-179.
[6] Galano A L,Tan D X,Reiter R J.On the free radical scavenging activities of melatonin's metabolites,AFMK and AMK[J].J Pineal Res,2013,54(3):245-257.
[7] Takada L,Martins Junior A,Mingoti G Z,et al.Melatonin in maturation media fails to improve oocyte maturation,embryo development rates and DNA damage of bovine embryos[J].Sci Agric,2010,67(4):393-398.
[8] Takada L,Junior A M,Mingoti G Z,et al.Effect of melatonin on DNA damage of bovine cumulus cells during in vitro maturation(IVM)and on in vitro embryo development[J].Res Vet Sci,2012,92(1):124-127.
[9] Manjunatha BM,Devaraj M,Gupta PS,et al.Effect of taurine and melatonin in the culture medium on buffalo in vitro embryo development[J].Reprod Domest Anim,2009,44(1):12-16.
[10] Jang H Y,Kim Y H,Kim B W et al.Ameliorative effects of melatonin against hydrogen peroxide-induced oxidative stress on boar sperm characteristics and subsequent in vitro embryo development[J].Reproduction in Domestic Animals,2010,45(6):943-950.
[11] Sarabia L,Maurer I,Bustos-Obregon E.Melatonin prevents damage elicited by the organophosphorous pesticide diazinon on mouse sperm DNA[J].Ecotoxicol Environ Saf,2009,72(2):663-668.
[12] Fujinoki M.Melatonin-enhanced hyperactivation of hamster sperm[J].Reproduction,2008,136(5):533-541.
[13] Espino J,Bejarano I,Ortiz A,et al.Melatonin as a potential tool against oxidative damage and apoptosis in ejaculated human spermatozoa[J].Fertil Steril,2010,94(5):1 915-1 917.
[14] Li X X,Yang X G,Lu Y Q,et al.Protective effects of melatonin against oxidative stress in flow cytometry-sorted buffalo sperm[J].Reprod Domest Anim,2012,47(2):299-307.
[15] Kaya A,Aksoy M,Baspinar N,et al.Effect of melatonin implantation to sperm donor rams on post-thaw viability and acrosomal integrity of sperm cells in the breeding and nonbreeding season[J].Reprod Domest Anim,2001,36(3-4):211-215.
[16] Gao C,Han H B,Tian X Z,et al.Melatonin promotes embryonic development and reduces reactive oxygen species in vitrifled mouse 2-cell embryos[J].J Pineal Res,2012,52(3):305-311.
[17] Papis K,Poleszczuk O,Wenta-Muchalska E,et al.Melatonin effect on bovine embryo development in vitro in relation to oxygen concentration[J].J PinealRes,2007,43(4):321-326.
[18] Abecia J A,Forcada F,Zuniga O.The effect of melatonin on the secretion of progesterone in sheep and on the development of ovine embryos in vitro[J].Vet Res Commun,2002,26(2):151-158.
[19] Wang F,Tian X Z,Zhang L,et al.Beneficial effects of melatonin on in vitro bovine embryonic development are mediated by melatonin receptor 1[J].Journal of Pineal Research,2014,56(3):333-342.
[20] Guérin P,El Mouatassim S,Ménézo Y.Oxidative stress and protection against reactive oxygen species in the pre-implantation embryo and its surroundings[J].Hum Reprod Update,2001,7(2):175-189.
[21] du Plessis S S,Makker K,Desai N R,et al.Impact of oxidative stress on IVF[J].Expert Rev Obstet Gynecol,2008,3(4):539-554.
[22] Tian X,Wang F,He C,et al.Beneflcial effects of melatonin on bovine oocytes maturation:a mechanistic approach[J].J Pineal Res,2014,57(3):239-247.
[23] Hu J,Cheng D,Gao X,et al.Vitamin C enhances the in vitro development of porcine pre-implantation embryos by reducing oxidative stress[J].Reprod Domes Anim,2012,47(6):873-879.
[24] Wang F,Tian X,Zhang L,et al.Beneficial effect of resveratrol on bovine oocyte maturation and subsequent embryonic development after in vitro fertilization[J].Fertil Steril,2014,101(2):577-586.
[25] Wang F,Tian X,Zhang L,et al.Melatonin promotes the in vitro development of pronuclear embryos and increases the ef-fciency of blastocyst implantation in murine[J].J Pineal Res,2013,55(3):267-274.
[26] Sakaguchi K,Itoh M T,Takahashi N,et al.The rat oocyte synthesises melatonin[J].Reprod Fertil Dev,2013,25(4):674-682.
[27] Tamura H,Nakamura Y,Korkmaz A,et al.Melatonin and the ovary:physiological and pathophysiological implications[J].Fertil Steril,2009,92(1):328-343.
[28] Shi J M,Tian X Z,Zhou G B,et al.Melatonin exists in porcine follicular fluid and improves in vitro maturation and parthenogenetic development of porcine oocytes[J].J Pineal Res,2009,47(4):318-323.
[29] Dehghani-Mohammadabadi M,Salehi M,Farifteh F,et al.Melatonin modulates the expression of BCL-xl and improve the development of vitrified embryos obtained by IVF in mice[J].J Assist Reprod Genet,2014,31(4):453-461.
[30] Kumaresan A,Kadirvel G,Bujarbaruah K M,et al.Preservation of boar semen at 18℃induces lipid peroxidation and apoptosis like changes in spermatozoa[J].Anim Reprod Sci,2009,110(1):162-171.
[31] Juknat A A,Mendez Mdel V,Quaglino A,et al.Melatonin prevents hydrogen peroxide-induced bax expression in cultured rat astrocytes[J].J Pineal Res,2005,38(2):84-92.
[32] Martín-Hidalgo D,Barón F J,Bragado M J,et al.The effect of melatonin on the quality of extended boar semen after longterm storage at 17℃[J].Theriogenology,2011,75(8):1 550-1 560.
[33] du Plessis S S,Hagenaar K,Lampiao F.The in vitro effects of melatonin on human sperm function and its scavenging activities on NO and ROS[J].Andrologia,2010,42(2):112-116.
