姜黄素对大肠杆菌攻毒仔猪生长性能和抗氧化性能的影响
2015-03-29赵春萍荀文娟侯冠彧张立岭
赵春萍,荀文娟,侯冠彧*,曹 婷,于 萍,张立岭
(1.海南大学农学院,海南海口570228;2.中国热带农业科学院热带作物品种资源研究所,海南儋州571737)
在现代养猪生产中,仔猪早期断奶是普遍采用的技术之一。但是,在断奶期,由于生理、营养和环境的突然改变,断奶应激及病原微生物侵袭,可引起断奶仔猪采食量下降、生长阻滞和腹泻、肠道绒毛萎缩和隐窝增生、免疫功能降低等,即早期断奶综合症[1-2]。为了提高仔猪的生长性能和抗病能力,抗生素、激素和化学合成药物等物质被广泛应用于饲料添加剂行业,由于这类药物的滥用,反而造成动物体内菌群失调、免疫机能下降及耐药菌株的产生,同时在动物体内的残留也对人体和环境造成危害等[3]。因此,如何有效地降低仔猪早期断奶后腹泻的发生,一直是国内外研究的热点。
姜黄素(Curcumin)是姜黄、郁金等多种植物中提取出来的一种脂溶性酚类色素,具有抗炎、抗氧化、抗感染、抗肿瘤和降脂等广泛的药理作用,且毒副作用很低[4-5]。目前对姜黄素的研究主要集中在对鼠的药理基础方面,作为饲料添加剂在畜禽方面的研究还鲜有报道[6-8]。且尚未见姜黄素对断奶仔猪生长性能和抗氧化性方面的研究。因此,本试验通过研究日粮中添加不同水平的姜黄素对断奶仔猪生长性能和抗氧化性能的影响,旨在掌握日粮中添加姜黄素对早期断奶仔猪生长性能和抗氧化功能的调控效果,对畜牧业健康可持续发展具有重要的现实意义。
1 材料与方法
1.1 试验材料
姜黄素(CUR),选购于美国Sigma公司;喹烯酮,购于大连容海生物科技有限公司。试验攻毒用大肠杆菌(E.coli)选购于国家兽医微生物菌种保藏管理中心,菌种编号为CVCC224。菌种在液体LB培养基中震荡培养12h后,测定其浓度,并于预试期第4天按每头猪总大肠杆菌1×109个细胞分早晚两次给服[9]。按表1要求,评分为2分及以上即为攻毒成功[10]。
1.2 试验动物及试验设计
选取胎次、体重相近的21日龄健康早期断奶“杜×长×大”仔猪40头,公母各半,随机分为4个处理,每个处理10个重复,每个重复1头猪。4个处理基础日粮一致,A组饲喂基础日粮,B组饲喂基础日粮+50mg/kg喹烯酮,C组饲喂基础日粮+200mg/kg CUR,D组饲喂基础日粮+400mg/kg CUR。预试期为7d,正试期为21d。基础日粮组成及营养成分水平见表2。

表1 腹泻状态评分标准Table 1 Scoring criteria of diarrhea
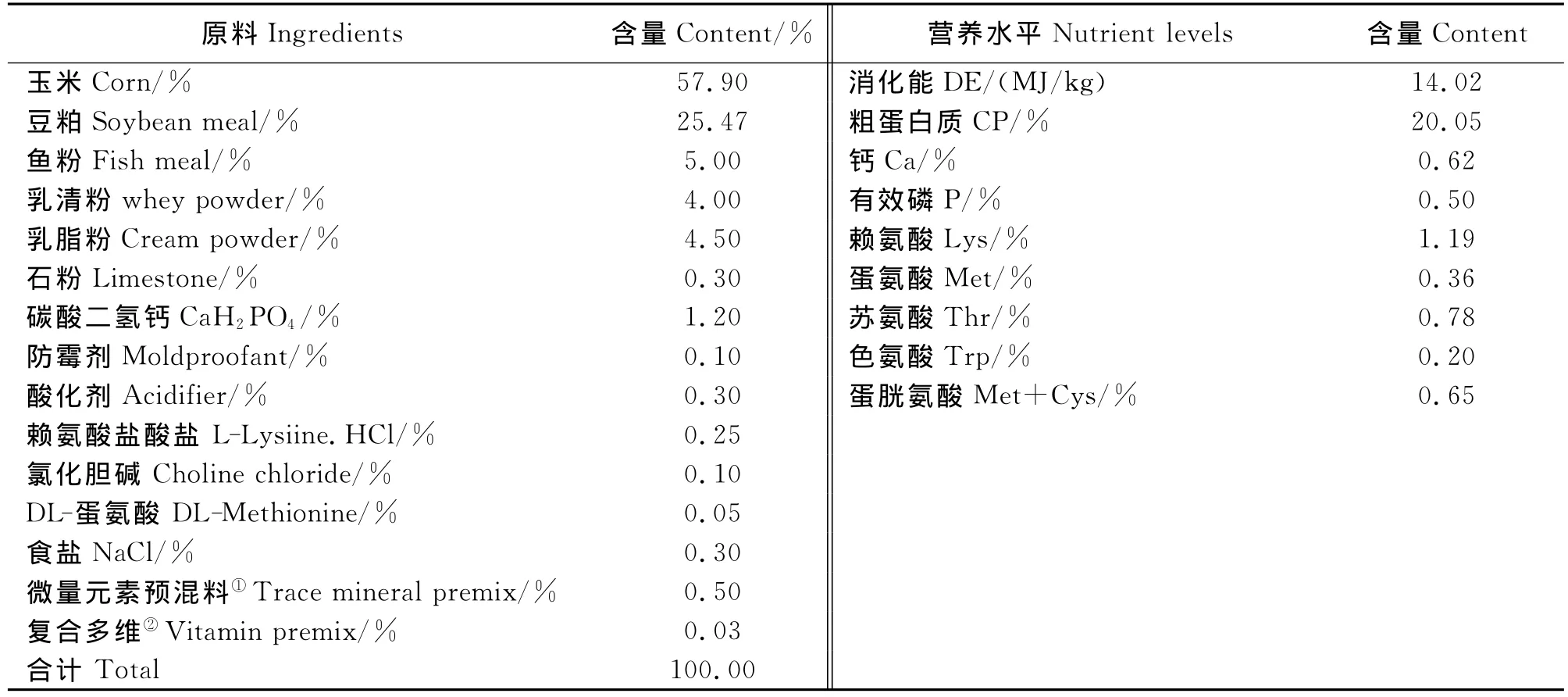
表2 日粮组成及其营养水平Table 2 Composition and nutrient levels of the basal diet
1.3 饲养管理
试验在半封闭猪舍进行,每天9∶00、18∶00两次投料,自由饮水,每次投料前称剩余料重。
1.4 样品采集及指标测定
正试期第1天08∶00对所有仔猪空腹称重并记录(始重),正试期第21天08∶00空腹称重并记录(末重),每日观察猪群生长情况,记录正试期所耗饲粮重,计算平均日增量、平均日采食量及料重比,正试期每次喂料时观察粪便,稀软粪判为腹泻。
正试期第21天,所有试验仔猪空腹前腔静脉采血10mL于真空采血管中,待析出血清后4℃,3 000r/min离心10min,-20℃保存。采用化学比色法测定血清中谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、总抗氧化能力(T-AOC)和过氧化氢酶(CAT)含量,试剂盒购自南京建成生物工程研究所。
1.5 数据处理
采用SPSS 17.0统计软件中的ANOVA程序进行单因素方差分析,差异显著性分析用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准,结果用平均值± 标准差表示。
2 结果与分析
2.1 姜黄素对断奶仔猪生长性能的影响
从表3可以看出,各组ADG和ADFI平均值差异不显著(P>0.05),B和D组F/G显著高于A组(P<0.05),C组合A组差异不显著(P>0.05)。
2.2 姜黄素对断奶仔猪血清抗氧化的影响
从表4可知,B、D组血清GSH-PX、SOD活力和MDA含量均与A组差异显著(P<0.05),而B组与D组、A组与C组无显著性差异(P>0.05);A、B、C组血清T-AOC活力无显著性差异(P>0.05),而D组与其余各组间存在显著性差异(P<0.05);B、C、D组血清CAT活力均与A组差异显著(P<0.05),B组与C、D组无显著性差异(P>0.05),但是C组与D组之间有显著性差异(P<0.05)。

表3 姜黄素对断奶仔猪生长性能的影响Table 3 Effect of curcumin on growth performance of weanling piglets

表4 姜黄素对断奶仔猪血清抗氧化状态的影响Table 4 Effect of curcumin on antioxidant capacity in serum of weaning piglets
3 讨 论
3.1 姜黄素对断奶仔猪生长性能的影响
姜黄素作为饲料添加剂,能有效提高动物的生长性能。王进波等[11]研究发现大黄鱼基础饲粮中添加0.04%姜黄素能显著提高大黄鱼的平均鱼体终重、平均鱼体增重率、成活率,降低饲料系数。崔岩等[12]在艾维茵肉鸡基础日粮中添加姜黄素,同样可以提高肉鸡生产性能。韩刚等[13]以聚乙烯吡咯烷酮为载体制备了姜黄素固体分散体,发现相同剂量的姜黄素,固体分散体形式可以起到更好的效果。王斌等[14]在育肥猪饲粮中添加400mg/kg姜黄素发现,平均日增重显著提高,料重比明显下降,胴体性状也有显著提高。此外,张靖等[15]用姜黄素替代育肥猪饲料中的喹烯酮发现,姜黄素对猪体健康无不良影响,而且对育肥猪生长性能的影响研究上与王斌等[14]有相同的结论。本研究表明,日粮中添加姜黄素可以有效促进断奶仔猪生长,提高采食量,降低料重比,其中添加400mg/kg姜黄素作用效果最好,其作用效果优于50mg/kg喹烯酮。
3.2 姜黄素对断奶仔猪血清抗氧化的影响
动物机体在新陈代谢过程中产生大量的超氧阴离子、过氧化物、氢离子等自由基,这些自由基如不能被及时清除,都可能对机体造成严重的损伤。在正常生理状态下,机体内同时存在着高效、完善的清除自由基系统,可使自由基的产生与清除处于一种动态平衡的状态。SOD、GSH-PX、CAT都是这个系统中的重要组成部分,其中SOD可以将超氧阴离子转化为过氧化物,之后GSH-PX、CAT会立即将其分解为无害的水[16]。MDA则是脂质过氧化反应过程的稳定终产物,具有一定的细胞毒性,其含量的高低反应了氧自由基介导的脂质过氧化程度[17]。而T-AOC可以体现机体内抗氧化大分子、抗氧化小分子和酶的抗氧化活性。这些指标可以全面直观的表现出动物机体的抗氧化能力的高低。
本试验结果表明,日粮中添加姜黄素可以有效的提高断奶仔猪机体的抗氧化能力,添加400mg/kg姜黄素组的作用效果显著(P<0.05)言于喹烯酮组。这与一些之前的研究结果相似,李婉雁等[18]报道添加5.00g/kg的姜黄粉能够显著提高快大型岭南黄鸡血清中SOD、CAT和GSH-PX的活力,降低MDA含量,从而提高黄鸡的抗氧化能力。胡忠泽等[19]研究发现,在日粮中添加250mg/kg姜黄素,肉鸡体内抗氧化酶SOD、CAT和GSH-PX的活性升高,MDA和NO含量下降。韩刚等[13]则发现,将姜黄素制成固体分散体同样可以高肉鸡的抗氧化性能,且作用效果比添加同剂量姜黄素更好。
4 结 论
本研究结果表明,在日粮中添加400mg/kg姜黄素可促进仔猪生长、提高机体抗氧化能力,其作用效果优于50mg/kg喹烯酮。
[1] Manashi B D,Mark M B S,Case W B S.The acute and chronic stress-induced oxidative gastrointestinal injury in rats,and the protective ability of anovel grape seed proanthocyanidin extract[J].Nutri Res,1999,19(8):1 189-1 199.
[2] 朱 翠,蒋宗勇.谷氨酰胺对早期断奶仔猪肠粘膜免疫的调节作用[J].中国畜牧兽医,2011,38(8):10-16.
[3] 谷 娟,许丛丛,蔡 旋,等.复合多肽对早期断奶仔猪生长性能、血液理化指标和肠道主要菌群数量的影响[J].动物营养学报,2013,25(3):579-586.
[4] Radhakrishna P G,Srivastava A S,Hassanein T I,et al.Induction of apoptosis in human lung cancer cells by curcumin[J].Cancer Lett,2004,208(2):163-170.
[5] Khor T O,Keum Y S,Lin W,et al.Combined inhibitory effects of curcumin and phenethyl isothiocyanate on growth of human PC-3prostate xenografts in immunodeficient mice[J].Cancer Res,2006,66(2):613-621.
[6] 贾盛华.新生大鼠坏死性小肠结肠炎模型建立及姜黄素对其防治机制的研究[D].重庆:重庆医科大学,2010:22-33.
[7] 王 改.姜黄素对肠单层上皮氧化应激损伤的保护作用[D].河北石家庄:河北医科大学,2010:23-35.
[8] Zhang M,Deng C S,Zheng J J,et al.Curcumin regulated shift from Th1to Th2in trinitrobenzene sulphonic acid-induced chronic colitis[J].Acta Pharmacol Sin,2006,27(8):1 071-1 077.
[9] 肖定福,唐志如,印遇龙.壳聚糖对大肠杆菌攻毒仔猪生长性能和免疫力的影响[J].动物营养学报,2011,23(10):1 783-1 789.
[10] 廖波.25-OH-D3对免疫应激断奶仔猪的生产性能、肠道免疫功能和机体免疫应答的影响[D].重庆:四川农业大学,2009:28.
[11] 王进波,吴天星.姜黄素在大黄鱼饲料中的应用效果研究[J].水利渔业,2007,27(6):110-111.
[12] 崔 岩,祝国强,侯风琴,等.姜黄素对肉鸡生产性能和生化指标的影响[J].畜牧与兽医,2010,42(8):48-50.
[13] 韩 刚,郭肖菲,肖 倩,等.姜黄素固体分散体对肉鸡血脂和抗氧化能力的影响[J].饲料工业,2011,32(11):34-35.
[14] 王 斌,侯风琴,祝国强,等.姜黄素对育肥猪生产性能、肉品质及胴体参数的影响[J].畜牧与兽医,2010,42(7):51-54.
[15] 张 靖,王井亮,周 明,等.姜黄素替代喹烯酮在肥育猪应用效果的研究[J].养猪,2011(4):49-51.
[16] 宋志学,杜天玺,孙红国,等.红芪粗多糖对免疫应激断奶仔猪生长性能、血清生化指标和抗氧化能力的影响[J].动物营养学报,2013,25(5):1 062-1 068.
[17] 王红丽,吴 铁.皮肤衰老分子生物学机制的研究进展[J].国外医学-皮肤性病学分册,2003,29(9):114-116.
[18] 李婉雁,陈国开,庞木生,等.姜黄粉对岭南黄鸡生产性能、免疫器官指数和抗氧化能力的影响[J].仲恺农业工程学院学报,2010,23(3):40-43.
[19] 胡忠泽,李敏娜,胡元庆.姜黄素对肉鸡体内抗氧化酶活性及NO含量的影响[J].饲料研究,2012(8):10-12.
