重症急性胰腺炎大鼠肺损伤的病理生理变化及机制研究
2015-03-29李欢李清怀李筱雨严丽张霖雷
李欢 李清怀 李筱雨 严丽 张霖雷
急性肺损伤(acute lung injury,ALI)是重症急性胰腺炎(severe acute pancreatitis,SAP)时最常见的并发症,其中,一部分患者进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),是 SAP 患者早期死亡的主要原因[1]。目前,对重症急性胰腺炎合并急性肺损伤的自然发病的详细过程还不甚明了,尤其是对其肺功能损伤的自然病程还没有一个完整的监测,其确切的发病机制也很不清楚。本文通过人工诱导建立大鼠SAP模型,在零干预的情况下,系统完整的监测SAP合并ALI的病理生理演变过程及肺损伤的发生率及程度,动态观察反映肺损伤的各项指标,为临床提供诊疗参考。
1 材料与方法
1.1 实验动物 于2008年1月至2009年1月选取健康雄性SD大鼠240只(购自河北医科大学实验动物中心)为观察组研究对象,清洁级,体重250~300 g,平均体重(274.2 ±12.4)g,月龄1 ~3 个月,平均(1.8±0.9)个月。按照随机数字表将240只大鼠随机均分为 SAP 不同时间点组(SAP 1 h、3 h、6 h、9 h、12 h、18 h、24 h组,观察组)和对照组,每组30只。各组大鼠体重、月龄等一般资料比较差异无统计学意义(P>0.05)。
1.2 模型制备 大鼠实验前14 h开始禁食,自由饮水,参照Aho等[2]的方法制备SAP模型。10%水合氯醛(3 ml/kg)腹腔内注射麻醉,上腹正中切口进入腹腔,显露胰胆管,以血管夹阻断近肝门处胰胆管后,用4 G钝头头皮静脉针于十二指肠乳头附近经十二指肠肠系膜壁穿刺,逆行插入胰胆管,在十二指肠乳头处用无创血管夹夹闭胆总管末端,将3.5%牛磺胆酸钠溶液用微量注射器按0.1 ml/100 g以恒速(0.1 ml/min)注入胰胆管,注射完毕后于注射孔捏闭胰胆管5 min,去掉血管夹,常规关腹。对照组大鼠进入腹腔后仅翻动十二指肠部数次即关腹。造模后,所有大鼠均皮下注射0.9%氯化钠溶液5 ml,以补充血容量的不足。每组大鼠 SAP模型制备成功后于 1 h、3 h、6 h、9 h、12 h、18 h和24 h分批取材。
1.3 观察指标 (1)血清淀粉酶;(2)肺组织湿干重比:肺组织湿/干重比=(肺湿重-肺干重)/肺干重;(3)肺髓过氧化物酶(MPO)活性:湿重=(测定管OD值-对照管OD值)/11.3×取样量(g);(4)肺通透性指数:肺通透性指数=血清蛋白浓度/肺泡灌洗液蛋白浓度。
1.4 肺损伤病理学评分 每张病理切片随机选择3个高倍视野(×400)分别评分,然后取平均值为此切片的得分。肺组织学评分按改良的Aho等[2,3]的标准进行评分。见表1。

表1 肺损伤病理学评分标准
1.5 统计学分析 应用SPSS 16.0统计软件,计量资料以表示,正态资料采用Oneway ANOVA,偏态资料采用秩和检验,相关性分析采用Spearman秩相关,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠血清淀粉酶检测 对照组大鼠血清淀粉酶含量为(596.9 ± 248.13)U/L,观察组 1 h、3 h、6 h、9 h、12 h、18 h 和24 h 组分别为(1 437.9 ±331.97)、(2 052.0 ±290.44)、(3 152.9 ±301.39)、(4 944.58±308.545)、(5 162.8 ±315.98)、(8 236.7 ±381.97)和(11 800.0 ±200.75)U/L;观察组各时间点组与对照组比较差异有统计学意义(P<0.05),观察组各时间点组内除9 h与12 h组外比较差异均有统计学意义(P<0.05)。
2.2 大鼠肺组织的病理学变化
2.2.1 肉眼观察:对照组肺组织肉眼观察正常,无胸水。观察组1 h组肺组织轻度水肿,无明显胸水。3 h组观察肺组织水肿较前加重,肺表面颜色变红,少量黄色胸水。6 h组肺组织水肿加剧,肺表面可见散在小出血点。9 h组肺组织水肿更重,胸腔积液量增加,肺表面颜色暗红,出血点增多。12 h组肺水肿更重,肺组织表面可见空泡及斑片状出血,大量混浊胸腔积液。18 h组肺组织肿胀,表面局部萎陷,出血坏死范围增大,胸腔积液淡血性。24 h组肺组织肿胀严重,弥漫出血坏死,血性胸腔积液。见图1、2。

图1 正常大鼠肺组织(HE×400)
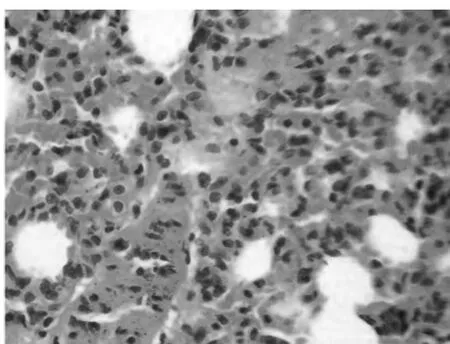
图2 SAP大鼠24 h后肺组织(HE×400)
2.2.2 光镜下观察:对照组肺组织结构基本正常。观察组1 h组肺间质轻度水肿、充血,单核细胞及少量中性粒细胞浸润。3 h组肺间质水肿、充血更明显,中性粒细胞浸润增多。6 h组间质水肿、充血更重,大量炎细胞浸润,偶见肺泡内出血。9 h组肺间质广泛水肿、充血及炎细胞浸润,肺泡内出血增多。12 h组肺组织结构紊乱,部分肺泡融合,间质出血、水肿严重,肺泡及气管内出血,大量中性粒细胞浸润。18 h组可见部分肺泡塌陷,灶性肺不张。24 h组可见片状肺不张,部分肺泡透明膜形成。
2.3 大鼠肺损伤相关指标变化 观察组大鼠肺损伤组织评分随时间延续逐渐升高,各时间点组均明显高于对照组(P<0.05),观察组内各时间点之间比较差异均有统计学意义(P<0.05)。观察组大鼠肺组织湿干重比随时间的延续呈逐渐增加趋势,除观察组1 h组肺湿/干重比与对照组差异无统计学意义外其余观察组各组与对照组比较差异均有统计学意义(P<0.05)。观察组肺通透性指数随时间延续呈逐渐降低趋势,均低于对照组,差异均有统计学意义(P<0.05),观察组内各时间点之间除18 h和24 h组外比较差异均有统计学意义(P<0.05)。观察组肺髓过氧化物酶(MPO)水平随时间延续持续升高,明显高于对照组,差异均有统计学意义(P<0.05),观察组组内各时间点之间比较差异均有统计学意义(P<0.05)。见表2。
2.4 相关性分析 肺组织MPO水平与肺损伤评分存在正相关(r=0.946,P<0.01),肺湿干重比与肺损伤评分成正相关(r=0.879,P<0.01),肺通透性指数与肺损伤评分存在负相关(r=-0.859,P<0.01)。
表2 重症急性胰腺炎大鼠肺损伤的病理生理变化情况n=30,±s

表2 重症急性胰腺炎大鼠肺损伤的病理生理变化情况n=30,±s
注:与对照组比较,*P <0.05;与术后1 h组比较,#P <0.05;与术后1 h组比较,△P <0.05;与术后6 h组比较,☆P <0.05;与术后9 h组比较,▲P <0.05;与术后12 h组比较,★P <0.05;与术后18 h组比较,□P <0.05
?
3 讨论
SAP是临床常见的急腹症之一,它不仅引起胰腺本身及胰周的炎性肿胀、渗出和坏死,而且常导致全身重要脏器功能的损害,是一种发病急、进展快、并发症多、死亡率高的严重疾病,死亡率可达20% ~40%。SAP时常并发MODS,成为SAP的主要死亡原因。其中,SAP并发ALI的发病率占合并多器官功能衰竭的首位[1]。SAP并发ALI病情凶险,病死率高,其发病机制较为复杂。
ALI和ARDS是急性胰腺炎导致腹外器官功能不全最常见的表现,有作者称之为急性胰腺炎相关性肺损 伤 (acutepancreatitis associated lung injury,APALI)[4]。ALI/ARDS是在严重感染、休克、创伤及烧伤等非心源性疾病过程中,肺毛细血管内皮细胞和肺泡上皮细胞损伤造成弥漫性肺间质及肺泡水肿,导致的急性低氧性呼吸功能不全或衰竭。以肺容积减少、肺顺应性降低、严重的通气/血流比例失调为病理生理特征,临床上表现为进行性低氧血症和呼吸窘迫。ALI/ARDS的基本病理生理改变是肺泡上皮和肺毛细血管内皮通透性增加所致的非心源性肺水肿。由于肺泡水肿、肺泡塌陷导致严重通气/血流比例失调,特别是肺内分流明显增加,从而产生严重的低氧血症[5]。
SAP时,中性粒细胞聚集激活是引起肺部毛细血管和肺泡受损的主要原因。正常情况下,间质内中性粒细胞(poly-morphonuclear neutrophil,PMN)数量相当少。在SAP时发生SIRS,循环血液中的各种细胞因子如 IL-1、IL-6、IL-8、TNF-α 和炎性介质诱导肺中性粒细胞、单核巨噬细胞激活,引起ALI,早期肺细胞产生多种趋化物质如血小板活化因子(PAF)、TNF-α、补体C5a,趋化激活中性粒细胞、单核和淋巴细胞,使大量PMN迁移、聚集于肺循环中,粘附于肺毛细血管表面并释放一系列损害内皮细胞的有害物质[6,7]。
本文使用3.5%牛磺胆酸钠溶液逆行注射大鼠胰胆管[8],制备大鼠SAP模型,SAP 1 h组血清淀粉酶比对照组明显升高(P<0.05),表示SAP模型建立成功。SAP发生后,随着SAP病程的进展,肺组织的损伤逐渐加重,APALI的严重程度与胰腺病变程度密切相关,这与相关文献报道相符合。实验结果证实:SAP大鼠1 h已有肺间质轻度水肿、充血,单核细胞及少量中性粒细胞浸润,反映中性粒细胞浸润程度的指标MPO活性显著增高,这表明肺脏在SAP后1 h时已经有了一定程度的损伤,且病理学评分明显高于对照组(P<0.05)。随着时间的推移肺组织呈现出典型的ALI病理生理改变,病理学评分逐渐升高,SAP 3 h至12 h肺间质水肿、充血,肺实质水肿、出血,中性粒细胞浸润逐渐加重;到18 h组可见部分肺泡塌陷,灶性肺不张;24 h组可见肺泡透明膜形成。
MPO是中性粒细胞(PMN)特有的还原酶,它主要存在于PMN的嗜天青颗粒中,能催化H2O2与CL-形成次氯酸,次氯酸具有明显的细胞毒作用[9]。而且每个细胞所含MPO的量是恒定的,故而可通过测定组织MPO活性来反映PMN的数目,肺组织PMN细胞数目与肺组织中的MPO的活力成正比。通过测定MPO的活力,可以明确PMN在肺组织中浸润的程度,也可以了解MPO对组织造成的损伤。本研究结果显示,对照组MPO活性很低,SAP制模后1 h时肺组织MPO活性明显增加(P<0.05),且随时间延长其增加更显著,并且肺组织MPO活性与肺损伤评分存在正相关(r=0.946,P<0.01),说明 SAP 1 h 时肺组织中已出现中性粒细胞的扣押与聚集,并已造成肺组织的损伤,并随时间延长SAP组肺组织中PMN的浸润愈发增多。目前认为中性粒细胞的激活并浸润到胰腺及胰腺外组织,通过呼吸爆发释放出大量氧自由基、蛋白水解酶等毒性物质是胰腺炎加重并伴发MOF的主要因素[10]。激活的PMN释放的大量炎性介质和细胞因子,进一步损伤微血管内皮细胞,破坏内皮细胞的完整性,最终引起肺肺血管通透性增加,造成肺间质水肿、出血,肺出血坏死及肺泡透明膜形成。所以,临床可以用MPO作为炎性细胞浸润的检测指标。
肺通透性指数和肺组织湿干重比是衡量肺损伤程度的重要指标。可反映肺组织的水肿、渗出程度。本研究结果显示随着SAP的发生,肺组织湿干重比逐渐升高,肺通透性指数逐渐降低,提示肺损伤逐渐加重,表现为肺毛细血管内皮和肺泡上皮通透性增加,导致非特异性的肺水肿、肺间质炎性细胞浸润,并伴有肺毛细血管充血,富含蛋白的水肿液渗出到间质和肺泡中,与纤维素、变性坏死脱落的I型上皮细胞和基膜共同形成透明膜。最初由夏淑晶等[11]报道,在雨蛙肽诱导的大鼠AP模型中,ALI特征包括:3 h时肺泡毛细血管通透性增加1.8倍,肺湿重增加1.5倍;6 h时肺泡间质明显出血,血管内皮细胞破坏。假手术组相应的肺组织的湿干重比及肺通透性指数也低,肺组织未出现损伤。SAP组相应的肺湿干重比及肺通透性指数相应增高,肺病理改变加重。且本研究得出肺湿干重比与肺病理学评分二者存在正相关(r=0.879,P<0.01),肺通透性指数与肺病理学评分二者存在负相关(r=0.859,P<0.01)。
综上所述,SAP大鼠肺损伤的发生率及损伤程度随SAP病程延长而逐渐增加,肺组织MPO水平持续升高。随着人们对SAP、MODS及APALI的发病机制的深入了解,特别是对早期SIRS调控机制研究的不断进展,我们将会对SAP肺损伤的发生、发展过程有更加清晰的认识。
1 Chooklin S.Pathogenic aspects of pulmonary complications in acute pancreatitis patients.Hepatobiliary Pancreat Dis Int,2009,8:186-192.
2 Aho HJ,Kosensalo SML,Nevalainen TJ.Experimental pancreatitis in the rat.Scand J Gastroenterol,1980,15:411-416.
3 Osman MO,Kristensen JU,Jacobsen NO,et al.A monoclonal anti-interleukin 8 antibody(WS-4)inhibits cytokine response and acute necrotising pancreatitis in rabbits.Gut,1998,43:232-239.
4 谢俊锋,徐萍.急性胰腺炎相关性肺损伤发病机制研究进展.国际消化病杂志,2008,28:449-451.
5 陈瑜,黄中伟,沈雁波.SP-A在急性坏死性胰腺炎肺损伤大鼠的表达和意义.重庆医学,2011,40:2497-2498.
6 Yang SQ,Xu JG.Effect of glutamine on serum interleukin-8 and tumor necrosis factor-alpha levels in patients with severe pancreatitis.Nanfang Yike Daxue Xuebao,2008,28:129-131.
7 徐毅晖,陈垦,崔淑兰,等.促炎和抗炎因子在急性胰腺炎发病机制中的研究进展.世界华人消化杂志,2010,18:1912-1918.
8 熊玉霞,周业江,孟宪丽,等.急性胰腺炎相关性肺损伤模型的建立.医药论坛杂志,2009,30:7-8.
9 Rakonczay Z,Hegyi P,Takacs T,et al.The role of NF-kappaB activation in the pathogenesis of acute pancreatitis.Gut,2008,57:259-267.
10 刘丙刚.重症急性胰腺炎致肺损伤发病机制研究进展.现代医药卫生,2010,26:393-395.
11 夏淑晶,许春芳.MG132对雨蛙肽诱导的小鼠急性胰腺炎相关性肺损伤的影响.江苏医药,2009,35:202-204.
