基于微通道的ZnO 纳米棒生物荧光检测研究*
2015-03-27刘向飞赵振杰
刘向飞,蒋 栋,赵振杰,李 欣
(1.华东师范大学 纳光电集成与先进装备教育部工程研究中心,上海200062;2.华东理工大学 分析测试中心,上海200237)
0 引 言
氧化锌(ZnO)纳米材料作为一种II-VI 族半导体纳米材料,具有较好的光学和电学响应,被广泛用于太阳能电池、紫外传感器、场发射器件等[1]。同时,ZnO 纳米材料还具有比表面积高、电子迁移率高、电化学活性和化学稳定性等特点,可结合场效应管[2]、压电效应[3]、电化学检测[4]、光学检测[5]等技术研制不同类型高灵敏度的生物传感器。近年来,多项研究工作表明:ZnO 纳米材料在生物医学检测的应用上得到了快速发展[6],具有广阔的应用前景。其中,一维ZnO 纳米材料能提高荧光检测性能[7,8],用于研制新型的生物荧光检测器,深化了荧光检测在生物学、疾病诊断等领域的应用[9,10]。然而,不断发展的高通量检测对ZnO 纳米材料的制备工艺、器件集成提出了新的要求。
目前,ZnO 纳米材料的制备主要包括水热法[11]、化学气相沉积法[12]、电化学沉积法[13]等。其中,水热法具有成本低廉、工艺简单、可操作性强等特点[14],便于工艺的集成与器件的研制。然而常规水热法合成中,反应物会不断消耗,只能通过更换生长液来获得较长的纳米棒。目前,在微流控芯片中合成ZnO 纳米棒,生长溶液可不断更新,有利于保持反应物浓度的稳定,从而获得较长的ZnO 纳米棒,并用于检测pH 值、研制气体传感器等[15,16]。同时,微流控芯片具有微型化、消耗少、便于集成等特点,与传统荧光检测器件相比,集成了纳米材料的高灵敏度芯片传感器具有突出的优势,是生物检测技术发展的重要方向[17]。
本文提出在具有阵列式微通道的微流控芯片中,利用种子法和水热合成技术制备ZnO纳米棒,通过对样品的表征和测试,比较并分析了采用常规条件和微通道芯片制备的ZnO 纳米棒的结构和形貌特征。同时,本文建立了基于阵列式微通道的ZnO 纳米棒生物荧光检测方法,以异硫氰酸荧光素标记的羊抗牛IgG 抗体为例对ZnO 纳米棒的荧光检测性能进行了研究。
1 实 验
1.1 试 剂
其中,六水硝酸锌(Zn(NO3)2·6H2O)、六亚甲基四胺(HMTA)、二水乙酸锌(C4H6O4Zn·2H2O)、氨水(NH3·H2O)购自国药集团化学试剂有限公司,聚乙烯醇(PVA)、聚醚酰亚胺(PEI)购自美国Sigma-Aldrich 公司,异硫氰酸荧光素标记的羊抗牛IgG 抗体(FITC-antiIgG)购于美国ImmunoReagents公司。
1.2 种子层的制备
采用溶胶—凝胶法和旋涂法制备ZnO 种子层。方法如下:首先,称取0.25 g PVA 溶解于5 mL 去离子水中,70 ℃下搅拌1 h 形成透明液体;冷却后加入0.05 g 的乙酸锌,室温下搅拌2 h 得到种子溶液。然后,将种子溶液旋涂在载玻片上,转速为3 000 rpm,时间为1 min。最后,将得到的薄膜在500 ℃下热处理3 h,得到ZnO 的种子层。
1.3 ZnO 纳米棒的制备
本文采用水热法分别用在常规条件下和微通道中制备ZnO 纳米棒。
ZnO 生长溶液的制备:分别将0.744 g Zn(NO3)2·6H2O,0.175 g HMTA,0.4 g PEI 溶解于100 mL 去离子水中,再缓慢加入1.5 mL NH3·H2O 搅拌均匀并调节pH 值至10.6。
常规条件下水热法制备ZnO 纳米棒:将种子层基底正面向下放入生长溶液中,距离容器底部约1 cm 处,在90 ℃温度下生长3 h。最后取出样品用去离子水冲洗并用氮气吹干。
微通道中水热法制备ZnO 纳米棒:具有阵列微通道结构的微流控芯片是用软光刻工艺制备的。芯片模板购自武汉介观生物科技有限责任公司,通道长度为1.5 cm,宽度为500 μm,高度为50 μm。制备ZnO 纳米棒时,将聚二甲基硅氧烷(PDMS)通道用氧等离子体处理后置于ZnO 种子层上方并密封(图1)。其后,用注射泵(流速为10 μL/min)将生长溶液通入微通道中,在90 ℃温度下生长3 h。最后,用去离子水冲洗通道并用氮气吹干,得到ZnO 纳米棒阵列。
1.4 样品的表征
采用原子力显微镜(AFM,Nano Wizard II)分析ZnO 种子层表面形貌,使用扫描电子显微镜(SEM,Hitachi S—4800)和X 射线衍射仪(XRD,Rigaku,Ultima IV)分别对ZnO 纳米棒的表面形貌和晶体结构的特性进行表征。

图1 微流控芯片中制备ZnO 纳米棒阵列的示意图Fig 1 Diagram of ZnO nanorods arrays fabricated by microfluidic chip
1.5 FITC-antiIgG 的检测
将FITC-antiIgG 溶于pH 值为7.4 的磷酸盐缓冲液(PBS)中,配置不同浓度的FITC-antiIgG 溶液(1×10-6~100 μg/mL),以5 μL/min 的流速通入微通道中,10 min 后用PBS 和去离子水清洗并用氮气吹干。所有样品采用荧光显微镜(重庆奥特BDS200—FL)观察,对所得图像用imageJ 进行处理,分析荧光强度。
2 结果与讨论
2.1 ZnO 纳米棒的表征分析
为研究微通道中制备的ZnO 纳米棒形貌特征,分析与常规条件下制备样品的差异,本文利用SEM 对两种条件制备的ZnO 纳米棒形貌进行了表征,如图2 所示。分析SEM照片可得,常规条件下制备的ZnO 纳米棒的平均直径、长度分别为0.05,1.26 μm,取向稍显杂乱。微通道中制备的ZnO 纳米棒的平均直径、长度分别为0.1,10 μm,且垂直于基底生长。微通道中制备的纳米棒的长度和直径均有显著增加,且密度较小。造成尺寸差异的主要原因是在常规条件下制备ZnO 纳米棒时,基底表面反应物的更新主要依靠扩散来完成。然而在微通道中制备ZnO 纳米棒时,反应物的更新主要依靠生长液的灌流,使生长表面保持较稳定的浓度。所以,ZnO 纳米棒的直径和长度均有显著增加。同时,邻近的纳米棒出现了融合生长的现象,导致其密度降低,并于底部逐渐融合成薄膜。

图2 不同合成条件下ZnO 纳米棒的SEM 图Fig 2 SEM images of ZnO nanorods synthesized in various conditions
为了分析制备的ZnO 纳米棒的晶体结构,本文对两种合成条件下的ZnO 纳米棒进行了X 射线衍射分析,如图3所示,两种ZnO 纳米棒具有相似的XRD 图谱。通过对比标准谱图(JCPDS NO.36—1451),两种合成条件下的ZnO 纳米棒均为六方纤锌矿结构,(002)方向的衍射峰最强,说明其良好的c 轴取向性和结晶度。微通道中制备的ZnO 纳米棒的(002)衍射峰强度约为常规方法的4 倍,表明微通道在制备c 轴取向性好的ZnO 纳米棒方面更有优势。
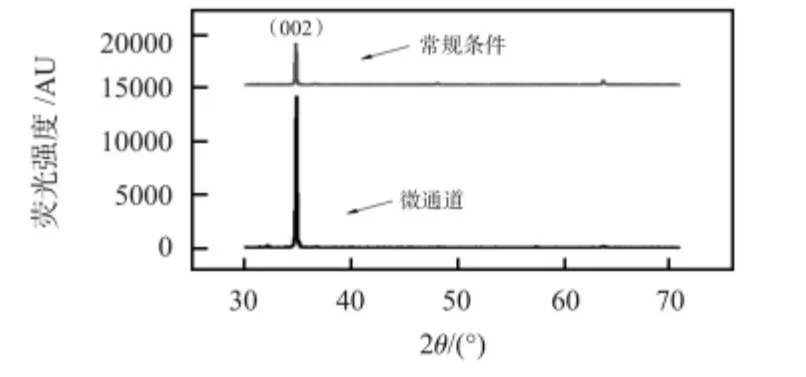
图3 不同合成条件下ZnO 纳米棒的XRD 图Fig 3 XRD patterns of ZnO nanorods synthesized in different conditions
2.2 ZnO 纳米棒荧光检测性能分析
本文以10 μg/mL 的FITC-antiIgG 为模型分子研究了ZnO 纳米棒的荧光检测性能。首先,分别以玻璃、ZnO 种子层、微通道中制备的ZnO 纳米棒为载体,在微通道中对蛋白的荧光强度进行了检测,如图4(a)所示。可见,玻璃和ZnO种子层载体上观察不到荧光信号,而微通道中制备的ZnO纳米棒载体的荧光信号清晰可见。从荧光强度的分布(图4(b))也可以发现,玻璃和ZnO 种子层上的荧光强度与背景信号相似,而微通道中制备的ZnO 纳米棒荧光信号显著增强,是蛋白样品的良好载体。
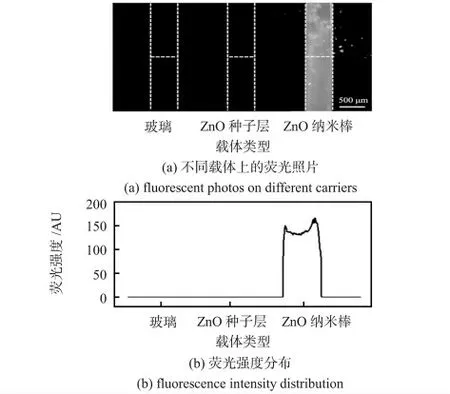
图4 不同载体上FITC-antiIgG 的荧光照片与荧光强度分布Fig 4 Fluorescent photos and fluorescence intensity profile of FITC-antiIgG on different carriers
本文还利用阵列式微通道制备的ZnO 纳米棒在各通道中检测不同浓度FITC-antiIgG 的荧光强度,如图5 所示。通道1~11 的检测浓度分别为0,1×10-6,1×10-5,1×10-4,1×10-3,0.01,0.1,1,10,50,100 μg/mL。从图5(a),(b)中可以看出:随着蛋白浓度从0 增加到100 μg/mL,荧光强度也随之增强。通过分析荧光强度(图5(c))可以发现,利用ZnO 纳米棒检测蛋白,在低浓度范围内有很好的响应。当蛋白浓度为1×10-6,1×10-5μg/m 时,荧光信号强度接近于背景信号。浓度在1×10-4~10 μg/mL 范围内,如图5(c)中插图所示,荧光强度与蛋白浓度的对数值基本呈线性变化,检测限为10-4μg/mL。浓度继续增大到50 μg/mL 后,荧光强度达到最大值。实验结果表明:微通道中制备的ZnO 纳米棒可用于生物蛋白的检测,具有较高的检测灵敏度。此外,运用阵列式微通道的芯片,可同时检测多种样品,减少样品消耗,降低检测成本。

图5 ZnO 纳米棒上FITC-antiIgG 的荧光照片、荧光强度分布及荧光强度随浓度的变化Fig 5 Fluorescent photos intensity profiles of FITC-antiIgG on ZnO nanorods platform change of fluorescence intensity with concentration
ZnO 纳米棒载体荧光增强效应的机制主要包括两个方面。首先,ZnO 纳米棒具有高等电点,在中性缓冲液中,ZnO 纳米棒表面富集正电荷,是检测生物分子的优良载体[6];其次,ZnO 纳米棒作为波导传输光信号时,光场沿轴向传播,在纳米棒外部形成消逝场,使穿透深度范围内的荧光分子得到更强的激发[18]。和常规方法相比,微通道中制备的ZnO 纳米棒的直径和长度较大,比表面积高,有利于蛋白吸附。同时,微通道中制备的ZnO 纳米棒结晶性和取向性更好,有利于光传输和荧光信号检测,对检测低浓度样品具有重要作用。
3 结 论
本文利用水热法,在阵列式微通道中制备了ZnO 纳米棒,建立了一种基于微通道的生物荧光检测方法,并研究了ZnO 纳米棒的荧光检测性能,对FITC-antiIgG 的检测限可达1×10-4μg/mL。结果表明:和常规条件下制备的ZnO 纳米棒相比,微通道中制备的ZnO 纳米棒的比表面积、结晶性和c 轴取向性均有较大提高,可显著增强荧光信号。利用阵列式微通道芯片可同时检测多种样品,提高检测效率,为研制高通量、高灵敏度生物荧光检测传感器提供了一种新方法和研究依据。
[1] Wang Z L.ZnO nanowire and nanobelt platform for nanotechnology[J].Materials Science and Engineering R,2009,64:33-71.
[2] Hagen J A,Kim S N,Bayraktaroglu B,et al.Biofunctionalized zinc oxide field effect transistors for selective sensing of riboflavin with current modulation[J].Sensors,2011,11(12):6645-6655.
[3] Wang X,Yu H,Lu D,et al.Label free detection of the breast cancer biomarker CA15.3 using ZnO nanorods coated quartz crystal microbalance[J].Sensors and Actuators B:Chemical,2014,195:630-634.
[4] Nam Y K,Park J,Kim Pak Y K,et al.Aptamer-based immunosensor on the ZnO nanorods networks[J].Journal of Nanoscience and Nanotechnology,2012,12:5547-5551.
[5] Park H,Go H,Kalme S,et al.Protective antigen detection using horizontally stacked hexagonal ZnO platelets[J].Analytical Chemistry,2009,81(11):4280-4284.
[6] Arya S K,Saha S,Ramirez-Vick J E,et al.Recent advances in ZnO nanostructures and thin films for biosensor applications:Review[J].Analytica Chimica Acta,2012,737:1-21.
[7] Dorfman A,Kumar N,Hahm J.Highly sensitive biomolecular fluorescence detection using nanoscale ZnO platforms[J].Langmuir,2006,22(11):4890-4895.
[8] Singh M,Song S,Hahm J.Unique temporal and spatial biomolecular emission profile on individual zinc oxide nanorods[J].Nanoscale,2013,6(1):308.
[9] Hahm J.Zinc oxide nanomaterials for biomedical fluorescence detection[J].Journal of Nanoscience and Nanotechnology,2014,14(1):475-486.
[10]Hu W,Lu Z,Liu Y,et al.A portable flow-through fluorescent immunoassay lab-on-a-chip device using ZnO nanorod-decorated glass capillaries[J].Lab on a Chip,2013,13(9):1797.
[11]Liu B,Zeng H C,et al.Hydrothermal synthesis of ZnO nanorods in the diameter regime of 50 nm[J].Journal of the American Chemical Society,2003,125(15):4430-4431.
[12]Han N,Hu P,Zuo A,et al.Photoluminescence investigation on the gas sensing property of ZnO nanorods prepared by plasma-enhanced CVD method[J].Sensors and Actuators B:Chemical,2010,145(1):114-119.
[13]Qiu J,Guo M,Feng Y,et al.Electrochemical deposition of branched hierarchical ZnO nanowire arrays and its photoelectrochemical properties[J].Electrochimica Acta,2011,56(16):5776-5782.
[14]李 琛,周 明,沈 坚.水热法制备不同形貌的氧化锌纳米结构[J].功能材料,2011,42(7):1327-1331.
[15]Kim J,Li Z,Park I.Direct synthesis and integration of functional nanostructures in microfluidic devices[J].Lab on a Chip,2011,11(11):1946.
[16]胡 杰,邓 霄,桑胜波,等.微流控技术制备ZnO 纳米线阵列及其气敏特性[J].物理学报,2014(20):207101-207102.
[17]Yeo L Y,Chang H C,Chan P P.et al.Microfluidic devices for bioapplications[J].Small,2011,7(1):12-48.
[18]Börner S,Rüter C E,Voss T,et al.Modeling of ZnO nanorods for evanescent field optical sensors[J].Physica Status Solidi A,2007,204(10):3487-3495.
