灰飞虱2种热激蛋白基因Hsp70的克隆、分析
2015-03-26陆明星祝树德
张 青, 陆明星, 祝树德
(1.扬州大学园艺与植物保护学院,江苏 扬州 225009;2.苏州市农业科学院,江苏 苏州 215155)
灰飞虱[Laodelphax striatellus(Fallén)]属半翅目飞虱科,是水稻等粮食作物的重要害虫,既能直接刺吸危害,又能通过传播水稻条纹叶枯病毒(Rice stripe virus,RSV)等引起间接危害,造成严重的产量损失[1-4]。热激蛋白(Heat shock proteins,Hsp)作为细胞的重要组成成分几乎在所有的生物体都有存在,Hsps有的还受到多种胁迫的诱导,如高温、低温、干燥、缺氧、杀虫剂、重金属、饥饿等[5]。Hsp的主要功能是参与蛋白质合成、折叠、装配及转运等生命活动[6]。根据同源性与分子量大小,昆虫热激蛋白一般分为Hsp90、Hsp70、Hsp60、Hsp40和小分子量热激蛋白(sHsp)[7-8]。其中Hsp70家族是最保守,也是研究最为广泛的家族[9]。热激蛋白Hsp70包含了胁迫诱导型和细胞组成型(Heat shock cognate,Hsc70)二种类型[10]。Hsp70主要结构包括氨基端的大小约为45 000的ATP结合域和羧基端的大约为25 000的结合结构域[11]。尽管在蛋白质结构上具有许多共同的特征,但是它们的表达模式完全不同。大量的研究结果表明:热激蛋白Hsp70在生物体的生理功能、各种抗性、环境监测中具有重要的作用[12-14]。温度是决定昆虫种群分布和丰度的最重要因子之一[15-16]。在自然条件下,昆虫经常要面对不利的温度,但是由于其个体较小,调节自身温度的能力较差,因而在长期的进化过程中,昆虫形成了多种补充的方法应对不利温度,如昆虫可通过调节热激蛋白Hsp70的表达来维持其体内各种蛋白质的平衡以抵抗不良温度[11,17-18]。灰飞虱具有较强的耐高温、抗低温能力,它能在中国长江中下游水稻主产区以3~5龄若虫越冬越夏[19-22]。研究结果表明,灰飞虱4~5龄若虫的过冷却点均在-10℃以下,表现出较强的抗寒力[22]。在18~30℃下卵的发育速率直线加快,且高温不能抑制灰飞虱卵的发育[23]。目前灰飞虱对不良温度适应的分子机制仍然不清楚。本研究从热激蛋白角度出发,探索了灰飞虱对温度胁迫响应的分子机制。为进一步科学合理地制定该虫的综合防治策略提供理论依据。
1 材料与方法
1.1 供试昆虫
扬州大学园艺与植物保护学院昆虫实验室内饲养的不携带条纹叶枯病毒的灰飞虱种群,用武育粳7号稻苗饲养10代以上。饲养条件为(26±1)℃,相对湿度70%,光周期16 L/8 D。
1.2 灰飞虱Hsp70基因的克隆
灰飞虱总RNA提取,Hsp70基因中间片段克隆,Hsp70基因RACE扩增,Hsp70基因序列拼接与分析,Hsp70结构分析等方法参照张青等对灰飞虱HSP90基因的克隆与分析方法[23],并略有改动。根据已有半翅目昆虫Hsp70基因序列,设计了2对简并引物,分别为 LsHsp70F1、LsHsp70R1和 LsH-sc70F1、LsHsc70R1(表1)。
1.3 不同发育阶段及不同温度胁迫下灰飞虱Hsp70基因表达差异分析
1.3.1 cDNA第一链的合成 参照张青等研究HSP90的相关方法[23]。
1.3.2 引物设计与合成 根据灰飞虱Hsp70基因全长设计用于荧光实时定量PCR的引物,并根据已扩增的灰飞虱β-actin部分序列设计内参基因引物(表1),由上海英俊生物技术有限公司合成引物。1.3.3 实时定量分析 运用SYBR Green I嵌合荧光法进行Real-time PCR分析,详细方法参照HSP90的分析方法[24],并略有改动。其中退火温度(Tm)分别为 Hsp70:58.5℃,Hsc70:60.8℃,β-actin: 58.5℃。
2 结果与分析
2.1 灰飞虱Hsc70和Hsp70基因全长扩增与序列分析
以灰飞虱的cDNA为模板,采用简并引物LsH-sc70F1、LsHsc70R1和LsHsp70F1、LsHsp70R1进行PCR扩增,分别获得约1 000 bp和400 bp的特异性条带。扩增产物回收、克隆、测序后,经Blast比对,发现该核苷酸序列分别与其他昆虫的 Hsc70和Hsp70核苷酸序列具有高度相似性,推测其为灰飞虱Hsc70和Hsp70的中间片段,长度分别为1 047 bp和421 bp。根据这2个片段分别设计扩增灰飞虱Hsc70和Hsp70基因cDNA全长的3′和5′引物,并进行RACE扩增。根据Hsc70的中间序列,分别扩增得到980 bp 3′端序列和1 823 bp的5′端序列。经DNAMAN拼接获得一个2 399 bp的灰飞虱Hsc70基因cDNA序列全长,命名为LsHsc70(GenBank登录号:KF660252)。其3′UTR末端具有典型的ploy A结构,在ploy A上游12 bp处具有1个多聚腺苷酸结构 AATAAA。它的开放阅读框(ORF)长1 974 bp,编码657个氨基酸,编码的蛋白质分子量73 000,等电点5.3。LsHsc70蛋白质具有Hsp70蛋白质家族特征签名序列:IDLGTTYS(第34~41位残基)、VFDLGGGTFDVSLL(第222~235位残基)、LVLVGGSTRIPKVQQ(第359~373位残基)。除此之外,在157~164位残基处有1个ATP~GTP结合位点;C-末端(第654~657位残基)具有4个保守的氨基酸KDEL,表明LsHsc70是内质网型热激蛋白家族成员(图1A)。根据Hsp70的中间序列,分别扩增得到1 805 bp 3′端序列和1 485 bp的5′端序列。经DNAMAN拼接获得1个2 468 bp的灰飞虱Hsp70基因cDNA序列全长,命名为LsHsp70(GenBank登录号:KF660251)。其3′UTR末端具有典型的ploy A结构,但在ploy A上游未发现AATAAA结构。它的开放阅读框(ORF)长2 073 bp,编码690个氨基酸,编码的蛋白质分子量74 900,等电点5.8。LsH-sp70具有Hsp70蛋白质家族特征签名序列:IDLGTTNS(第62~69位残基)、VYDLGGGTFDISIL(第247~260位残基)、VILVGGMTRMPKVQS(第388~402位残基)。除此之外,在183~190位残基处有1个ATP-GTP结合位点(图1B)。

表1 本研究所使用引物Table 1 Primer sequences used in this study
2.2 LsHsc70和LsHsp70蛋白质结构分析
以人类Homo sapiens Hsp70蛋白质(PDB ID: c3d2fC)为模型,使用Phyre预测灰飞虱Hsc70和Hsp70蛋白质结构模型,它们与人类Hsp70蛋白质的相似性分别为27%和25%。尽管它们之间的相似性不高,但它们结构之间的比对都是基于600个以上的氨基酸残基。结构模型显示灰飞虱LsHsc70和LsHsp70蛋白质都具有热激蛋白质家族70的结构特征(图2)。
2.3 LsHsc70和LsHsp70系统分析

图1 灰飞虱LsHsc70(A)和LsHsp70(B)基因的碱基序列和编码的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of LsHsc70(A)and LsHsp70(B)genes from Laodelphax striatellus
序列相似性分析结果显示:灰飞虱LsHsc70和LsHsp70都与内华达古白蚁Zootermopsis nevadensis Hsc70(KDR08641)的氨基酸序列的一致性最高,分别达 91%和 84%。以不同生物体的 Hsc70和 Hsp70为外群,对21种昆虫的Hsc70和Hsp70氨基酸序列进行完全比对,基于Meg5.0采用邻接法构建的系统发育树表明灰飞虱 Hsc70与西花蓟马Frankliniella occidentalis Hsc70(AGI36553)单独聚为一支;但灰飞虱Hsp70与赤拟谷盗Tribolium castaneum Hsc70(XP_975386)聚为一支。所有的鳞翅目昆虫Hsc70和Hsp70都聚集在一起。同时,热激蛋白质70所构建的系统发育树也反应了这些生物体的系统关系(图3)。

图2 灰飞虱Hsc70(A)和Hsp70(B)的结构预测Fig.2 Structure of Hsc70(A)and Hsp70(B)from L.striatellus
2.4 不同发育阶段灰飞虱体内LsHsc70和LsHsp70的表达变化
LsHsc70和LsHsp70在不同发育阶段的灰飞虱体内呈现出不同的表达模式。随着灰飞虱龄期不断的增加,LsHsc70的表达量逐渐增多,在雄成虫时达到最大值,并显著高于雌成虫(F6,14=7.509,P <0.001)。1龄若虫体内LsHsp70基因表达量最高,显著高于其他龄期(F6,14=3.377,P=0.028)。但是,LsHsp70基因表达量在雌雄成虫之间无显著差异(图4)。
2.5 不同温度胁迫下灰飞虱4龄若虫体内LsHsc70和LsHsp70的表达
高温和低温都可以诱导灰飞虱体内LsHsc70和LsHsp70的表达,但是,低温对这2种热激蛋白的诱导作用要强于高温。例如,在低温条件下,LsHsc70和LsHsp70分别在-4℃和-9℃达到最大值,分别是26℃时表达量的10.06和13.70倍。在高温条件下,LsHsc70和LsHsp70的表达量与26℃时相比增加,分别在42℃和38℃达到最大值,分别是26℃时的4.97和3.20倍(图5)。
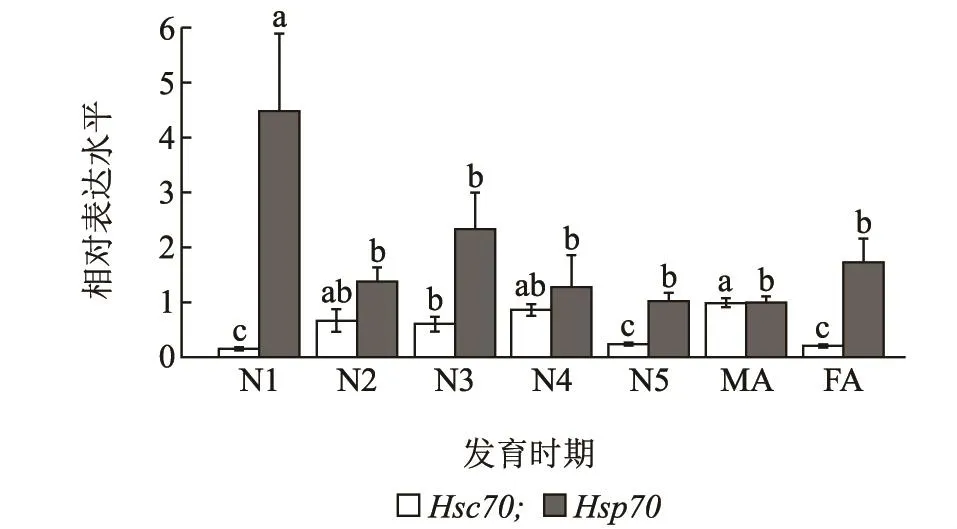
图4 不同发育阶段的灰飞虱LsHsc70和LsHsp70 mRNA的相对表达水平Fig.4 Relative expression levels of LsHsc70 and LsHsp70 mRNA in different developmental stages of L.striatellus
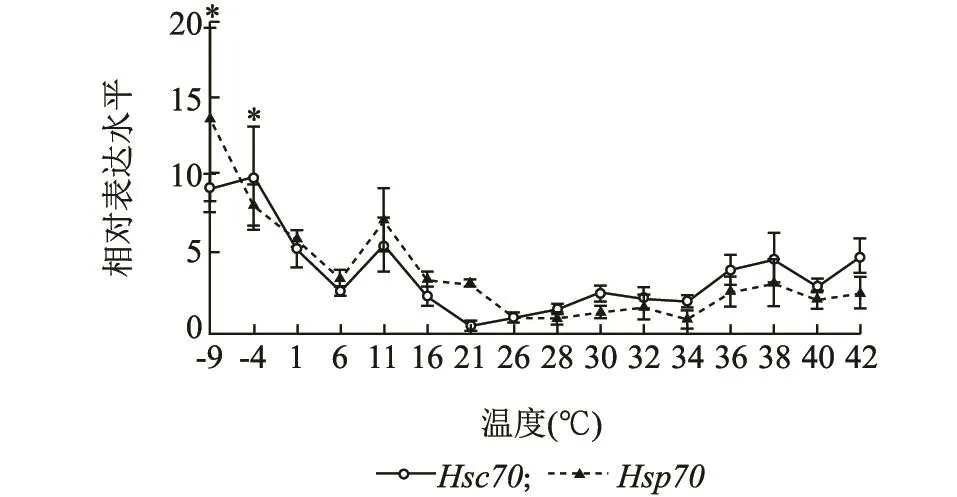
图5 不同温度处理1 h后灰飞虱4龄若虫LsHsc70和LsHsp70 mRNA的相对表达水平Fig.5 Relative expression levels of LsHsc70 and LsHsp70 mRNA in the 4th instar nymphs of L.striatellus exposed to different temperatures for 1 h
2.6 不同持续时间高、低温胁迫下灰飞虱4龄若虫体内LsHsc70和LsHsp70的表达变化
灰飞虱4龄若虫在40℃条件下,经过不同持续时间处理后发现LsHsc70和LsHsp70的表达趋势一致。分别在处理后0.5 h时达到最大值,分别是对照的12.29和9.35倍,并且均显著高于其他处理(P<0.001)。在-4℃下不同持续时间处理后,LsHsc70和LsHsp70的表达模式与40℃条件下不同。LsHsc70和LsHsp70的表达量均在处理后1 h时达到最大值,分别是对照的10.06和8.22倍,且它们均显著高于处理后0.25 h时的表达量(P<0.001)(图6)。
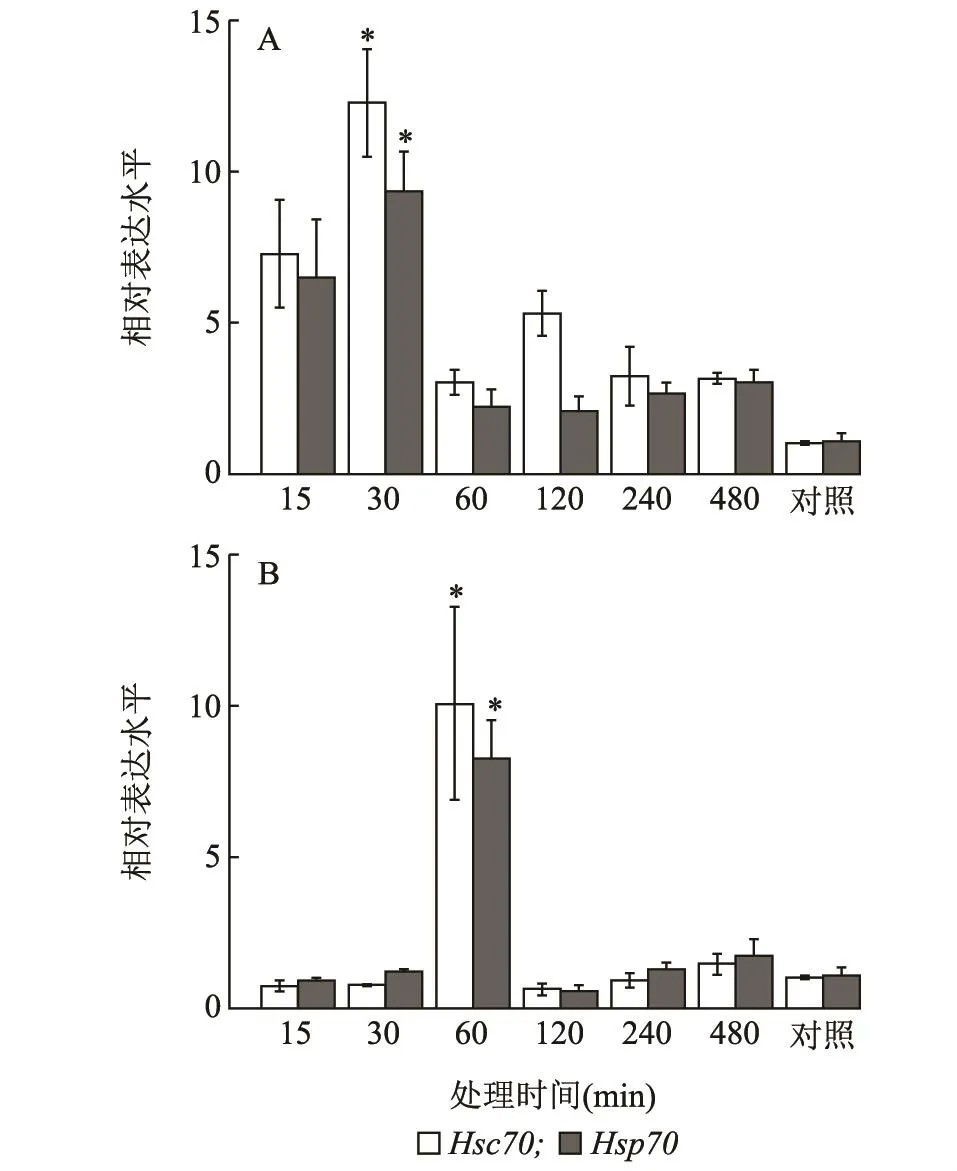
图6 40℃(A)和-4℃(B)下处理不同时间灰飞虱4龄若虫LsHsc70和LsHsp70 mRNA的相对表达水平Fig.6 Relative expression levels of LsHsc70 and LsHsp70 mRNA in the 4th instar nymphs of L.striatellus exposed to 40℃(A)and-4℃(B)for different time
3 讨论
本研究通过RACE法克隆得到灰飞虱体内2种Hsp70家族基因LsHsc70和LsHsp70。氨基酸序列分析结果表明2个基因均具有Hsp70家族3个签名序列和1个 ATP~GTP结合位点[25]。LsHsc70在3′UTR端的poly(A)上方有加尾信号“AATAAA”,但LsHsp70不具有加尾信号。同源性比较显示不同生物体Hsp70家族基因具有较高的保守性。但是,通过Blast比对发现半翅目同翅亚目昆虫的Hsp70基因序列之间的相似性较低。例如,LsHsc70和LsH-sp70都与内华达古白蚁Z.nevadensis Hsc70最为相似;褐飞虱 Nilaparvata lugens Hsp70与苹果蠹蛾Cydia pomonella Hsp70同源性最高。由于Hsp70属于多基因家族,推测可能与这类昆虫中存在亲源关系较近的Hsp70未被鉴定有关。
已有研究发现热激蛋白质70在调控昆虫生长发育方面起到重要的作用[26-28]。随着灰飞虱的生长发育,LsHsc70表达量逐渐增多,在雄成虫时达到最大值,类似的现象也在小菜蛾(Plutella xylostella)和斜纹夜蛾(Spodoptera litura)中发现[29-30]。同时,雄虫体内的LsHsc70显著高于雌成虫。LsHsc70可能还参与昆虫的生殖调控,其在灰飞虱中的这类作用机制仍需进一步研究。但是,LsHsp70在1龄若虫体内的表达量最高,类似的现象也在水稻二化螟(Chilo suppressalis)中被发现[31]。在灰飞虱整个发育过程中,LsHsp70表达量相对稳定。
Hsp70是与生物体温度耐受性最为相关的一类蛋白质,一些研究结果已经证实了他们在昆虫抵抗冷热胁迫中起到重要的作用[31-35]。高温和低温都可以诱导灰飞虱体内LsHsc70和LsHsp70的表达,但是,低温对这2种热激蛋白的诱导作用要强于高温。但是,Kim等人研究发现低温不可以诱导L.striatellus体内的另外二种热激蛋白质70基因的表达[36]。低温对大螟(Sesamia inferens)的Sihsc70的诱导不显著[37]。低温可以诱导黑腹果蝇(D.melanogaster Hsp70Aa,但是不能诱导Hsc70-1[38]。这说明不同昆虫的不同Hsp70作用不尽相同。灰飞虱以3~5龄若虫越冬越夏,热激蛋白70的调控有助于其渡过不良环境温度。温和的温度也可以诱导灰飞虱LsH-sc70和LsHsp70表达。较低温度的锻炼同样也引起了南美斑潜蝇(Liriomyza huidobrensis)Hsp70的增加[39]。LsHsc70和LsHsp70在42℃和38℃的表达量分别是26℃的4.97和3.20倍。王海鸿等研究结果表明高温可以诱导在烟粉虱(Bemisia tabaci B biotype)和温室白粉虱(Trialeurodes vaporariorum) Hsp70的表达[40]。高低温处理不同时间均能诱导LsHsc70和LsHsp70表达,这与美洲棉铃虫(Helicoverpa zea)体内的Hsp70表达模式相似[41]。在40℃条件下,灰飞虱4龄若虫体内的LsHsc70和LsHsp70的表达量都在0.5 h时达到最大值。然而,在-4℃下LsHsc70和LsHsp70的表达量均在处理后1 h时达到最大值。这表明热激蛋白70对高温和低温有不同的响应时间。因此,我们初步推断调节LsHsc70和LsHsp70的表达是灰飞虱渡过不良环境温度的重要生理手段。
为了探讨灰飞虱对不良环境的适应机制,本研究成功克隆了其Hsc70和Hsp70基因全长序列,分析了不同发育阶段LsHsc70和LsHsp70的表达变化规律,检测了冷热条件下LsHsc70和LsHsp70的表达水平,初步阐明了Hsp70与灰飞虱温度适应能力有着密切的联系。本研究仅仅是从基因水平研究了灰飞虱的Hsp70,有必要从蛋白质水平研究其功能。同时,我们也发现灰飞虱体内还有其他热激蛋白质70家族基因,为了进一步深入探讨它的环境适应机制,有必要结合其他热激蛋白70进行进一步研究。
[1] 蒲茂华.苏南灰稻虱(Delphacodes striatella Fallén)的初步研究[J].昆虫学报,1963,12(2):117-136.
[2] 阮义理,蒋文烈,林瑞芬.稻病毒病介体昆虫灰稻虱的研究[J].昆虫学报,1981,24(3):283-290.
[3] 程兆邦,杨荣明,周益军,等.江苏稻区水稻条纹叶枯病发生新规律[J].江苏农业科学,2002(1):39-41.
[4] 陆虎华,孙权星,彭长俊,等.不同播期对玉米粗缩病发生及鲜穗产量的影响[J].江苏农业科学,2013,41(9):75-76.
[5] NOVER L,SCHARF K D.Heat stress proteins and transcription factors[J].Cellular and Molecular Life Sciences,1997,53(1): 80-103.
[6] FEDER M E,HOFMANN G E.Heat-shock proteins,molecular chaperones,and the stress response:evolutionary and ecological physiology[J].Annual Review of Physiology,1999,61(1): 243-282.
[7] DENLINGER D L,RINEHART J P,YOCUM G D.Stress proteins: a role in insect diapause?——Insect timing:Circadian rhythmicity to seasonality[M].Amsterdam:Elsevier,2001.
[8] SØRENSEN J G,KRISTENSEN T N,LOESCHCKE V.The evolutionary and ecological role of heat shock proteins[J].Ecology Letter,2003,6(11):1025-1037.
[9] BOORSTEIN W R,ZIEGELHOFFER T,CRAIG E A.Molecular evolution of the Hsp70 multigene family[J].Journal of Molecular E-volution,1994,38(1):1-17.
[10]GKOUVITSAST,KONTOGIANNATOS D,KOURTI A.Cognate Hsp 70 gene is induced during deep larval diapause in the moth Sesamia nonagrioides[J].Insect Molecular Biology,2009,18(2):253-264.
[11]HUNG J J,CHENG T J,CHANG M D,et al.Involvement of heat shock elements and basal transcription elements in the differential induction of the 70-kDa heat shock protein and its cognate by cadmium chloride in 9 L rat brain tumor cells[J].Journal of Cellular Biochemistry,1998,71(1):21-35.
[12]KREGEL K C.Heat shock proteins:modifying factors in physiolog-ical stress responses and acquired thermotolerance[J].Journal of Applied Physiology,2002,92(5):2177-2186.
[13]MAHROOF R,ZHU K Y,NEVEN L,et al.Expression patterns of three heat shock protein 70 genes among developmental stages of the red flour beetle,Tribolium castaneum(Coleoptera:Tenebrionidae)[J].Comparative Biochemistry and Physiology,2005,141 (2):247-256.
[14]CLARK M S,PECK L S.Triggers of the HSP70 stress response:environmental responses and laboratory manipulation in an Antarctic marine invertebrate(Nacella concinna)[J].Cell Stress and Chaperones,2009,14(6):649-660.
[15]BALE J S,MASTERS G J,HODKINSON I D,et al.Herbivory in global climate change research:direct effects of rising temperature on insect herbivores[J].Global Change Biology,2002,8(1): 1-16.
[16]HOFFMANN A A,CHOWN S L,CLUSELLA-TRULLAS S.Upper thermal limits in terrestrial ectotherms:how constrained are they?[J].Functional Ecology,2012,27(4):934-949.
[17]崔亚东,陆明星,杜予州.二化螟热休克蛋白70基因的克隆及热胁迫下的表达分析[J].昆虫学报,2010,53(8):841-848.
[18]BALE J S,HAYWARD S A L.Insect overwintering in a changing climate[J].Journal of Experimental Biology,2010,213(6): 980-994.
[19]李济宸,李桂珍,高立起,等.灰飞虱发生规律的研究[J].北京农业科学,1998,16(6):24-27.
[20]孙兴全,吴静菊,吴爱忠,等.灰飞虱生物学特性研究[J].上海农学院学报,2000,18(2):150-154.
[21]刘向东,翟保平,刘慈明.灰飞虱种群暴发成灾原因剖析[J].昆虫知识,2006,43(2):141-146.
[22]刘向东,翟保平,胡自强.高温及水稻类型对灰飞虱种群的影响[J].昆虫知识,2007,44(3):348-352.
[23]张爱民,刘向东,翟保平,等.温度对灰飞虱生物学特性的影响[J].昆虫学报,2008,51(6):640-645.
[24]张 青,陆明星,祝树德.灰飞虱热激蛋白基因Hsp90的克隆、分析与表达模式研究[J].昆虫学报,2014,57(7):777-786.
[25]KELLEY L A,STERNBERG M J E.Protein structure prediction on the Web:a case study using the Phyre server[J].Nature Protocols,2009,4(3):363-371.
[26]PETTERSEN E F,GODDARD T D,HUANG C C,et al.UCSF Chimera-a visualization system for exploratory research and analysis[J].Journal of Computational Chemistry,2004,25(13): 1605-1612.
[27]RAVAUX J,TOULLEC J Y,LEGER N.First hsp70 from two hydrothermal vent shrimps,Mirocaris fortunate and Rimicaris exoculata:Characterization and sequence analysis[J].Gene,2007,386(1-2):162-172.
[28]SHARMA S,ROHILLA M S,TIWARI P K.Developmental and hyperthermia-induced expression of the heat shock proteins HSP60 and HSP70 in tissues of the housefly Musca domestica:an in vitro study[J].Genetics and Molecular Biology,2007,30(1):159-168.
[29]SHU Y H,DU Y,WANG J W.Molecular characterization and expression patterns of Spodoptera litura heat shock protein 70/90,and their response to zinc stress[J].Comparative Biochemistry and Physiology Part A,2011,158(1):102-110.
[30]SONODA S,ASHFAQ M,TSUMUKI H.Cloning and nucleotide sequencing of three heat shock protein genes(hsp90,hsc70,and hsp19.5)from the diamondback moth,Plutella xylostella(L.)and their expression in relation to developmental stage and temperature[J].Archives of Insect Biochemistry and Physiology,2006,62(2):80-90.
[31]LU M X,LIU Z X,CUI Y D,et al.Expression patterns of three heat shock proteins in Chilo suppressalis(Lepidoptera:Pyralidae)[J].Annals of the Entomological Society of America,2014,107(3):667-673.
[32]RINEHART J P,LI A Q,YOCUM G D,et al.Up-regulation of heat shock proteins is essential for cold survival during insect diapause[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(27):11130-11137.
[33]YI S X,MOORE C W,LEE R E.Rapid cold-hardening protects Drosophila melanogaster from cold-induced apoptosis[J].Apoptosis,2007,12(7):1183-1193.
[34] KOŠTÁl V,TOLLAROVÁ-BOROVANSKÁ M.The 70 kDa heat shock protein assists during the repair of chilling injury in the insect,Pyrrhocoris apterus[J].Plos One,2009,4(2):e4546.
[35]XU P J,XIAO J H,LIU L,et al.Molecular cloning and characterization of four heat shock protein genes from Macrocentrus cingulum (Hymenoptera:Braconidae)[J].Molecular Biology Reports,2010,37(5):2265-2272.
[36]KIM D H,LEE S C,KWAK D Y,et al.Cloning of heat shock protein genes from the brown planthopper,Nilaparvata lugens,and the small brown planthopper,Laodelphax striatellus,and their expression in relation to thermal stress[J].Insect Science,2008,15(5):415-422.
[37]孙 猛,陆明星,汤小天,等.大螟HSC70基因克隆及表达模式分析[J].昆虫学报,2014,57(7):787-797.
[38]COLINET H,LEE S F,HOFFMANN A.Temporal expression of heat shock genes during cold stress and recovery from chill coma in adult Drosophila melanogaster[J].FEBS Journal,2010,277: 174-185.
[39] HUANG L H,CHEN B,KANG L.Impact of mild temperature hardening on thermotolerance,fecundity,and Hsp gene expression in Liriomyza huidobrensis[J].Journal of Insect Physiology,2007,277(12):1199-1205.
[40]王海鸿,雷仲仁.两种入侵粉虱热激基因Hsp70的克隆及温度胁迫下的种间差异表达.生态学杂志,2010,29(4):693-701.
[41]ZHANG Q R,DENLINGER D L.Molecular characterization of heat shock protein 90,70 and 70 cognate cDNAs and their expression patterns during thermal stress and pupal diapause in the corn earworm[J].Journal of Insect Physiology,2010,56(2):138-150.
