不同途径新辅助化疗治疗年轻宫颈癌的疗效比较
2015-03-25杨学刚李政文文华长许国辉
杨学刚, 周 石, 李政文, 吴 戈, 李 威, 文华长, 吴 辉, 许国辉
宫颈癌是最常见的妇科恶性肿瘤,其发病率有明显上升趋势[1-2]。年轻宫颈癌患者对保留卵巢功能以及对性生活的要求较高,根治性手术常成为首选治疗方法。新辅助化疗在宫颈癌上也得到广泛应用。子宫动脉灌注化疗和静脉化疗这2种宫颈癌新辅助化疗方式均取得了不错的疗效[3]。
1 材料与方法
1.1 临床资料
回顾性分析2000—2010年本院收治的120例年轻宫颈癌患者(年龄≤35岁)的临床资料。术前采用子宫动脉灌注化疗栓塞联合手术63例(A组),采用静脉化疗联合手术57例(B组)。所有病例均经病理确诊、首次治疗、不伴其他恶性肿瘤病史;治疗前均接受实验室检查(血常规、肝肾功能、CEA)、妇科、X线胸片、腹部超声和盆腔MRI检查。A组中位年龄 30(20~35)岁,B 组中位年龄 31(21~35)岁;两组患者一般临床资料对比,差异无统计学意义 (P>0.05)。 见表 1。
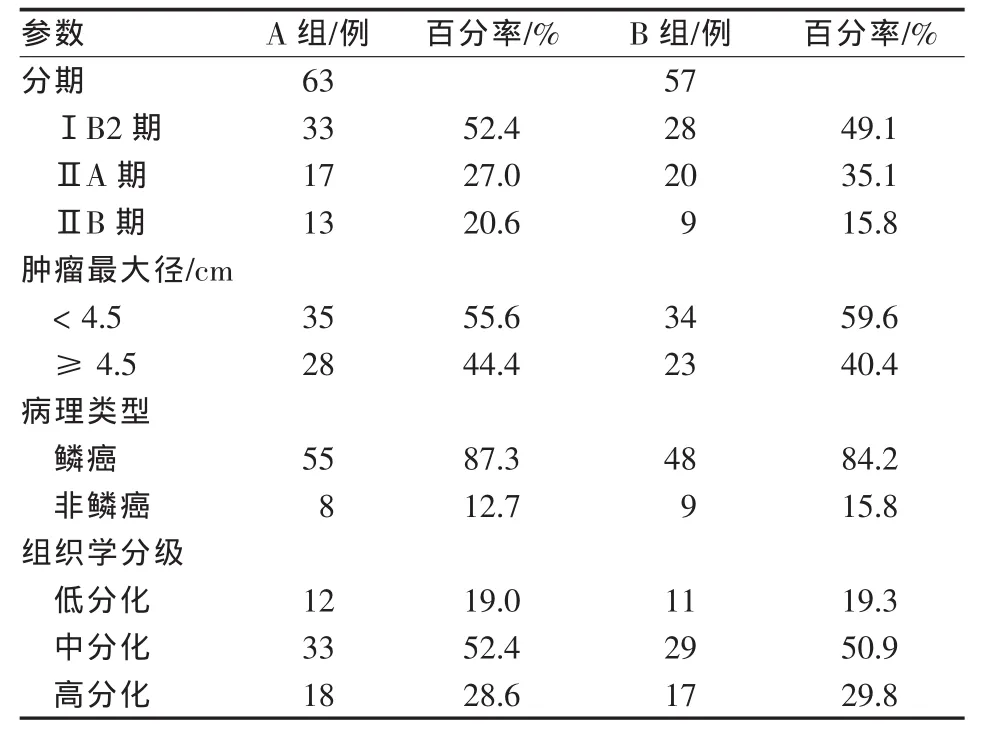
表1 两组患者一般临床资料对比
1.2 方法
1.2.1 新辅助化疗 所有患者卡氏(KPS)评分均≥80分,无介入手术及化疗禁忌证,患者及家属对治疗方法知情并签署同意书。A组采用子宫动脉灌注化疗栓塞[4]:经双侧子宫动脉灌注卡铂(50 mg/m2)和吉西他滨(1 000 mg/m2),灌注完后用明胶海绵颗粒(粒径700~1 000μm)栓塞双侧子宫动脉,直至末梢不显影。间隔3周治疗1次,共1~2次。B组采用静脉化疗,化疗方案同A组,每个疗程2 d,间隔7~10 d,共 1~2 个疗程。
1.2.2 手术治疗 每次新辅助化疗前均行盆腔增强MRI及妇科检查,综合评估有手术机会者,立即接受广泛子宫切除联合盆腔淋巴结清扫术及主动脉旁淋巴结取样;对于新辅助化疗后疗效评估为稳定,但患者积极要求手术者,亦采用手术治疗。
1.2.3 疗效评价 采用实体瘤疗效评价标准:完全缓解(CR),指肿瘤完全消失;部分缓解(PR),指肿瘤最大径之和缩小≥30%以上,并至少维持4周;稳定(SD),指肿瘤最大径之和缩小未达PR,或增大未达PD;进展(PD),指肿瘤最大径增大≥20%,或出现新病灶,但原病灶分裂不计在内。CR和PR为有效,SD和PD为无效。术后病理反应判定根据恶性肿瘤放(化)疗后的形态学变化标准:Ⅰ度,指肿瘤细胞不同程度退行性变;Ⅱ度,指肿瘤细胞大部分消失;Ⅲ度,指肿瘤细胞完全消失,原肿瘤部位纤维组织增生。
1.2.4 辅助治疗 术后全盆腔外照射组织量为46~50 Gy,腔内治疗阴道黏膜下0.5 cm处组织量为10 Gy。
1.2.5 不良反应评价标准 化疗不良反应评价参照WHO抗肿瘤药物急性及亚急性不良反应分度评价标准,分为0~Ⅳ度5个级别。
1.2.6 随访 所有患者从确诊时开始随访。累计生存定义为从确诊时间至末次随访或死亡时间。无瘤生存时间定义为从手术时间至复发或末次随访时间。每3个月随访1次,随访至患者死亡或者失去联系,随访截止2013年12月30日。随访内容包括妇科检查、盆腔超声、阴道残端细胞学涂片及X线胸片检查。
1.3 统计学分析
采用SPSS 16.0统计软件包进行资料分析,计量资料采用均数±标准差(x±s)表示,采用t检验分析;计数资料的比较采用χ2检验;累计生存分析采用Kaplan-Meier法;生存率比较采用log-rank检验。
2 结果
2.1 DSA造影表现
宫颈癌主要供血动脉-双侧子宫动脉主干有不同程度的增粗、迂曲,肿瘤血供丰富,肿瘤明显染色。
2.2 近期疗效
A组化疗前后的宫颈肿瘤最大径 (5.5±0.8)cm和(3.1±0.7)cm,差异有统计学意义(t=16.5,P<0.05)(图 1);B 组为(5.4±0.9)cm 和(3.5±0.8)cm,差异无统计学意义(t=11.9,P>0.05);A组的近期疗效优于B 组(t=3.1,P<0.05)。 A 组有效率 90.5%(57/63),B组有效率 71.9%(38/57),2组差异有统计学意义(χ2=7.5,P<0.05),见表 2。
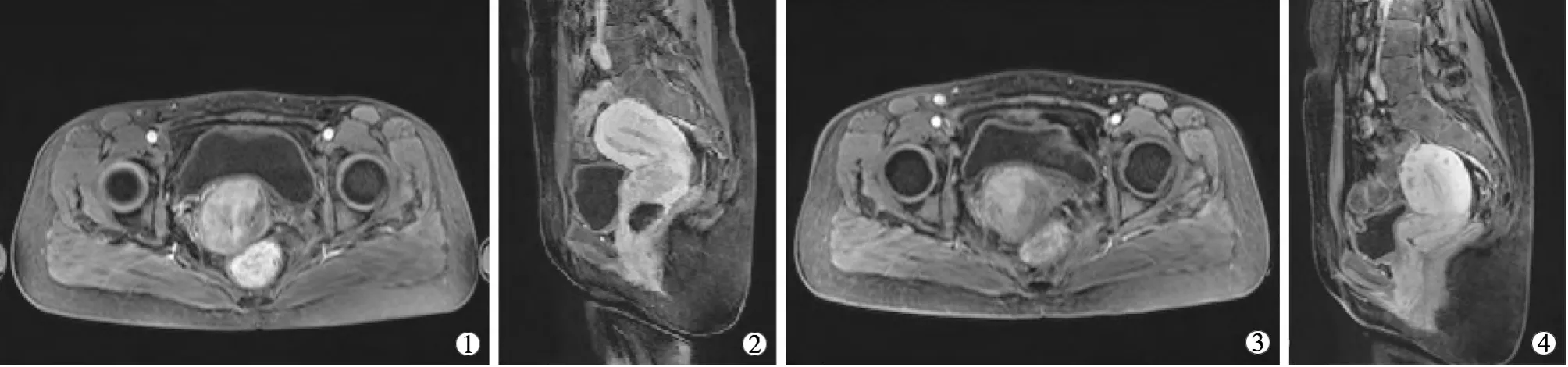
①②子宫动脉灌注化疗栓塞治疗前,子宫颈肿瘤巨大肿块,不均匀强化,子宫颈僵硬;③④治疗后,肿瘤明显缩小,子宫颈柔软塌陷图1 经子宫动脉化疗栓塞前后图像

表2 两组患者近期疗效比较
A组60例获得了手术机会,切除率95.2%(60/63),其中鳞癌手术切除率 98.2%(54/55),非鳞癌手术切除率6/8,3例接受3次介入治疗后,肿瘤体积缩小,但与周围脏器分界不清,手术切除困难,家属及患者要求放弃手术,改为同步放化疗。B组48例获得了手术机会,切除率84.2%(48/57),其中鳞癌手术切除率89.6%(43/48),非鳞癌手术切除率5/9;9例化疗3个疗程后,综合评估无法手术切除,改为同步放化疗。 A 组术中出血量(443±263)ml,手术时间为(3.8±1.0)h;B 组术中出血量为(695±312)ml,手术时间为 (4.3±1.1)h;A组术中出血量少于B组(t=4.802,P<0.05); 但手术时间无差异 (t=2.7,P>0.05)。
术后病理结果:术后病理切片中可见肿瘤细胞大量坏死及淋巴结细胞浸润(图2)。A组阴道残端无残留,9.5%(6/63)达到病理完全缓解;B组3例手术切缘阳性,5.3%(3/57)达到病理完全缓解;两组术后病理结果差异有统计学意义(χ2=12.3,P<0.05),见表3。

①肿瘤细胞成团状紊乱,明显异型性肿瘤细胞;②子宫动脉灌注化疗栓塞治疗后术后切片示肿瘤组织片状坏死和淋巴细胞浸润图2 肿瘤栓塞前后病理所见
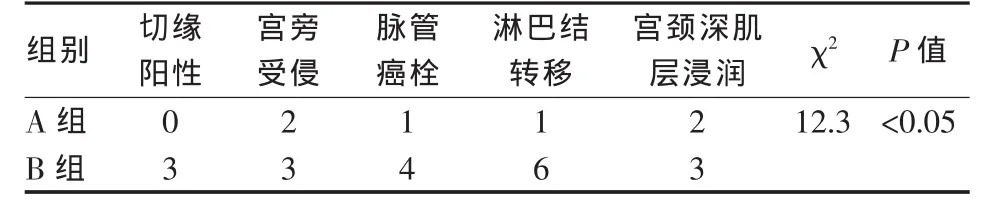
表3 两组患者术后病理比较 例
2.3 累计生存率的比较
A组5年无进展生存率(PFS)、累计生存率(OS)分别为73.0%、77.8%;B组分别为54.4%、63.2%。见表4。
2.4 不良反应
A、B两组主要不良反应是骨髓抑制和消化道不良反应(见表5)及不同程度的脱发;此外,导致肝功能异常者A组3例,B组2例;B组2例全身肌肉酸痛和关节疼痛,对症治疗后症状缓解。A组13例子宫动脉灌注化疗栓塞后出现低热,5例下腹部疼痛和(或)坠胀感,6例穿刺点部位出现小片瘀斑,但无大面积的渗血或血肿,无下肢静脉血栓形成。
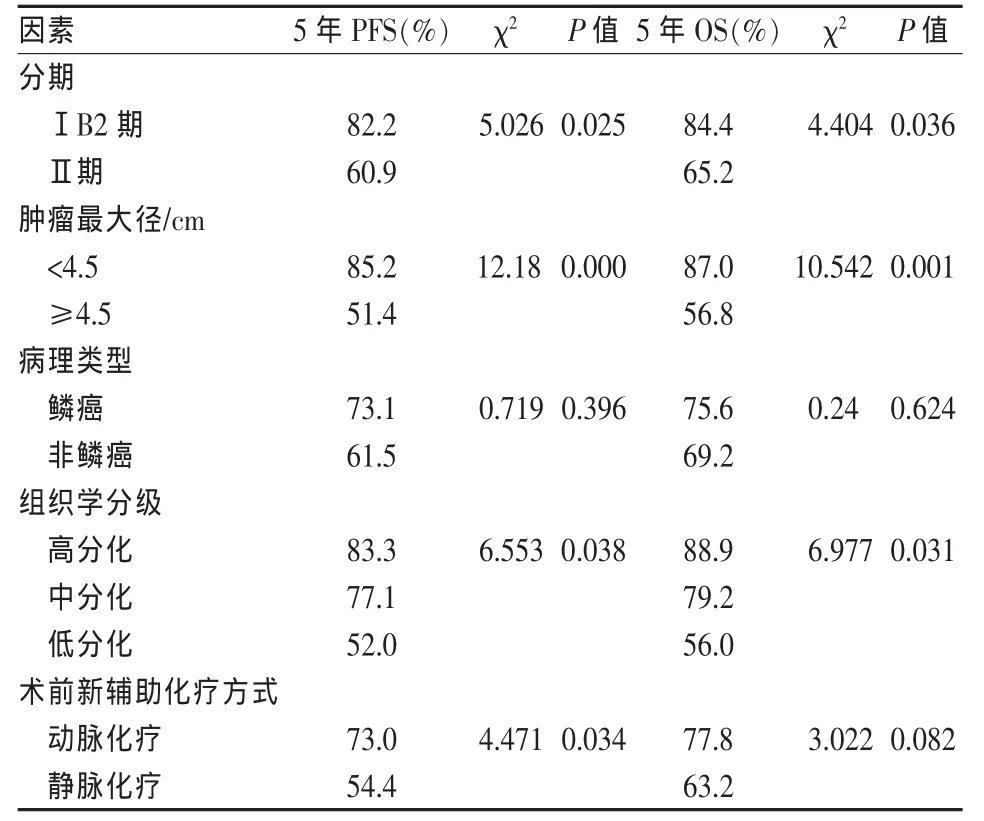
表4 120例年轻宫颈癌患者预后影响因素的单因素分析
3 讨论
同步放化疗仍然是中晚期宫颈癌的标准治疗方法。然而,新辅助化疗联合外科手术在近20年也逐渐成为局部晚期宫颈癌的治疗方式之一,且5年总生存率达到 45%~83%[4]。
放疗也会损伤正常组织,尤其是年轻患者的卵巢,造成其分泌功能受损,更年期提前,性生活质量下降。年轻宫颈非鳞癌的病理类型明显多于老年宫颈癌[5]。非鳞癌对放疗的敏感性差,需争取手术治疗。局部晚期宫颈癌通过术前辅助化疗降期而获得手术切除机会。子宫颈癌供血动脉主要是髂内动脉的前干分支子宫动脉,这给动脉灌注化疗栓塞提供了解剖学基础[6]。

表5 两组患者骨髓抑制及消化道不良反应比较
本研究A组子宫动脉灌注化疗栓塞前后肿瘤缩小明显,最大径差异有统计学意义(P<0.05);而B组静脉化疗后子宫颈肿瘤有缩小,但变化不明显(P>0.05)。两种不同化疗途径获得近期疗效差异明显(P<0.05)。栓塞子宫动脉减少肿瘤的血供,造成瘤体缺血坏死,有利于减轻瘤体与周围组织的粘连,手术界面易于剥离,减少术中出血量[7]。本研究中A组术中出血量(443±263)ml较B 组(695±312)ml少(P<0.05)。本研究中A组有效率90.5%,稍低于文献,但优于B组的 71.9%(P<0.05);完全缓解率26.9%(17/63)高于 B 组的 19.3%(11/57),稍低于上述文献报道的31.8%[8],这可能与化疗方案不同相关;B组完全缓解率19.3%(11/57)与文献报道的20%相近[3]。A组手术切除率 95.2%高于 B组的84.2%;A组术后病理缓解率为9.5%稍低于文献报道,但高于B组的5.3%。本组结果与姬红等[9]报道的相近,A组完全缓解率28.6%,缓解率85.7%,较B组完全缓解率18.7%,缓解率49.8%,两者差异有统计学意义(P<0.05)。
120例年轻宫颈癌单因素分析结果表明临床分期、组织学分级、肿瘤直径均与5年总生存率有关(P<0.05);不同化疗途径对年轻宫颈癌的5年总生存率无明显影响(P>0.05),但两组患者的无病生存率存在明显的差异(P<0.05)。这主要是术前子宫动脉灌注化疗栓塞能使肿瘤组织分化降级,同时杀灭肿瘤周围的微小转移灶和亚临床灶,减少了术后的危险因素,减少了复发者,提高了无进展生存率,同时也改善了生活质量。
综上所述,子宫动脉灌注化疗栓塞较静脉化疗具有更好的降期效果,能提高手术切除率,可改善年轻宫颈癌PFS,但长期生存率改善不明显(P<0.05)。本研究是回顾性分析,病例数有限,关于如何提高年轻宫颈癌患者的长期生存率,还需进一步的多中心前瞻性研究。
[1]Soerjomataram I,Lortet-Tieulent J,Parkin DM,et al.Global burden of cancer in 2008:a systematic analysis of disabilityadjusted life-years in 12 world regions [J].Lancet,2012,380:1840-1850.
[2]李 雪,孔为民,韩 超,等.首都医科大学附属北京妇产医院1992-2011年间宫颈癌发病趋势分析[J].中华妇幼临床医学杂志:电子版,2013,9:310-314.
[3]张 蓉,李 斌,白 萍,等.紫杉醇联合铂类在局部晚期宫颈癌新辅助化疗中的应用[J].中华肿瘤杂志,2011,33:616-620.
[4]Chen H,Liang C,Zhang L,et al.Clinical efficacy of modified preoperative neoadjuvant chemotherapy in the treatment of locally advanced(stageⅠB2 toⅡB)cervical cancer:randomized study[J].Gynecol Oncol,2008,110:308-315.
[5] 刘兰芳,孙海燕.831例35岁以下妇女宫颈癌的临床病理特点和预后[J].中国癌症杂志, 2008, 18: 298-301.
[6]中国解剖学会体质调查委员会.中国人解剖学数值[M].北京:人民卫生出版社,2002:299.
[7] 张国福,田晓梅,韩志刚,等.介入化疗栓塞在宫颈癌术前的临床应用[J].介入放射学杂志, 2009, 18: 97-99.
[8]Tsubamoto H,Maeda H,Kanazawa R,et al.Phase Ⅱ trial on neoadjuvant intravenous and trans-uterine arterial chemotherapy for locally advanced bulky cervical adenocarcinoma [J].Gynecol Oncol,2013,129:129-134.
[9]姬 红,姚安梅.两种新辅助化疗治疗局部晚期宫颈癌的疗效比较[J].现代肿瘤医学, 2010, 18: 2040-2042.
