IL-8基因-251T/A和+781C/T多态性与南通地区肝癌遗传易感性的关联研究
2015-03-25陆小华朱小庆张玉宇储玉山茅国新
陆小华, 朱小庆, 张玉宇, 储玉山, 茅国新
肝癌是临床最常见的恶性肿瘤之一。遗传因素在肝癌的病因中约占所有危险因素的60%[1]。南通地区,尤其是启东、海门,在国内属于肝癌高发区,发病率、死亡率位居前列。对寡核苷酸多态性(SNP)与肝癌遗传易感性关联的研究将有利于在本地区采取更好的预防、诊断和治疗措施,具有重要的临床意义和应用价值。许多研究表明,白细胞介素(IL)SNP与肝癌的发生发展有关[2-5]。IL-8作为一种多功能的趋化因子,在新生血管形成、炎性反应等多种生理病理过程中发挥作用。本研究选取该基因在中国人群中等位基因型频率>0.05且在国内外肿瘤易感性研究中涉及较多的的-251T/A(rs4073)、+781C/T(rs2227306)位点进行南通地区肝癌遗传易感性关联的研究,并探究基因多态性与不同暴露因素交互作用对肝癌发病风险的影响。
1 材料与方法
1.1 研究对象
本研究为医院基础的病例对照研究。包括454例肝癌患者及446名健康对照。病例组选择2011年7月1日至2013年3月31日在我院介入放射科、普外科住院,按照《原发性肝癌诊疗规范(2011年版)》诊断标准确诊的且无治疗史的肝癌患者,对照组选择同期在我院门诊体检且无肿瘤疾病的健康人群。入组人员均为南通地区籍贯或在南通地区生活15年以上的汉族成年人。
1.2 方法
1.2.1 问卷调查 采用统一调查表,在征得受检者知情同意后,填写每例(名)研究对象的人口学资料和相关暴露因素资料调查表。调查表中按WHO标准定义吸烟和饮酒史,即研究对象一生中连续或累积吸烟半年或以上者视为有吸烟史;每周饮酒至少1次,持续半年或以上者视为有饮酒史。所有研究对象资料的收集均符合伦理学原则。
1.2.2 试验方法 所有研究对象均抽取外周静脉血3 ml,采用上海生工SK8224血液基因组DNA抽提试剂盒提取基因组DNA。利用RFLP-PCR方法,对IL-8基因-251位点和+781位点进行基因分型。引物序列为:-251位点正向引物 5′-ATTGGCTGGCTTATCTTCA-3′, 反 向 引 物 5′-CAAATACGGAGTATGACGAAAG-3′。 +781 位点正向引物 5′-GTGGTATCACAGAGGATTATGC-3′,反向引物 5′-CAGTCATAACTGACAACATTGATC-3′。PCR 反应体系总体积为 15μl:11μl ddH2O;1.5μl 10×PCR 缓 冲 液 ;1.2 μl 25 mmol/L Mg2+;0.3 μl dNTP;0.2 μl正向引物;0.2 μl反向引物;Taq DNA聚合酶0.1 μl;0.5 μl模板 DNA。 反应步骤:95℃预变性 5 min,95℃变性 30 s,68℃退火 45 s,72℃延伸1 min, 循环 20 次;95℃变性 30 s,58℃退火 30 s,72℃延伸40 s循环20次,72℃延伸6 min。-251位点PCR扩增产物的长度为272 bp,Mun I消化后在2%琼脂糖凝胶上电泳。TT基因型显示272 bp条带,AA基因型显示170、102 bp 2个条带,AT基因型显示272、170和102 bp 3个条带(见图1)。+781位点PCR扩增产物的长度为162 bp,Bcl I消化后在2%琼脂糖凝胶上电泳。CC基因型显示162 bp条带,TT基因型显示118、44 bp 2个条带,CT基因型显示162、118和44 bp 3个条带 (见图2)。在全部样本中,随机挑取15%样本进行测序,以验证分型的准确性。
1.3 统计学处理
应用SPSS18.0软件对数据进行处理,用Hardy-

(M:Marker; 1、4、5、6 泳道为 AT 基因型;3 泳道为 AA 基因型;2、7、8泳道为TT基因型)图1 IL-8基因-251位点PCR产物酶切电泳图

(M:Marker;1、2、5、6、8 泳道为 CC 基因型;3、4 泳道为 CT 基因型;7泳道为TT基因型)Weinberg平衡检验样本的群体代表性,用方差分析进行计量资料的多样本均数比较,用χ2检验比较各位点基因型及由2个位点组成的基因型频率差异,以多因素Logistic回归分析IL-8 SNP与肝癌易感性的关联,关联强度用OR、95%CI及交互作用指数S表示,其中S>1为正交互,S<1为负交互。所有统计检验均为双侧检验,检验水准α=0.05。
2 结果
2.1 研究对象的一般情况
病例组454例,对照组446例。两组在性别、年龄的差别无统计学意义(P>0.05)。吸烟、饮酒、HBV感染和肝癌家族史在两组中的分布频率差异有统计学意义(P<0.05)。 见表 1。
2.2 IL-8基因型分布Hardy-Weinberg平衡检验
IL-8-251、+781位点各基因型在对照组中Hardy-Weinberg平衡结果表明,对照组中各基因型分布均符合该平衡定律,其中-251位点χ2=0.09,P=0.95;+781 位点 χ2=0.04,P=0.98。可认为对照组人群来自总体人群,具有群体代表性。

表1 肝癌组、对照组研究对象的一般情况
2.3 2位点等位基因和基因型频率分布比较
-251位点3种基因型TT、TA、AA在病例组中分布频率为23.79%、64.54%、11.67%,在对照组分别为38.57%、44.17%、17.26%,2组之间3种基因型分布差异有统计学意义(P<0.05)。等位基因T在病例组和对照组中频率分别为56.06%、60.65%,等位基因A在病例组和对照组中频率分别为43.94%、39.35%。2组之间等位基因分布差异无统计学意义(P>0.05)。 +781位点 3种基因型 CC、CT、TT 在病例组中分布频率为38.55%、51.98%、9.47%,在对照组分别为45.29%、41.03%、13.68%,2组之间3种基因型分布差异有统计学意义(P<0.05)。等位基因C在病例组和对照组中频率分别为64.54%、65.81%,等位基因T在病例组和对照组中频率分别为35.46%、34.19%。2组之间等位基因分布差异无统计学意义(P>0.05)。 见表 2。

表2 两位点各基因型、等位基因频率在研究对象中的分布
2.4 IL-8基因多态性与HCC患病风险的多因素Logistic回归分析
与IL-8-251位点TT野生型基因携带者相比,携带AT杂合突变型基因者罹患HCC的风险增加(OR=1.99,95%CI:1.01~3.85), 携带 AA 纯合突变基因型者与HCC的患病风险无统计学关联(OR=1.06,95%CI:0.82~1.75)。 而与+781 位点 CC 野生基因型个体相比,携带突变基因型CT、TT者罹患HCC的风险增加 (CT基因型 OR=1.78,95%CI:1.03~3.1;TT 基因型 OR=1.36,95%CI:1.01~2.62)。 结果见表3。

表3 2位点多态性与HCC患病风险的多因素Logistic回归分析
2.5 2位点联合基因型与HCC发生风险的关联
本研究显示,与携带-251位点、+781位点TTCC联合基因型的个体相比,携带AT-CT、TT-CT及AT-CC联合基因型的个体罹患HCC的风险增加(AT-CT 基因型 OR=2.10,95%CI:1.52~2.9;TT-CT基因型 OR=3.33,95%CI:1.01~10.50;AT-CC 基因型OR=3.67,95%CI:2.28~5.90)。 而携带 AA-TT、AACT、TT-TT联合基因型者罹患HCC的风险无统计学关联。见表4。
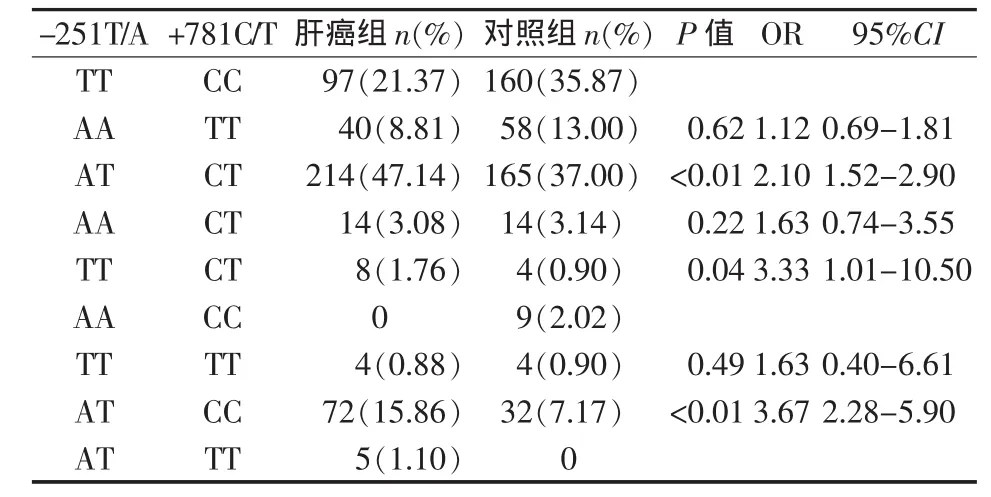
表4 2个多态位点联合基因型与HCC发生风险的关联结果
2.6 IL-8基因多态性与不同暴露因素在HCC发病中的交互作用分析
本研究发现,-251位点SNP与饮酒、HBV感染、肝癌家族史因素在HCC的发生中存在正交互作用,该位点SNP与年龄、性别、吸烟因素在HCC的发生中存在负交互作用。+781位点SNP与饮酒、肝癌家族史因素在HCC的发生中存在正交互作用,而该位点SNP与年龄、性别、吸烟、HBV感染这些因素在HCC的发生中存在负交互作用。现将吸烟、饮酒、HBV感染、肝癌家族史阳性与否的结果见表 5、6。

表5 -251T/A位点SNP与多种暴露因素在HCC发生中的交互作用

表6 +781C/T位点SNP与多种暴露因素在HCC发生中的交互作用
3 讨论
肝癌的发病机制十分复杂,其发生、发展和转移与多种基因的突变、细胞信号传导通路和新生血管增生异常等因素密切相关。IL-8作为一种多能α型趋化因子,对多种白细胞有趋化、激活作用,在炎症、免疫反应、动脉硬化及DIC中起到一定作用;同时其也是促血管生成因子,可促进血管内皮细胞在血管生成过程中的应答,增强内皮细胞和肿瘤细胞存活及扩散,并促进肿瘤部位的肿瘤细胞、内皮细胞和浸润性嗜中性粒细胞迁移。与肿瘤血管新生、生长以及肿瘤的侵袭转移有密切关系,影响肿瘤的治疗和预后。IL-8信号表达可通过以下途径:①调节多种转录因子的活动影响基因表达;②在翻译阶段调节细胞蛋白质组;和(或)③通过调节蛋白的翻译后调节影响细胞骨架,从而激活多个上游的信号传导通路[6]。IL-8基因位于人染色体4q13-q21区域,由4个外显子、3个内含子和1个启动子构成。IL-8的产生受包括-251A/T在内的的启动子区域的控制。启动子区发生突变,可影响IL-8基因转录,导致IL-8产生受到影响。内含子区+781 C/T定位于CAAT盒的上游,可以结合CAAT/增强子结合蛋白B(C/EBPb),从而促进IL-8基因的转录和调节作用。内含子区发生突变,可导致真核基因剪接信号的改变,使得内含子以隐外显子的方式出现在真核RNA中,编码出无活性的蛋白质,从而影响IL-8的功能。近年来,许多研究发现IL-8基因多态性与胃癌、乳腺癌、鼻咽癌、舌癌、口腔鳞癌等多种肿瘤的易感性相关[7-12]。但该基因多态性与肝癌的遗传易感性的关联研究不多,尤其缺少国内人群的相关报道。本研究结合南通地区肝癌高发的特点,进行该基因-251T/A和+781C/T位点多态性与南通地区人群肝癌遗传易感性的关联研究。结果显示,IL-8-251位点杂合突变基因型AT及+781位点突变基因型CT、TT是南通地区人群罹患HCC的易感基因型。-251位点纯合突变基因型AA在本研究中虽然未达到统计学检验标准,但显示为边缘阳性(P=0.05)。鉴于本研究的初期样本量较小,可能会产生一定的偏倚,我们后续研究将通过进一步增加样本量来验证该位点多态性与HCC发生存在关联。而台湾地区 Chien等[13]研究发现,IL-8+781位点 TT基因型较CC基因型发生HCC的风险显著降低(OR=0.346,95%CI:0.132~0.909), 与本研究结果不一致,可能原因包括:一是不同地区人群具有异质性;二是肝癌是多基因多位点突变共同造成的结果,不仅仅是由单一基因单个位点突变所致,单个位点是否发生突变并不能直接导致肝癌的发生。另外,本研究发现,-251、+781 2位点不同联合基因型中,AT-CT、TT-CT及AT-CC3种联合基因型的个体罹患肝癌的风险增加。复杂疾病一般由多种遗传与环境因素以及它们之间的相互作用引起,并促使其发生发展。目前已经有很多研究证据表明,肝癌的发生是基因与环境交互作用的共同结果[14-16]。本文针对IL-8基因上的2个SNP位点展开研究,发现其与年龄、性别、吸烟、饮酒、HBV感染、家族史等方面存在交互作用,为后续的进一步研究提供了线索,也为个体化治疗提供了一定的研究方向。肝癌的发病机制十分复杂,其发生绝非单一分子事件,只有当多种基因同时发生改变、协同作用,方可增加发生肝癌的危险性。分析易感基因的某种基因型频率在肝癌患者与正常对照人群中的分布差异,只能确定某基因型个体对肝癌的易感性,仅是肝癌遗传机制中的诸多作用因素之一。本研究仅选择了IL-8基因的2个多态位点,且样本量较小,所以只能视其为一个初步研究。今后我们应该加强于肝癌发生相关的细胞信号传导通路中的多基因交互作用,在大样本基础上对多个基因的交互作用与肝癌发生关联进行研究。如加强基因与基因之间以及基因与不同环境影响因素交互作用的研究,构建肝癌易感基因单体型图,或将有助于增加对肝癌的认识,为从基因水平更好的采取预防、诊断和治疗措施打下理论基础。
[1]米登海,罗好曾,陈学鹏,等.肝癌遗传模式与危险因素病例-对照研究[J].中国公共卫生, 2006, 22: 849-850.
[2]Hirankarn N,Kimkong I,Kummee P,et al.Interleukin-1beta gene polymorphism associated with hepatocellular carcinoma in hepatitis B virus infection [J].World J Gastroenterol,2006,12:776-779.
[3]Tseng LH,Lin MT,Shau WY,et al.Correlation of interleukin-10 gene haplotype with hepatocellular carcinoma in Taiwan [J].Tissue Antigens,2006,67:127-133.
[4]仇小强,贝春华,余红平,等.广西地区人群IL-6及IL-10单核苷酸多态性与HBV相关肝癌关联研究[J].中华流行病学杂志,2011,32:510-513.
[5]Wei YG,Liu F,Li B,et al.Interleukin-10 gene polymorphisms and hepatocellular carcinoma susceptibility:A meta-analysis[J].World JGastroenterol,2011,17:3941-3947.
[6]Waugh DJ,Wilson C.The interleukin-8 pathway in cancer[J].Clin Cancer Res,2008,14:6735-6741.
[7]Gao LB,Pan XM,Jia J,et al.IL-8-251A/T polymorphism is associated with decreased cancer risk among population-based studies:Evidence from a meta-analysis [J].Eur JCancer,2010,46:1333-1343.
[8]Wang N,Zhou R,Wang C,et al.-251 T/A polymorphism of the interleukin-8 gene and cancer risk:a HuGE review and metaanalysis based on 42 case-control studies [J].Mol Biol Rep,2012,39:2831-2841.
[9]Liu L,Zhuang W,Wang CY,et al.Interleukin-8-251 A/T gene polymorphism and gastric cancer susceptibility:a meta-analysis of epidemiological studies[J].Cytokine,2010,50:328-334.
[10]Zhang L,Du C,Guo X,et al.Interleukin-8-251A/T polymorphism and helicobacter pylori infection influence risk for the development of gastric cardiac adenocarcinoma in a highincidence area of China[J].Mol Biol Rep,2010,37:3983-3989.
[11]Huang Q,Wang C,Qiu LJ,et al.IL-8-251A>T polymorphism isassociated with breast cancer risk:a meta-analysis[J].JCancer Res Clin Oncol,2011,137:1147-1150.
[12]Shimizu Y,Kondo S,Shirai A,et al.A single nucleotide polymorphism in the matrix metalloproteinase-1 and interleukin-8 gene promoter predicts poor prognosis in tongue cancer[J].Auris Nasus Larynx,2008,35:381-389.
[13]Chien MH,Yeh CB,Li YC,et al.Relationship of interleukin-8 gene polymorphisms with hepatocellular carcinoma susceptibility and pathological development[J].JSurg Oncol,2011,104:798-803.
[14]曾小云,黄金梅,许 杨,等.肝癌病例中XRCC1基因多态性与环境因素的交互作用分析[J].中华肿瘤防治杂志,2012,19: 1281-1284.
[15]Falleti E,Fabris C,Toniutto P,et al.Interleukin-6 polymorphisms and gender:relationship with the occurrence of hepatocellular carcinoma in patients with end-stage liver disease[J].Oncology,2009,77:304-313.
[16]Kew MC.Epidemiology of chronic hepatitis B virus infection,hepatocellular carcinoma, and hepatitis B virus-induced hepatocellular carcinoma[J].Pathol Biol(Paris),2010,58:273-277.
