桃叶珊瑚苷对脑出血大鼠的神经保护作用及对肿瘤坏死因子α的影响研究
2015-03-25刘秋庭姚靓涂鄂文谭莉李晓辉王照
刘秋庭,姚靓,涂鄂文,谭莉,李晓辉,王照
·论著·
桃叶珊瑚苷对脑出血大鼠的神经保护作用及对肿瘤坏死因子α的影响研究
刘秋庭,姚靓,涂鄂文,谭莉,李晓辉,王照
目的探讨桃叶珊瑚苷(AU)对脑出血大鼠的神经保护作用及对肿瘤坏死因子α(TNF-α)的影响。方法将90只健康SD大鼠随机分成假手术组、脑出血组、AU治疗组,每组30只。脑出血组及AU治疗组大鼠于尾壳核区注入自体非肝素抗凝动脉血,建立脑出血动物模型,假手术组于相同部位注入0.9%氯化钠溶液。造模成功后,AU治疗组于术后6 h给予AU腹腔注射,脑出血组在相同时间给予相同剂量0.9%氯化钠溶液腹腔注射。各组分别在造模后12 h、2 d、3 d、5 d、7 d取6只大鼠,参照Longa 5级评分法进行神经功能缺损评分、采用HE染色并计算血肿周围脑组织白细胞数目、采用免疫组化法检测血肿周围脑组织中TNF-α表达情况。结果AU治疗组和脑出血组大鼠造模后12 h神经功能缺损评分比较,差异无统计学意义(P>0.05);AU治疗组大鼠造模后2 d、3 d、5 d、7 d神经功能缺损评分低于脑出血组(P<0.05)。脑出血组大鼠造模后12 h、2 d、3 d、5 d、7d血肿周围脑组织中白细胞数目和TNF-α阳性细胞数多于AU治疗组,AU治疗组多于假手术组(P<0.05)。结论AU对脑出血大鼠具有神经保护作用,其作用机制可能与抑制血肿周围脑组织TNF-α的表达有关。
脑出血;桃叶珊瑚苷;神经保护;肿瘤坏死因子;大鼠
刘秋庭,姚靓,涂鄂文,等.桃叶珊瑚苷对脑出血大鼠的神经保护作用及对肿瘤坏死因子α的影响研究[J].实用心脑肺血管病杂志,2015,23(3):34-37.[www.syxnf.net]
Liu QT,Yao J,Tu EW,et al.Neuroprotective effect of Aucubin and its impact on TNF-α in rats with cerebral hemorrhage[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(3):34-37.
脑出血(intracerebral hemorrhage)是神经内科的多发病和常见病,具有病死率高及致残率高等特点。脑出血急性期脑组织发生一系列病理生理变化,其中炎性反应在脑出血后继发性脑损伤中发挥了重要作用[1]。吴玉强等[2]研究显示,脑出血过程中血浆肿瘤坏死因子α (TNF-α)水平与出血量呈正相关,出血量越大血浆TNF-α水平增高越明显。桃叶珊瑚苷(aucubin,AU)属于环烯醚萜苷类,是杜仲、车前草、地黄等中草药的有效成分之一,其药理作用较广泛[3],能抑制由抗原刺激产生的TNF-α和白介素6(IL-6)的基因表达与蛋白质合成[4]。本研究通过观察脑出血大鼠不同时间点神经功能缺损评分、血肿周围脑组织中白细胞数目和TNF-α表达情况,旨在探讨AU对脑出血大鼠的神经保护作用及对TNF-α的影响。
1 材料与方法
1.1 动物及试剂健康雄性SD大鼠90只,购于上海斯莱克实验动物有限公司,体质量为250~270 g。AU购于四川维克奇生物科技有限公司;免抗大鼠TNF-α免疫组化试剂盒购于武汉博士德生物试剂公司;通用型二抗免疫组化试剂盒购于北京中山金桥生物试剂公司。
1.2 分组及试验方法将90只SD大鼠随机分成假手术组、脑出血组、AU治疗组,每组30只。AU治疗组于造模后6 h给予AU 4.2 mg/kg[5],腹腔注射,1次/d;假手术组和脑出血组在同样时间给予相同剂量的0.9%氯化钠溶液,腹腔注射,1次/d。各组分别在造模后12 h、2 d、3 d、5 d、7 d随机选取6只大鼠,评价神经功能缺损评分、测定血肿周围组织中白细胞数目和TNF-α表达情况。
1.3 模型制备脑出血组和AU治疗组参照Rosenberg等报道的方法制备大鼠脑出血模型。采用10%水合氯醛(400 mg/kg)腹腔麻醉大鼠,将大鼠俯卧位固定在立体定位仪上,调节门齿托的高度,使大鼠前、后囟处于同一水平,沿头皮正中切一长10 mm切口,无菌操作暴露前囟,于前囟前0.2 mm,中线向右旁开3 mm处钻一直径为0.5 mm的小孔,进针深度为5.5 mm(即尾壳核位置)。取大鼠尾静脉自体不凝血50 μl,用微量进样器在8~10 min内缓慢、多次、少量注入,注血结束留针10 min后缓慢退针,局部用骨蜡封闭后缝合皮肤。假手术组于相同部位注入等量无菌0.9%氯化钠溶液。以术后见明显肢体瘫痪,大鼠脑切片中有明显的圆形、椭圆形或不规则形的血肿存在为脑出血模型造模成功标准,不符合以上标准及死亡者剔除。所有操作在无菌条件下进行,术毕将大鼠放回笼中饲养,自由活动,禁食禁水。
1.4 观察指标评定脑出血组和AU治疗组大鼠造模后不同时间点神经功能缺损评分;观察3组大鼠造模后不同时间点血肿周围脑组织中白细胞数目和TNF-α表达情况。
1.4.1 神经功能缺损评分脑出血组、AU治疗组参照Longa 5级评分法[5]对神经功能缺损程度进行评分,0级:无体征,计0分;1级:动物不能完全伸直其前肢,计1分;2级:动物一侧肢体瘫痪,有追尾现象,计2分;3级:动物不能站立或打滚,计3分;4级:无自发性活动,有意识障碍,计4分。
1.4.2 标本选取及病理切片制作造模成功大鼠,在12 h、2 d、3 d、5 d、7 d经水合氯醛深度麻醉满意后,于剑突下横切口,沿膈肌与胸廓交界处剪开膈肌,暴露心脏,于心尖向上进针,插入升主动脉,固定针头,剪开右心耳,快速滴入37℃0.9%氯化钠溶液100 ml,至右心耳流出液体变清亮,后用4℃的多聚甲醛(0.1 mmol/L PBS配制,pH值7.2~7.4)灌注(10 ml/ min),先快后慢,约250 ml。断头开颅取全脑,去除嗅脑、小脑和低位脑干,将脑组织置于4%多聚甲醛中固定48 h。以穿刺点为中心分别向前、后各移1.0 mm,将脑组织冠状切开,修成包含出血区及周边区的4 mm长、厚约2 mm的脑片,常规石蜡包埋,然后在切片机上连续切片,片厚2 μm,行免疫组化染色和HE染色。
1.4.3 HE染色测定血肿周围脑组织中白细胞数目切片脱蜡至水,放入苏木精水溶液染色数分钟,之后放入酸水及氨水中分色数秒钟,流水冲洗1 h入蒸馏水片刻,入70%和90%乙醇中脱水各10 min,入乙醇伊红染色液染色2~3 min,树胶盖玻片封固。在400倍视野下,用计算机图像分析系统软件随机观察并计数血肿周围4个不重复视野的白细胞数目,取其平均值。
1.4.4 免疫组化染色检测血肿周围脑组织中TNF-α的表达切片常规脱蜡至水,0.01M枸橼酸钠缓冲液微波修复10 min;滴加一抗,4℃过夜,PBS漂洗2 min× 3次;加二抗,37℃孵育30 min,PBS漂洗2 min×3次;DAB显色,中性树胶封片。TNF-α免疫组化染色着色于细胞质和细胞膜,免疫组化阳性细胞胞质和胞膜可见棕黄色颗粒,细胞无色或淡黄色为阴性。在400倍视野下,用计算机图像分析系统软件随机观察并计数血肿周围4个不重复视野的TNF-α阳性细胞数,取其平均值。
1.5 统计学方法应用SPSS 13.0统计学软件进行数据处理,计量资料以(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验;两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 脑出血组和AU治疗组大鼠神经功能缺损评分比
较两组大鼠造模后12 h神经功能缺损评分比较,差异无统计学意义(P>0.05);AU治疗组大鼠造模后2 d、3 d、5 d、7 d神经功能缺损评分低于脑出血组,差异有统计学意义(P<0.05)。两组大鼠神经功能缺损程度呈先严重后减轻趋势,造模3 d时最为严重(见表1)。
表1 两组大鼠造模后不同时间点神经功能缺损评分比较(±s,分)Table 1 Comparison of neural function defect score between the two groups of rats at different time points after modeling
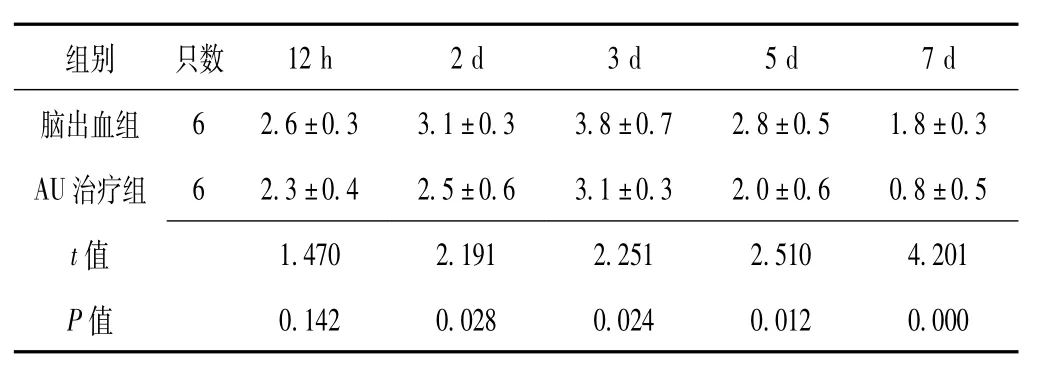
表1 两组大鼠造模后不同时间点神经功能缺损评分比较(±s,分)Table 1 Comparison of neural function defect score between the two groups of rats at different time points after modeling
62.6±0.33.1±0.33.8±0.72.8±0.51.8±0.3 AU治疗组62.3±0.42.5±0.63.1±0.32.0±0.60.8±0.5 t 12 h2 d3 d5 d7 d脑出血组组别只数1.4702.1912.2512.5104.201 P值值0.1420.0280.0240.0120.000
2.2 3组大鼠血肿周围脑组织中白细胞数目比较3组大鼠造模后12 h、2 d、3 d、5 d、7 d血肿周围脑组织中白细胞数目比较,差异有统计学意义(P<0.05);其中脑出血组大鼠造模后12 h、2 d、3 d、5 d、7 d血肿周围脑组织中白细胞数目高于AU治疗组,AU治疗组大鼠高于假手术组,差异均有统计学意义(P<0.05)。假手术组仅见少许白细胞浸润,而脑出血组和AU治疗组在造模后12 h病灶周围即有明显白细胞浸润,造模后3 d达高峰,见表2。
表2 3组大鼠造模后不同时间点血肿周围脑组织中白细胞数目比较(±s,个)Table 2 Comparison of WBC count in brain tissue around hematoma among 3 groups of rats at different time points after modeling
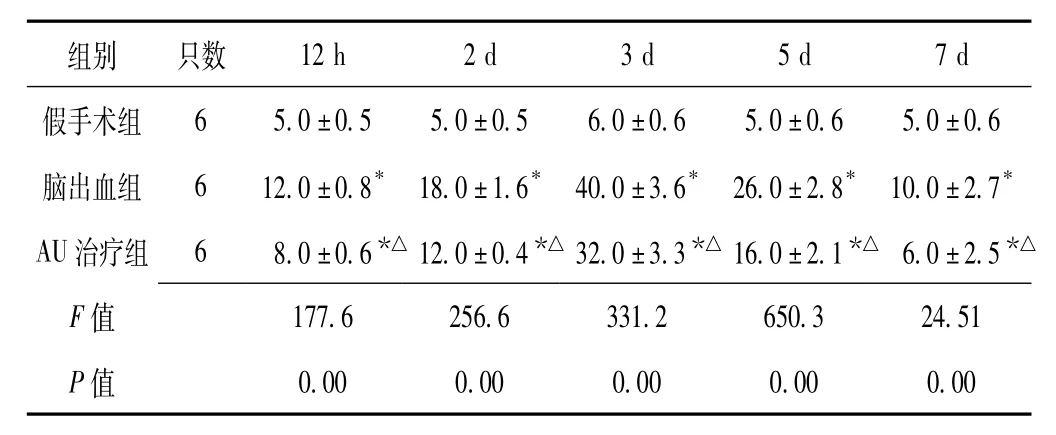
表2 3组大鼠造模后不同时间点血肿周围脑组织中白细胞数目比较(±s,个)Table 2 Comparison of WBC count in brain tissue around hematoma among 3 groups of rats at different time points after modeling
注:与假手术组比较,*P<0.05;与脑出血组比较,△P<0.05
组别只数65.0±0.55.0±0.56.0±0.65.0±0.65.0±0.6脑出血组612.0±0.8*18.0±1.6*40.0±3.6*26.0±2.8*10.0±2.7*AU治疗组68.0±0.6*△12.0±0.4*△32.0±3.3*△16.0±2.1*△6.0±2.5*△F 12 h2 d3 d5 d7 d假手术组177.6256.6331.2650.324.51 P值值0.000.000.000.000.00
2.3 3组大鼠血肿周围脑组织中TNF-α阳性细胞数比较3组大鼠造模后12 h、2 d、3 d、5 d、7 d血肿周围脑组织中TNF-α阳性细胞数比较,差异有统计学意义(P<0.05);其中脑出血组大鼠血肿周围脑组织中TNF-α阳性细胞数多于AU治疗组,AU治疗组多于假手术组,差异均有统计学意义(P<0.05)。假手术组仅见少量深棕黄色染色细胞,脑出血组和AU治疗组造模后12 h血肿区域即出现深棕黄色染色细胞,并于造模后3 d达高峰,见表3。
表3 3组大鼠造模后不同时间点血肿周围脑组织中TNF-α阳性细胞数比较(±s,个)Table 3 Comparison of TNF-α positive cell count in brain tissue around hematoma among 3groups of rats at different time points after modeling
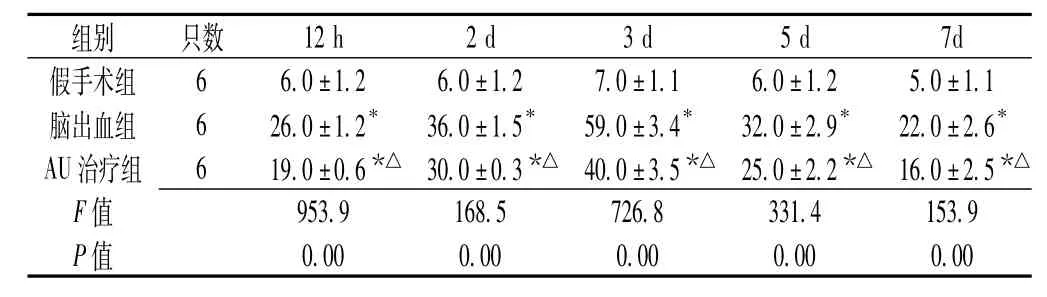
表3 3组大鼠造模后不同时间点血肿周围脑组织中TNF-α阳性细胞数比较(±s,个)Table 3 Comparison of TNF-α positive cell count in brain tissue around hematoma among 3groups of rats at different time points after modeling
注:与假手术组比较,*P<0.05;与脑出血组比较,△P<0.05
组别只数66.0±1.26.0±1.27.0±1.16.0±1.25.0±1.1脑出血组626.0±1.2*36.0±1.5*59.0±3.4*32.0±2.9*22.0±2.6* AU治疗组619.0±0.6*△30.0±0.3*△40.0±3.5*△25.0±2.2*△16.0±2.5*△F 12 h2 d3 d5 d7d假手术组953.9168.5726.8331.4153.9 P值值0.000.000.000.000.00
3 讨论
脑出血后神经组织损伤的病理生理机制十分复杂,具有多因素参与、同步相互作用的特点。实验表明,血肿周围的炎性反应高峰和细胞死亡高峰均发生在自体血注入脑实质后48~72 h,表明炎性反应与脑出血引起的细胞损伤有关,炎性反应参与了脑出血后继发性脑损伤的病理过程,是脑出血后继发性脑损伤不可忽视的因素[6]。而脑组织炎性反应过程以小胶质细胞激活和白细胞浸润为主,Longa等[6]研究发现,脑出血后6 h多形核白细胞在小血管内聚集,2 d后在出血处脑实质内浸润。金雷等[7]则报道,脑出血后6~12 h血肿周围出现中性粒细胞浸润,48~72 h达到高峰。
肿瘤坏死因子是一种具有广泛生物学效应的细胞因子,是脑损伤后出现的多向性细胞因子,其不仅是有效的肿瘤杀伤因子,还是机体炎症与免疫应答的重要调节因子。TNF-α是经典的炎性细胞因子,其参与全身炎性反应,与内皮细胞结合可增加过氧化物阴离子、刺激细胞脱颗粒和分泌髓过氧化物酶,从而使内皮细胞分泌白介素8(IL-8)、白介素(IL-1)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等炎性细胞因子,并促进中性粒细胞在内皮细胞上黏附,进而刺激机体局部发生炎性反应;同时TNF-α通过刺激单核细胞和巨噬细胞合成及释放IL-1、IL-8而导致炎症进一步发展。Zhang等[8]研究证明,脑出血大鼠出血侧皮质脑组织神经元、神经胶质细胞质有TNF-α表达,48~72 h达高峰,且与脑含水量呈正相关。Castillo等[9]研究发现,脑出血患者发病后3~4 d血肿周围水肿程度与发病后24 h TNF-α水平呈正相关。本研究采用新鲜未抗凝自体血注入大鼠尾状核模拟人体脑出血,并在不同时间点进行动态观察发现,脑出血组和AU治疗组血肿周围脑组织TNF-α表达增高,3 d达高峰,呈先增高后降低的趋势;脑出血组大鼠白细胞浸润明显,3~5 d达高
峰,血肿周围脑组织TNF-α阳性细胞数、白细胞数目与神经功能缺损严重程度高峰一致,与以往研究基本一致,进一步证实TNF-α能促进炎性反应发生,加重脑出血后继发性脑损伤。因此,抑制炎性细胞因子、维持体内生理平衡将可能成为减轻脑出血后继发性脑损伤的新途径。
AU属于环烯醚萜苷类,具有广泛的药理作用。Jeong等[4]研究发现,AU能够抑制抗原刺激的碱性粒细胞-2H3肥大细胞中转录因子κB(NF-κB)的p65亚基由细胞质向核内移位,并通过阻止IkBa的磷酸化和降解使胞质内IkBa水平升高,进而抑制NF-κB活性、下调TNF-α和IL-6的合成与表达。本研究结果表明,AU治疗组神经功能缺损评分及血肿周围脑组织中TNF-α阳性细胞数和白细胞数目低于脑出血组,提示AU能抑制TNF-α的合成和表达,进而减少炎性细胞的趋化、聚集,减轻炎性反应及脑出血后继发性脑损伤。
综上所述,降低TNF-α可能是AU减轻脑出血后急性炎性反应、阻止脑出血后继发性脑损伤、发挥神经保护作用的机制之一,为AU在脑出血急性期的应用提供了理论依据。
[1]Gong C,Hoff JT,Keep RF.Acute inflammatory reactionfollowing experimental intracerebral hemorrhage in rat[J].Brain Res,2000, 871(1):57-65.
[2]吴玉强,张海宇,刘敏,等.红花注射液对试验大鼠脑出血灶周围凋亡神经元的保护作用观察[J].中国中医药资讯,2010,2 (16):275-276.
[3]Thiex R,Tsirka SE.Brain edema after intracerebral hemorrhage: mechanisms,treatmentoptions,managementstrategies,and operative indications[J].Neurosurg Focus,2007,22(5):E6.
[4]Jeong HJ,Koo HN,Na HJ,et al.Inhibition of TNF-alpha and IL-6 production by Aucubin through blockade of NF-kappa B activation RBL-2H3 mast cells[J].Cytokine,2002,18(5): 252-259.
[5]Xue M,Del Bigio MR.Intracerebral injection of autologous whole blood in rats:time course of inflammation and cell death[J]. Neurosci Lett,2000,283(3):230-232.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebralartery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7]金雷,薛宏宇,金礼吉,等.桃叶珊瑚苷对糖尿病大鼠线粒体的抗氧化作用[J].山西医药,2008,48(4):16-17.
[8]Zhang X,Li H,Hu S,et al.Brain edema after intracerebral hemorrhage in rats:The role of inflammation[J].Nuerology India,2006,54(4):402-407.
[9]Castillo J,Davalos A,Aivarez-sabin J,et al.Molecular signatures of brain injury after intracerebral hemorrhage[J].Neurology,2002,58(4):624-629.
Neuroprotective Effect of Aucubin and Its Impact on TNF-α in Rats with Cerebral Hemorrhage
LIU Qiu-ting,YAO Jing,TU E-wen,et al.
Department of Neurology,Brain Hospital of Hu'nan,Changsha 410007,China
ObjectiveTo explore the neuroprotective effect of Aucubin and its impact on TNF-α in rats with cerebral hemorrhage.MethodsA total of 90 adult male Sprague-Dawley rats were selected and randomly divided into groups A,B and C,each of 30 cases.Rats of A group were given sham-operation and 0.9%sodium chloride solution injection on tail putamen area,while rats of groups A and B given autologous non-heparin anticoagulation arterial blood injection on tail putamen area to establish animal model of cerebral hemorrhage.After 6 hours of surgery,rats of B group were given intraperitoneal injection of Aucubin,while rats of C group were given intraperitoneal injection of 0.9%sodium chloride solution.After 12 hours,2 days,3 days,5 days,7 days of surgery,6 rats were picked out of each group to evaluate the neural function score(by Longa 5-level scoring method),white blood cells count and cells count with positive TNF-α expression of brain tissues around hematoma(by HE staining and immunohistochemistry method,respectively).ResultsNo statistically significant differences was found of neural function score between groups B and C after 12 hours of surgery(P>0.05),while that of B group was significantly lower than that of C group after 2 days,3 days,5 days,7 days of surgery,respectively(P<0.05).White blood cells count and cells count with positive TNF-α expression of C group were significantly higher than those of B group(P<0.05),and those of B group were significantly higher than A group(P<0.05).ConclusionAucubin has certain neuroprotective effect on cerebral hemorrhage of rats,and its mechanism is likely to correlated with inhibition of TNF-α of brain tissues around hematoma.
Cerebral hemorrhage;Aucubin;Neuron protection;Tumor necrosis factor-alpha;Rats
R 743.347
A
10.3969/j.issn.1008-5971.2015.03.010
2014-10-10;
2015-01-16)
(本文编辑:谢武英)
湖南省科技厅科技项目(2013SK3214)
410007湖南省长沙市,湖南省脑科医院神经内科(刘秋庭,涂鄂文,谭莉,李晓辉,王照);湖南中医药大学临床医学院(姚靓)
姚靓,410007湖南省长沙市,湖南中医药大学临床医学院;E-mail:137574248@qq.com
