早期肠内给予膳食纤维复合卡巴胆碱对弥漫性颅脑损伤大鼠肠黏膜屏障功能的影响
2015-03-23唐明贵邱涵坤王宝华王印华柴海霞浦践一邱方
唐明贵,邱涵坤,王宝华,王印华,柴海霞,浦践一,邱方
·论著·
早期肠内给予膳食纤维复合卡巴胆碱对弥漫性颅脑损伤大鼠肠黏膜屏障功能的影响
唐明贵,邱涵坤,王宝华,王印华,柴海霞,浦践一,邱方
目的研究早期肠内给予膳食纤维复合卡巴胆碱对弥漫性颅脑损伤大鼠肠黏膜屏障功能的影响。方法从126只清洁级Wistar大鼠中不规则抽取20只大鼠作为假手术组(对照组),其余106只大鼠采用Marmarou模型制备法制备弥漫性颅脑损伤模型,最终建模成功64只,按随机数字表法分为0.9%氯化钠溶液组(NS组,n=32)和膳食纤维复合卡巴胆碱组(DF+CAR组,n=32)。对照组大鼠自由饮水,NS组大鼠建模成功后采用0.9%氯化钠溶液灌胃,DF+CAR组大鼠建模成功后采用膳食纤维+卡巴胆碱灌胃,灌胃量为15 ml·kg-1·(6 h)-1,不足时加0.9%氯化钠溶液。3组大鼠分别于建模后6 h、12 h、24 h、48 h处死(对照组各时间点5只,NS组和DF+CAR组各时间点8只)。比较各组大鼠不同时间点血浆二胺氧化酶(DAO)、D-乳酸水平及肠绒毛高度。结果NS组及DF+CAR组大鼠建模后6 h、12 h、24 h、48 h血浆DAO水平均高于对照组,DF+CAR组大鼠建模后6 h、12 h、24 h、48 h血浆DAO水平均低于NS组(P<0.05)。NS组及DF+CAR组大鼠建模后6 h、12 h、24 h、48 h血浆D-乳酸水平均高于对照组,DF+CAR组大鼠建模后12 h、24 h、48 h血浆D-乳酸水平均低于NS组(P<0.05)。NS组及DF+CAR组大鼠建模后6 h、12 h、24 h肠绒毛高度低于对照组,NS组大鼠建模后48 h肠绒毛高度低于对照组,DF+CAR组大鼠建模后24 h、48 h肠绒毛高度高于NS组(P<0.05)。结论早期肠内给予膳食纤维复合卡巴胆碱对弥漫性颅脑损伤大鼠肠黏膜屏障功能有一定的保护作用。
肠黏膜;颅脑损伤;膳食纤维;卡巴胆碱;二胺氧化酶;D-乳酸;大鼠,Wistar
唐明贵,邱涵坤,王宝华,等.早期肠内给予膳食纤维复合卡巴胆碱对弥漫性颅脑损伤大鼠肠黏膜屏障功能的影响[J].实用心脑肺血管病杂志,2015,23(4):50-53.[www.syxnf.net]
Tang MG,Qiu HK,Wang BH,et al.Impact of early enteral-intestinal dietary fiber combined with carbachol on intestinal mucosal barrier function of rats with diffuse craniocerebral injury[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(4):50-53.
随着临床营养学的发展,肠道的消化、吸收功能及其重要的屏障保护功能逐渐受到关注。肠黏膜屏障的完整性一旦被破坏,则通透性增加、肠道细菌移位将引发失控性炎性反应,最终导致多脏器功能障碍(MODS),且MODS是导致患者死亡的主要原因。但目前临床针对肠黏膜屏障功能的保护措施有限,新方法尚未形成。膳食纤维是一种复杂的混合物的总称,可为肠黏膜提供营养,利于肠上皮细胞的代谢及更新,卡巴胆碱具有抗炎作用。本实验通过复制弥漫性颅脑损伤大鼠模型,探讨早期胃肠给予膳食纤维复合卡巴胆碱对大鼠肠黏膜屏障功能的影响,现报道如下。
1 材料与方法
1.1 实验动物清洁级Wistar大鼠126只,成年雄性,由北京维通利华实验动物技术有限公司提供,体质量(350±20)g,适应性饲养1周,实验前12 h禁食不禁水。
1.2 实验试剂及仪器肠内营养试剂:卡巴胆碱(美国Sigma公司)、膳食纤维〔纽迪希亚(Nutricia荷兰)制药(无锡)有限公司〕、0.9%氯化钠溶液(河北联合大学附属医院制剂室);主要仪器:紫外可见分光光度记(DU-7)(美国Beckman公司)、A120S型电子天平(德国Sartorius公司)、TGL-16C高速台式离心机(上海安亭科学仪器厂)Olympus显微镜(日本)、HPIAS-1000彩色病理图像分析系统(武汉清平公司)。
1.3 实验分组不规则抽取20只大鼠作为假手术组(对照组),将其余106只大鼠按Marmarou模型制备法[1]制备大鼠弥漫性颅脑损伤模型,剔除建模不成功42只;将建模成功的64只大鼠按随机数字表法分为0.9%氯化钠溶液组(NS组,n=32)和膳食纤维复合卡巴胆碱组(DF+CAR组,n=32)。(1)对照组:自由饮水。(2)NS组:建模成功后采用0.9%氯化钠溶液灌胃;(3)DF+CAR组:建模成功后采用膳食纤维(8 g·kg-1·d-1)+卡巴胆碱〔100 μg·kg-1·(12 h)-1〕灌胃,灌胃量保持在15 m l·kg-1·(6 h)-1,不足时加0.9%氯化钠溶液。大鼠灌胃期间均自由饮水。3组大鼠分别于建模后6 h、12 h、24 h、48 h处死(对照组各时间点5只,NS组和DF+CAR组各时间点8只)。
1.4 模型制备采用10%水合氯醛3.5 ml/kg对大鼠进行腹腔注射麻醉后俯卧位固定于脑落体致伤床垫,头
部备皮,以75%乙醇消毒后沿中线矢状切开头皮(约15 mm),剥离骨膜,暴露冠状缝与人字缝,将不锈钢垫(直径10 mm,厚3 mm)固定于大鼠冠状缝与人字缝中间,而后铜柱(半球底面)沿垂直套管自由落下撞击大鼠颅骨顶部钢垫(打击后即刻移开大鼠,以免打击锤反弹造成头部二次击伤),致伤冲击力为0.675 kg,颅骨下陷约0.28 mm,直至大鼠重型弥漫性颅脑损伤后进行心肺复苏,复苏成功的大鼠常规消毒后缝合头皮切口。对照组大鼠在10%水合氯醛3.5 ml/kg腹腔注射麻醉后只切开头顶部皮肤,剥离骨膜后常规消毒缝合。
1.5 血浆二胺氧化酶(DAO)及D-乳酸水平检测从大鼠心尖穿刺抽血,送北京304医院创伤研究室由专人采用分光光度法检测血浆DAO及D-乳酸水平,随机单盲测值。
1.6 肠绒毛高度测定心尖穿刺采集完血样后立即在距回盲部5 cm处向头部取2 cm小肠进行固定、包埋、切片、HE染色。采用HPIAS-1000彩色病理图像分析系统观察HE染色切片,随机单盲测值,每张切片顺次取奇数视野,测20个小肠绒毛高度。
1.7 统计学方法采用SPSS 16.0统计学软件进行数据处理,计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血浆DAO水平3组大鼠建模后6 h、12 h、24 h、48 h血浆DAO水平比较,差异均有统计学意义(P<0.05);NS组及DF+CAR组建模后血浆DAO水平均高于对照组,但DF+CAR组建模后6 h、12 h、24 h、48 h血浆DAO水平均低于NS组,差异有统计学意义(P<0.05,见表1)。
表1 3组大鼠不同建模时间点血浆DAO水平比较(±s,U/m l)Table 1 Comparison of plasma DAO level among the three groups of rat at different time points

表1 3组大鼠不同建模时间点血浆DAO水平比较(±s,U/m l)Table 1 Comparison of plasma DAO level among the three groups of rat at different time points
注:与对照组比较,*P<0.05;与NS组比较,△P<0.05;NS组6 h、24 h各死亡1只,DF+CAR组24 h、48 h各死亡1只
5 0.23±0.07 0.27±0.03 0.21±0.08 0.29±0.02 NS组8 1.60±0.06*1.34±0.15*1.45±0.02*2.23±0.15*DF+CAR组8 1.52±0.03*△0.99±0.03*△0.96±0.18*△0.86±0.02*△F 6 h 12 h 24 h 48 h对照组组别只数0.00 0.00 0.00 0.00 1191.36 190.40 166.88 750.89 P值值
2.2 血浆D-乳酸水平3组大鼠建模后6 h、12 h、 24 h、48 h血浆D-乳酸水平比较,差异均有统计学意义(P<0.05);NS组及DF+CAR组建模后血浆D-乳酸水平均高于对照组,但DF+CAR组建模后12 h、24 h、48 h血浆D-乳酸水平均低于NS组,差异有统计学意义(P<0.05,见表2)。
表2 3组大鼠不同建模时间点血浆D-乳酸水平比较(±s,μg/ml)Table 2 Comparison of plasma D-lactate level among the three groups of rat at different time points
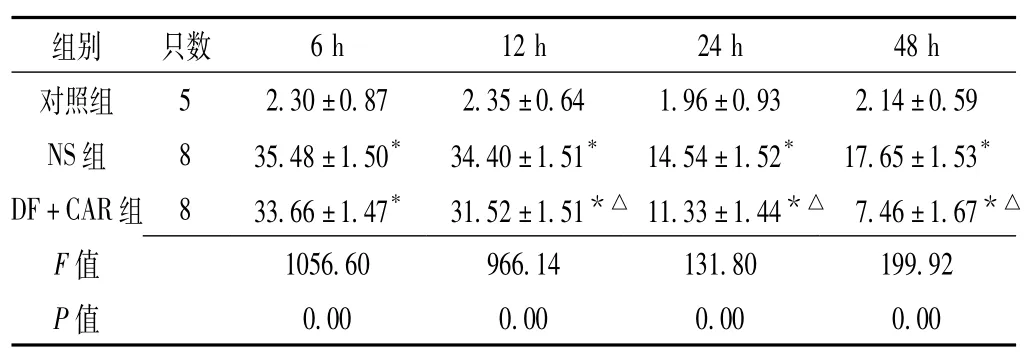
表2 3组大鼠不同建模时间点血浆D-乳酸水平比较(±s,μg/ml)Table 2 Comparison of plasma D-lactate level among the three groups of rat at different time points
注:与对照组比较,*P<0.05;与NS组比较,△P<0.05;NS组6 h、24 h各死亡1只,DF+CAR组24 h、48 h各死亡1只
组别只数5 2.30±0.87 2.35±0.64 1.96±0.93 2.14±0.59 NS组8 35.48±1.50*34.40±1.51*14.54±1.52*17.65±1.53*DF+CAR组8 33.66±1.47*31.52±1.51*△11.33±1.44*△7.46±1.67*△F 6 h 12 h 24 h 48 h对照组0.00 0.00 0.00 0.00 1056.60 966.14 131.80 199.92 P值值
2.3 肠绒毛高度3组大鼠建模后6 h、12 h、24 h、48 h肠绒毛高度比较,差异均有统计学意义(P<0.05); NS组及DF+CAR组建模后6 h、12 h、24 h肠绒毛高度低于对照组,NS组大鼠建模后48 h肠绒毛高度低于对照组,DF+CAR组建模后24 h、48 h肠绒毛高于NS组,差异有统计学意义(P<0.05,见表3)。
表3 3组大鼠不同建模时间点肠绒毛高度比较(±s,μm)Table 3 Comparison of intestinal villis height among the three groups of rat at different time points
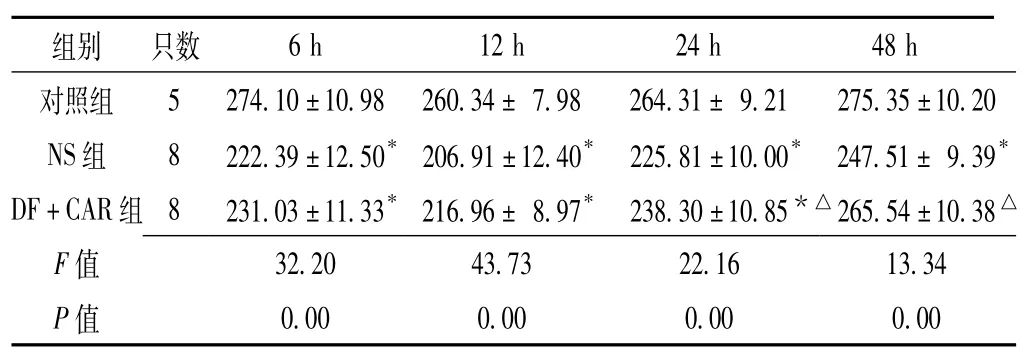
表3 3组大鼠不同建模时间点肠绒毛高度比较(±s,μm)Table 3 Comparison of intestinal villis height among the three groups of rat at different time points
组别只数35±10.20 NS组8 222.39±12.50*206.91±12.40*225.81±10.00*247.51±9.39*DF+CAR组8 231.03±11.33*216.96±8.97*238.30±10.85*△265.54±10.38△F 6 h 12 h 24 h 48 h对照组5 274.10±10.98 260.34±7.98 264.31±9.21 275.0.00 0.00 0.00 0.00 32.20 43.73 22.16 13.34 P值值
注:与对照组比较,*P<0.05;与NS组比较,△P<0.05;NS组6 h、24 h各死亡1只,DF+CAR组24 h、48 h各死亡1只
3 讨论
肠功能障碍是指肠实质和/或功能损害,导致消化、吸收和/或黏膜屏障功能障碍[2]。Malbrain等[3]将以肠缺血水肿、肠黏膜通透性增加为病理基础的综合征命名为急性肠损伤(ABI)或急性肠伤害综合征(AIDS),ABI/AIDS概括了机体在经受“三次打击”后肠道自身最基本的病理改变及其与全身各器官损伤的关系,而肠道复苏的核心为早期肠内营养(EEN)。黎介寿[2]研究表明,过早给予EN支持可能加重机体负担,危重症患
者在接受医疗处理24~48 h后呼吸、循环紊乱已得到基本纠正,内环境已进入较稳定状态,此时应给予肠内营养(EN)。有研究表明,约50%的小肠黏膜营养和80%的结肠黏膜营养来自肠腔内营养物质。危重患者早期机体处于高分解代谢、肠黏膜细胞营养缺乏状态,且应激状态下机体交感系统兴奋、胃肠血流减少、肠黏膜上皮细胞坏死、细胞凋亡增加均会破坏肠黏膜屏障,从而导致肠源性感染,甚至MODS。
膳食纤维不被机体消化吸收、不耗能、不增加肠道负担,分为可溶和不可溶两大类。可溶性膳食纤维的持水性可促进肠蠕动,减少肠内毒素的吸收;可溶性膳食纤维经肠道细菌发酵后产生短链脂肪酸可为肠黏膜上皮细胞供能,有益于肠黏膜上皮细胞的代谢及更新,维持肠黏膜屏障的完整。
卡巴胆碱是一种人工合成的拟胆碱药物,不易被胆碱酯酶水解,具有完全拟乙酰胆碱(Ach)作用,与M胆碱受体结合可发挥扩血管、促进胃肠动力、增加腺体分泌等作用,与胆碱能N受体α7亚基结合可发挥积极的抗炎作用。有研究表明,卡巴胆碱可减少烧伤、脓毒症后促炎因子的释放,减轻肠黏膜水肿,增加胃肠血流,改善脏器功能[4-5]。
本研究结果显示,弥漫性颅脑损伤大鼠肠绒毛短缩,血浆DAO及D-乳酸水平升高,提示肠黏膜损伤,完整性遭到破坏,通透性增加。DF+CAR组肠绒毛高度较NS组恢复快,在建模后24~48 h时表现明显;血浆DAO及D-乳酸水平分别从建模后6 h、12 h时较NS组下降,提示膳食纤维复合卡巴胆碱可减轻弥漫性颅脑损伤大鼠肠黏膜的损伤情况,恢复其完整性,降低其通透性。其机制可能与以下因素有关:膳食纤维可促进胃肠蠕动,并为肠黏膜上皮细胞提供营养及能量,增加胃肠血流[6],调节肠道菌群,益于益生菌的生长[7];卡巴胆碱能促进胃肠动力恢复,当与N受体结合时还可发挥胆碱能抗炎作用,抑制促炎因子和炎性递质的释放,减轻肠道局部及全身炎性反应,减轻肠道水肿,增加肠黏膜血流量及液体吸收量[8],抗氧自由基损伤[9],抑制肠上皮细胞和淋巴细胞凋亡[10],改善氧代谢指标[11]。
实验过程中大鼠未出现明显腹胀、腹泻,未观察到卡巴胆碱对大鼠呼吸、心率的明显抑制作用,但直至建模48 h,DF+CAR组血浆DAO、D-乳酸水平及肠绒毛高度均未恢复至对照组水平,因此还需增加样本量及延长实验观察时间,在不同动物模型中尝试膳食纤维与卡巴胆碱的不同配比及不同给药途径,为临床应用提供安全剂量及最佳给药途径。
综上所述,早期肠内给予膳食纤维复合卡巴胆碱对弥漫性颅脑损伤大鼠肠黏膜屏障功能有一定的保护作用。
[1]Marmarou A,Foda MA,van den Brink W,et al.A new model of diffuse brain injury in rats.Part I:Pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[2]黎介寿.肠衰竭——概念、营养支持与肠黏膜屏障维护[J].肠外与肠内营养,2004,11(2):65-67.
[3]Malbrain ML,De Laet I.AIDS is coming to your ICU:be prepared for acute bowel injury and acute intestinal distress syndrome…[J].Intensive Care Med,2008,34(9):1565-1569.
[4]胡森,白慧颖,张立俭,等.卡巴胆碱对脓毒症大鼠小肠组织含水率和促炎症因子水平的影响[J].解放军医学杂志,2009,34 (10):1198-1200.
[5]胡森,王海滨,车晋伟,等.卡巴胆碱对50%TBSA烧伤犬口服补液时组织灌流和脏器功能的影响[J].解放军医学杂志,2009,34(9):1058-1061.
[6]Cerda JJ,Robbins FL,Burgin CW,et al.Unstirred water layers in rabbit intestine:effects of guar gum[J].JPEN J Parenter Enteral Nutr,1987,11(1):63-66.
[7]Lesmes U,Beards EJ,Gibson GR,et al.Effects of resistant starch typeⅢpolymorphs on human colon microbiota and short chain fatty acids in human gut models[J].Agric Food Chem,2008,56 (13):5415-5421.
[8]耿世佳,包呈梅,吴静,等.卡巴胆碱对烫伤大鼠肠内补液时肠黏膜血流量、Na+-K+-ATP酶活性和水通道蛋白-1表达的影响[J].解放军医学杂志,2008,33(6):649-651.
[9]车晋伟,胡森,耿世佳,等.卡巴胆碱减轻大鼠烫伤休克期肠内补液时肠组织氧自由基的损伤[J].世界华人消化杂志,2008,16(8):900-903.
[10]邹晓防,胡森,吕艺,等.卡巴胆碱对肠上皮细胞氧化损伤保护作用研究[J].世界华人消化杂志,2007,15(12):213 -215.
[11]胡森,林凯,车晋伟,等.卡巴胆碱改善犬50%TBSA烧伤胃内补液时氧动力学指标[J].中国应用生理学杂志,2010,26 (2):237-240.
Im pact of Ear ly Enteral-intestinal Dietary Fiber Combined w ith Carbachol on Intestinal M ucosal Barrier Function of Rats w ith Diffuse Craniocerebral Injury
TANG Ming-gui,QIU Han-kun,WANG Bao-hua,et al.
ICU of the Affiliated Hospital of Hebei United University,Tangshan 063000
Objective To investigate the impact of early enteral-intestinal dietary fiber combined with carbachol on intestinal mucosal barrier function of rats with diffuse craniocerebral injury.M ethods A total of 126 cleaning Wistar rats were enrolled,and 20 rats were irregularly selected as control group and were given free drinking only;other rats were prepared for diffuse craniocerebral injury models by Marmarou method,and finally successfully prepared 64 rats.According to random number table,the 64 rats were divided into groups A and B,each of 32 rats,rats of A group were given gavage of 0.9%sodium chloride injection,rats of B group were given gavage of dietary fiber combined with carbachol,at a dose of 15 ml·kg-1·(6 h)-1(0.9%sodium chloride injection as supplement).After 6,12,24,48 hours of modeling,rats of each group were killed respectively(5 rats in control group,8 rats in groups A and B,respectively),and plasma levels of DAO and D-lactate,intestinal villis height were compared.Results Plasma DAO level of groups A and B was statistically significantly higher than that of control group after 6,12,24,48 hours of modeling,respectively;while plasma DAO level of B group was statistically significantly lower than that of A group after 6,12,24,48 hours of modeling,respectively(P<0.05).Plasma D -lactate level of groups A and B was statistically significantly higher than that of control group after 6,12,24,48 hours of modeling,respectively;while plasma D-lactate level of B group was statistically significantly lower than that of A group after 12,24,48 hours of modeling,respectively(P<0.05).Intestinal villis height of groups A and B was statistically significantly lower than that of control group after 6,12,24,48 hours of modeling,intestinal villis height of A group was statistically significantly lower than that of control group after 48 hours of modeling,intestinal villis height of B group was statistically significantly higher than that of A group after 24,48 hours of modeling(P<0.05).Conclusion Early enteral-intestinal dietary fiber combined with carbachol has some protective effect on intestinal mucosal barrier function of rats with diffuse craniocerebral injury.
Intestinal mucosa;Craniocerebral trauma;Dietary fiber;Carbachol;Diamine oxidase;D-lactate; Rats,Wistar
R 322.45
A
10.3969/j.issn.1008-5971.2015.04.015
2015-02-03;
2015-04-13)
(本文编辑:毛亚敏)
唐山市科技局基金资助项目(13130284z)
063000河北省唐山市,河北联合大学附属医院ICU(唐明贵,王宝华,王印华,柴海霞,浦践一);秦皇岛市第一医院ICU(邱涵坤,邱方)
浦践一,063000河北省唐山市,河北联合大学附属医院ICU;E-mail:pjy1971_5@sina.com
