EZH2蛋白在神经细胞发育中的表达变化
2015-03-23孙芳,郇通,潘云,李艳*
孙 芳,郇 通,潘 云,李 艳*
(1.大理大学基础医学院,云南大理 671000;2.大理大学附属医院,云南大理 671000)
蛋白甲基转移酶(EZH2)与果蝇zeste 基因增强子同源,是多梳蛋白抑制复合物2(PRC2)蛋白复合物(Ploycmb Repressive Complex 2)的一个催化亚基,通过SET 结构域催化组蛋白H3 赖氨酸第27 号位的三甲基化(H3K27me3),进一步介导转录抑制〔1〕。其在疾病尤其是肿瘤发生发展中的作用已经得到共识,成为当前研究的热点。研究表明,EZH2的过表达在许多不同类型的肿瘤中发现,比如前列腺癌、乳腺癌、膀胱癌等,与肿瘤的侵袭、演化以及不良预后有关〔2-5〕。在血液系统肿瘤中,EZH2 的过表达已经在成人T 细胞白血病/淋巴瘤、Burkitt’s 淋巴瘤、T/NK细胞淋巴瘤、套细胞淋巴瘤(MCL)、慢性淋巴细胞白血病(CLL)、B 细胞急性淋巴细胞白血病(B-ALL)、弥漫大B 细胞淋巴瘤(DLBCL)等多种淋巴系统肿瘤中被证实〔6-9〕。在神经系统肿瘤中,EZH2 与神经胶质瘤,恶性外周神经鞘膜瘤等肿瘤的发生发展、分级及治疗密切相关〔9-10〕。尽管EZH2在神经系统肿瘤中意义重大,EZH2 致肿瘤发生的作用机制大部分仍不清楚,目前的国内外基础研究也相当有限。我们成功建立了小鼠胚胎干细胞体外分化体系,观察EZH2 在胚胎干细胞诱导分化为神经细胞过程中的蛋白表达变化,为以后对EZH2蛋白功能与作用机制的进一步研究提供依据。
1 材料和方法
1.1 实验细胞系小鼠胚胎干细胞系E14Tg2A.4。
1.2 主要试剂、仪器设备及来源明胶(Millipore,ES-006-B);DMEM 培养基(Dulbecco’s minimal essential medium,Specialty media,SLM-220-M);胎牛血清(Hyclone,SH30071.03);非必需氨基酸(Specialty media,TMS-001-C);2-巯基乙醇(Specialty media,ES-007-E);L-谷氨酰胺(Specialty media,TMS-002-C);核苷酸(Specialty media,ES-008-D);青霉素-链霉素(Specialty media,TMSAB-2C);1 000 U/mL血病抑制因子(leukemia inhibitory factor,LIF;ESGRO,Millipore ESG1107);胰酶(tryple express Gibco:ref:12605-028,lot:1248224);DMSO(sigma,D2650);DPBS(REF14190144);维甲酸(RA,sigma,R2625-50MG);逆转录酶试剂盒(RevertAid First Strand cDNA Synthesis Kit,fermentas);Taq酶,Fast Green Master(ROX)(04913914001,Roche);BCA蛋白浓度测定试剂盒(碧云天,P0010S);超敏ECL 化学发光试剂盒(碧云天,P0018);EZH2一抗(BD Biosciences,612666);EZH2 二抗(Abcam ab6709);荧光定量PCR 仪(CFX96TMReal-Time system C1000,Bio-Rod);ECL 化学发光(thermo,Prod#34080);倒置显微镜(Primo Vert,ZEISS);Western blot所用电泳仪等为Bio-rad公司生产;显影设备为ImageQuant LAS 4000系统。
1.3 RA诱导小鼠胚胎干细胞向神经细胞分化实验E14Tg2A.4 培养在预铺有明胶涂层的细胞培养皿中,加入DMEM 完全培养基:80%DMEM 培养基,15%胎牛血清,1%非必需氨基酸,1%2-巯基乙醇,1%L-谷氨酰胺,1%核苷酸,1%青霉素-链霉素,1 000 U/mL血病抑制因子。在铺有明胶的10 cm培养皿中,DMEM 完全培养基培养2 d 后,收集细胞1.5×106,将细胞沉淀标记为第0 天(D0),同时按照1.5×106/10 cm 培养皿的密度种植于 5 个 10 cm 细胞培养皿,在撤去LIF 的DMEM 完全培养基中加入维甲酸(浓度为5×10-7mol/L)进行诱导,其间每天换液,第5 天诱导结束。于诱导分化第1 天(D1)、第2天(D2)、第3天(D3)、第4天(D4)、第5天(D5)收集细胞沉淀,标号。细胞培养期间每天倒置显微镜下观察细胞形态,并拍照保存。
1.4 RT-PCR 在干细胞分化过程中,按固定时间收获细胞,用TRN2ol 试剂提取RNA,然后用Super-Script III 逆转录酶,oligo(dT)作为引物合成cDNA,用SYBR green法作定量PCR反应。
1.5 Western blot 将收获的D0至D5细胞沉淀,用RIPA 裂解法制备全细胞裂解液,超声破碎,测蛋白浓度,按照 60 μg 的上样量进行 Western blot,用SDS-PAGE 蛋白电泳法分离蛋白,用湿转膜的方法把蛋白转移到硝酸纤维素膜上(转膜条件:4 ℃,恒流,360 mA,1 h),3%脱脂牛奶室温封闭1 h,一抗室温孵育 1 h,TBST 洗 3 次,5 min/次,然后二抗孵育1 h,TBST 洗 3 次,5 min/次,ECL 化学发光,孵育5 min,ImageQuant LAS 4000 系统显影,应用Image Quant TL软件分析图像,计算相对蛋白含量。
1.6 统计学处理对各组的计量数据用均数±标准差表示。用SPSS17.0软件统计包进行统计,多组间的比较采用方差分析,总体差异显著后,进行Post Hoc两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 胚胎干细胞诱导分化过程中细胞形态上的变化形态学观察可见,胚胎干细胞(ESCs)呈椭圆或圆形,细胞核大,核仁明显。加入RA诱导1 d后,细胞逐渐变为三角形或多边形向外扩展,随后的几天开始伸出突起,变细变长,与邻近细胞交织成网,在诱导5 d后,形成密集的神经样网络,神经样细胞多呈双极性,胞体圆亮。整体来看,细胞形态已趋于一致。见图1。
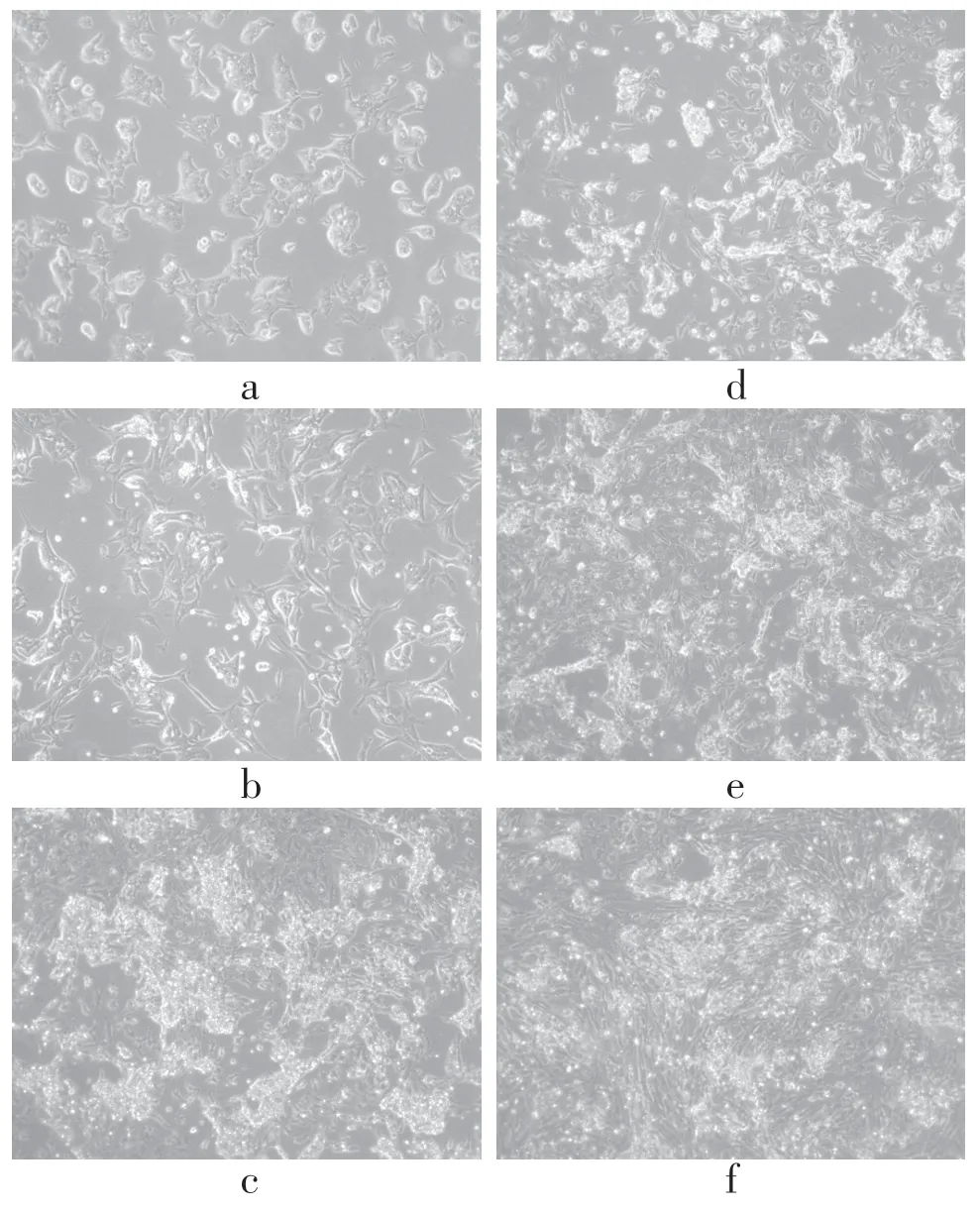
图1 胚胎肝细胞诱导分化过程中细胞形态变化
2.2Real-Time PCR验证胚胎干细胞标记物和神经细胞早期分化标记物结果胚胎干细胞标记Sox2、Oct3/4、Nanong 在诱导过程中mRNA 表达水平大幅度下降,神经细胞早期分化标记物Nestin、Tuj1、NeuroD、Nestin 在诱导过程中mRNA 表达水平大幅度上升。结合从细胞形态学变化和Real-Time PCR分析结果,确定小鼠胚胎干细胞向神经细胞诱导分化成功。见图2~3。
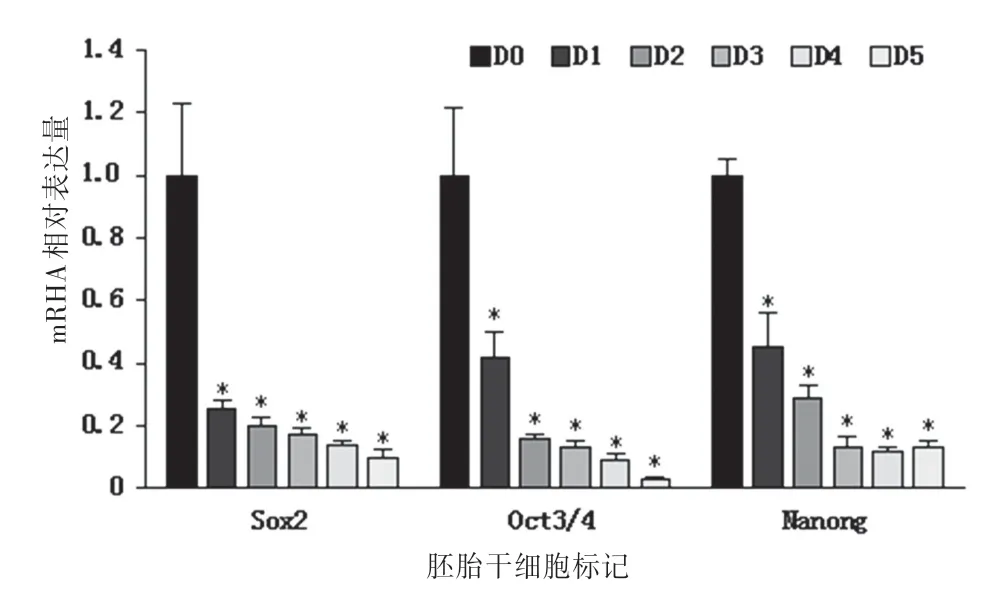
图2 胚胎干细胞标记物Sox2、Oct3/4、Nanong 在ESCs向神经细胞分化过程中mRNA的表达变化

图3 神经细胞早期分化标记物Nestin、NeuroD、Tuj1在ESCs向神经细胞分化过程中mRNA的表达变化
2.3胚胎干细胞向神经细胞分化过程中EZH2蛋白表达水平变化EZH2在小鼠胚胎干细胞中蛋白表达水平比较高(D0)。在撤去LIF 加入RA 诱导向神经干细胞分化1 d 后,EZH2 表达水平仍然较高。在RA 的持续作用下从第2 天开始EZH2 表达水平逐渐下降,在第5天降至最低。见图4~5。
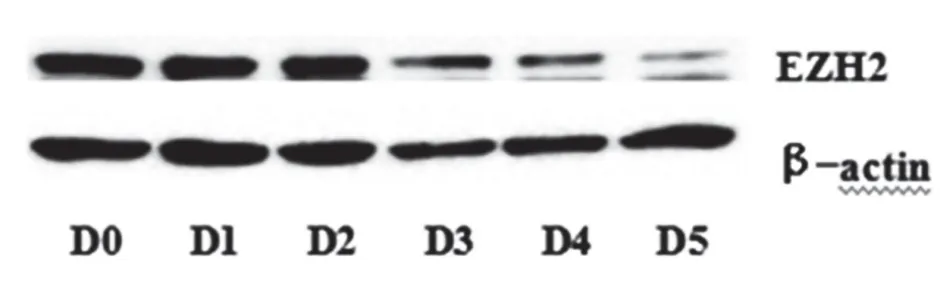
图4 EZH2在ESCs向神经细胞分化过程中蛋白表达量的变化
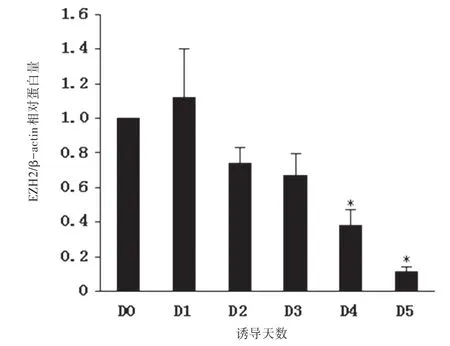
图5 在ESCs向神经细胞分化过程EZH2/β-actin相对蛋白含量的变化
3 讨论
本实验成功诱导了小鼠胚胎干细胞向神经细胞的分化,并且观察到EZH2 蛋白在小鼠胚胎干细胞中表达水平比较高(第0天),在撤去LIF加入RA诱导向神经胞分化1 d后EZH2表达水平仍然较高,在RA 的持续作用下从第2 天开始EZH2 表达水平逐渐下降,在第5天降至最低的变化。总的来说,本实验建立了小鼠胚胎干细胞向神经细胞分化的体系,观察到与神经发育疾病相关的EZH2 蛋白在神经细胞发育过程中的特异性表达变化,为下一步研究EZH2的作用机制打下了基础。
〔1〕Guo S Q,Zhang Y Z. Overexpression of enhancer of zests homolog 2 in lymphoma〔J〕.Chin Med J(Engl),2012,125(20):3735-3739.
〔2〕Yu J,Rhodes D R,Tomlins S A,et al. A polycomb repression signature in metastatic prostate cancer predicts cancer outcome〔J〕.Cancer Res,2007,67(22):10657-10663.
〔3〕Bracken A P,Pasini D,Capra M,et al.EZH2 is downstream of the pRB-E2F pathway,essential for proliferation and amplified in cancer〔J〕.EMBO J,2003,22(20):5323-5335.
〔4〕Varambally S,Dhanasekaran S M,Zhou M,et al. The poly-comb group protein EZH2 is involved in progression of prostate cancer〔J〕.Nature,2002,419(6907):624-629.
〔5〕Chase A,Cross N C. Aberrations of EZH2 in cancer〔J〕.Clin Cancer Res,2011,17(9):2613-2618.
〔6〕Chen J,Li J,Han Q,et al. Enhancer of zeste homolog 2 is overexpressed and contributes to epigenetic inactivation of p21 and phosphatase and tensin homolog in B-cell acute lymphoblastic leukemia〔J〕.Exp Biol Med(Maywood),2012,237(9):1110-1116.
〔7〕Zhou,Z.Strong expression of EZH2 and accumulation of trimethylated H3K27 in diffuse large B-cell lymphoma independent of cell of origin and EZH2 codon 641 mutation〔DB/OL〕.(2015-03-08)〔2015-05-21〕.http://www.tandfonline.com/doi/full/10.3109/10428194.2015.1006220.
〔8〕Kanduri M,Sander B,Ntoufa S,et al. A key role for EZH2 in epigenetic silencing of HOX genes in mantle cell lymphoma〔J〕.Epigenetics,2013,8(12):1280-1288.
〔9〕Zhang P,Garnett J,Creighton C J,et al. EZH2-miR-30d-KPNB1 pathway regulatesmalignantperipheral nerve sheath tumour cell survival and tumourigenesis〔J〕.J Pathol,2014,232(3):308-318.
〔10〕王晓雪,王光明,丁跃明,等.EZH2 与神经胶质瘤的现况研究〔J〕. 中华临床医师杂志,2013,7(24):11695-11687.
