桑氏链霉菌突变株的抑菌活性及对杨树紫纹羽病的盆栽防效
2015-03-23李姝江朱天辉谯天敏
李姝江,朱天辉,余 琴,谯天敏,韩 珊
(四川农业大学林学院,成都 611130)
随着对环境健康、食品安全的重视,逐步降低化学农药用量是控制植物病害的趋势。由此,开发高效低毒、环境兼容性好的替代化学杀菌剂的新型生物农药是目前国内外植物保护领域研究的热点之一[1-2]。尽管如此,由于生防微生物种群的繁殖易受到环境温度、湿度、土壤pH 等诸多因素的影响,药效反应慢,作用效果大多不明显甚至无效[3-4]。有报道指出[5],生防微生物和化学农药混合使用,不仅可以降低化学农药的使用量,减轻对环境的污染,还因为化学杀菌剂削弱了病原菌的生长,使其对生防菌更加敏感,从而提高了生防微生物的防治效果。因此,生物农药的研究和开发要根据现有的基础和优势有针对性地发展。紫纹羽病又称紫色根腐病,是由紫纹羽丝核菌(RhizoctoniacrocorumFr.)引起的一种苗木病害。该菌寄主范围广泛,达45科,76属,100多种,包括松、柏、杉、刺槐、杨、榆、桑、柳、苹果等,是一种重要的土传病原菌。利用生防微生物防治紫纹羽丝核菌的研究,在国内外还未见报道。
链霉菌属(Streptomyces)是放线菌中分布最广、种类最多的一个属,也是用于植物病虫害生物防治最重要的一个属[6-7]。现已筛选出许多种具有生防价值的链霉菌,例如灰黄链霉菌(S.flavogriseus)、哥斯达黎加链霉菌(S.costaricanus)、灰色链霉菌(S.griseus)、利迪链霉菌(S.lydicus)、波赛链霉菌(S.peucetius)等,这些链霉菌在植物病害的防治中起到了重要作用[8],生防链霉菌的研究主要集中在作物病害生物防治方面,如水稻纹枯病[9]、香蕉黑星病[10]、马铃薯土传病害[11]、烟草细菌性枯萎病[12]等,在林木植物上报道较少。链霉菌所产生的抗生素[13]、酶类[14-16]等一系列次生代谢产物在医疗、农业与食品领域已被广泛开发利用。桑氏链霉菌(S.sampsonii)KJ40是本实验室从杨树根系中分离到的一株对紫纹羽丝核菌有较强抑制作用的放线菌[17],还能够产生几丁质酶。国内外对该菌研究较少,Jain等[18]从花园的土壤中分离得到S.sampsoniiGS1322菌株,发现其对指示真菌白色念珠菌(Candidaalbicans)、黑曲霉(Aspergillusniger)、石膏样小孢子菌(Microsporumgypseum)和毛癣菌属(Trichophytonsp.)均具有抑制作用。由于野生链霉菌对农药抗药性差,农药对具生防作用的菌株也有杀灭效果。福美双是一种广泛应用的植物杀菌剂,对多种疫病、立枯病、猝倒病、根腐病等有较好的防治作用[19]。本研究测定了对福美双具有抗性的2株桑氏链霉菌突变株MV-2、MV-4[20]对8种重要林木真菌的抑制作用,并探索了其发酵液萃取物和菌丝体浸出物的抑菌活性,研究了抑菌物质在不同温度、pH、光照、储藏温度条件下的稳定性及对福美双耐受性,将抑菌物质与福美双用于杨树紫纹羽病的盆栽防治试验,旨在为将其制作成生物农药投放生产提供实践依据。
1 材料与方法
1.1 供试拮抗菌和病原菌
桑氏链霉菌(S.sampsonii)原始菌株KJ40和抗福美双突变株MV-2、MV-4[20],由四川农业大学林学院森林保护省级重点实验室分离、鉴定、诱变和保存。病原菌:红豆杉根腐病病菌(终极腐霉PythiumultimumTrow)、板栗疫病病菌[寄生隐丛赤壳菌Cryphonectriaparasitica(Murr.)Barr.]、松落针病病菌[松针散斑壳菌Lophodermiumpinastri(Schrad.)Chevall.]、杨树紫纹羽病病菌[紫纹羽丝核菌R.crocorum(Pers.)DC.]、杂交竹梢枯病病菌[暗孢节菱孢菌Arthriniumphaeospermum(Corda)M.B.Ellis]、桉树焦枯病病菌(帚梗柱枝孢霉CylindrocladiumscopariumMorgan)、山茶灰斑病病菌[茶褐斑拟盘多毛孢Pestalotiopsisguepinii(Desm.)Stey.]、油橄榄孔雀斑病病菌[橄榄环黑星霉Spilocaeaoleaginea(Cast.)Hughes=CycloconiumoleaginumCast.],由四川农业大学林学院森林保护省级重点实验室提供。
1.2 供试植株
1 年生欧美杂交杨(Populusdeltoides×P.nigra)由四川省崇州市桤泉镇杨树苗圃提供。
1.3 培养基及试剂
牛肉膏蛋白胨(NA)培养基(葡萄糖10g、牛肉膏5g、蛋白胨10g、琼脂粉20g、NaCl 15g、蒸馏水1 000mL,pH 7.0~7.2)用于放线菌的培养;PDA培养基(马铃薯200g、葡萄糖20g、琼脂20g、蒸馏水1 000mL,pH 自然)用于拮抗性测定;发酵培养基(葡萄糖10g、黄豆饼粉10g、蛋白胨3g、NaCl 2.5g、CaCO32g、蒸馏水1 000mL,pH 7.0);所用试剂均为国产AR级试剂。乙酸乙酯、氯仿、正丁醇、甲苯、丙酮、甲醇,购自成都市科龙化工试剂厂;40%福美双可湿性粉剂,购自山东潍坊万盛生物农药有限公司。
1.4 KJ40及其突变株MV-2和MV-4的平板抑菌效果测定
采用平板对峙法[21]:将活化的直径5mm的各病原菌菌碟分别与拮抗菌株KJ40、MV-2、MV-4在PDA平板距中心25mm对称的两点接种。26℃培养5d后,观察记录抑菌情况,测定病原菌的菌落直径,计算抑制率,以只接病原菌为对照,每处理重复3次。菌落直径(mm)=测量菌落直径-5.0;菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.5 KJ40及其突变株MV-2和MV-4的发酵液制备
分别将106cfu/mL的KJ40和MV-2、MV-4的孢子悬浮液按1%(v/v)的接种量接种至盛有200mL发酵培养基的300mL三角瓶中,26 ℃、140r/min 振荡培养3d,发酵液于12 000r/min离心20min,收集上清液和菌丝体于4℃冷藏备用。
1.6 KJ40及其突变株MV-2和MV-4的发酵液萃取物和菌丝体浸出物的抑菌作用
萃取液的制备[22]:取MV-2、MV-4,以及原始菌株KJ40的发酵液,分别用2倍体积的乙酸乙酯、氯仿、正丁醇、甲苯溶液萃取,经RE2000E旋转蒸发器(上海科升仪器有限公司)浓缩至完全干燥,用甲醇定容于25 mL容量瓶中,4℃下冷藏备用。
菌丝体浸出物的制备[22]:取MV-2、MV-4,以及原始菌株KJ40的菌丝体,分别用乙酸乙酯、氯仿、丙酮、甲醇各50mL超声处理15min,常温下浸出48h后过滤,滤液经RE2000E旋转蒸发器浓缩至完全干燥,用甲醇定容于25mL容量瓶中,4℃下冷藏备用。
抑菌作用测定:采用孔洞法[23]。将供试病原菌菌饼(d=5 mm)置于PDA 培养基中央,距菌饼3 cm 处用打孔器(d=5 mm)打孔,每孔加入100μL发酵液萃取物或菌丝体浸出物,每种病原菌做3次重复,以只接病原菌为对照,置于26 ℃下培养,待对照菌落长满平板为止,观察并测量抑菌圈直径。
1.7 KJ40及其突变株MV-2和MV-4抑菌活性物质的稳定性测定
将KJ40、MV-2和MV-4中抑菌作用最强的有机溶剂萃取液和菌丝体浸出物合并,旋转蒸发器浓缩至完全干燥,甲醇溶解,即为含抑菌物质的混合液,以紫纹羽丝核菌为指示菌,测定抑菌活性物质的稳定性。热稳定性:将混合液分别置于40、60、80、100和121 ℃下处理30min,冷却至室温;酸碱稳定性:将混合液分别用0.1mol/L NaOH 和0.1mol/L HCl调至pH 为3、4、5、6、7、8、9、10、11,4℃过夜,然后再将各pH 调回至中性;紫外光稳定性:将混合液置于28 W 紫外灯下,距离10 cm处分别照射2、4、8、12、24h;耐储藏性:将混合液置于2mL封口离心管中,分别在-20、4、20、40、60 ℃的恒温条件下保存30d后,恢复至室温;对福美双的耐受性:将混合液与200μg/mL的福美双按体积比9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9混合;以上各处理均采用1.6中孔洞法测定其抑菌活性,观察并测量抑菌圈直径,每处理设3次重复,以未经处理的混合液为对照。
1.8 KJ40及其突变株MV-2和MV-4对紫纹羽丝核菌的盆栽防效
盆栽试验在四川农业大学林学院苗圃中进行。病原菌孢子悬浮液制备:将紫纹羽丝核菌接种于PDA 平板上,25~28℃培养,产孢后用无菌水配成104cfu/mL的孢子悬浮液备用。将杨树苗扦插于经高温灭菌的土壤里,经14d,杨树苗生根后,分别用(1)MV-2活性物质混合液;(2)MV-4活性物质混合液;(3)KJ40活性物质混合液;(4)200μg/mL的福美双;(5)200μg/mL的福美双+MV-2活性物质混合液(1∶1);(6)200μg/mL的福美双+MV-4活性物质混合液(1∶1);(7)200μg/mL的福美双+KJ40活性物质混合液(1∶1);(8)CK(无菌水)对杨树苗进行灌根[24]处理,每隔7d灌根1次,每次20mL,共3次,1个月后用制备的紫纹羽丝核菌孢子悬液60mL进行灌根,每处理10株,重复3次。接种紫纹羽丝核菌30d后,按下列方法进行病害调查统计,计算发病率、病情指数和防治效果。
病害分级标准[24]:0级,根部健康;1级,侧根腐烂<1/5;2级,1/5≤侧根腐烂<1/3;3级,1/3≤侧根腐烂≤2/3;4级,侧根腐烂>2/3甚至整株死亡。发病率(%)=(发病株数/总接种株数)×100;病情指数=[∑(各病级株数×代表级值)/(总株数×最高病级数)]×100;防治效果(%)=[(对照病情指数-处理病情指数)/对照病情指数]×100。
1.9 数据分析
试验数据采用Excel和SPSS 19.0软件分析处理,LSD 法进行多重比较(P<0.05)。
2 结果与分析
2.1 KJ40及其突变株MV-2和MV-4对病原菌的平板抑制效果
平板对峙法测定结果(表1)显示,KJ40及MV-2、MV-4对鞭毛菌亚门藻状菌纲的终极腐霉(P.ultimum)无抑制作用;对子囊菌亚门子囊菌纲的寄生隐丛赤壳菌(C.parasitica)和松针散斑壳(L.pinastri)抑制率达到70%以上;对半知菌亚门丝孢纲的暗孢节菱孢菌(A.phaeospermum)、帚梗柱枝孢霉(C.scoparium)、茶褐斑拟盘多毛孢(P.guepinii)、橄榄环黑星霉(S.oleaginea)抑制率均超过60%;对担子菌亚门层菌纲的紫纹羽丝核菌(R.crocorum)的抑制作用最强,菌落直径均低于15mm,抑菌率高于90%,显著高于其余供试病原菌。从3种供试拮抗菌抑菌效果上看,MV-2对病原菌抑制作用最强,但在病原菌菌落直径上除寄生隐丛赤壳菌和松针散斑壳外均与MV-4、KJ40差异不显著;从抑菌率上看,MV-2对寄生隐丛赤壳菌、松针散斑壳、暗孢节菱孢菌的抑菌率与MV-4、KJ40差异显著;MV-2对紫纹羽丝核菌的抑菌率与MV-4差异显著,但与KJ40差异不显著。
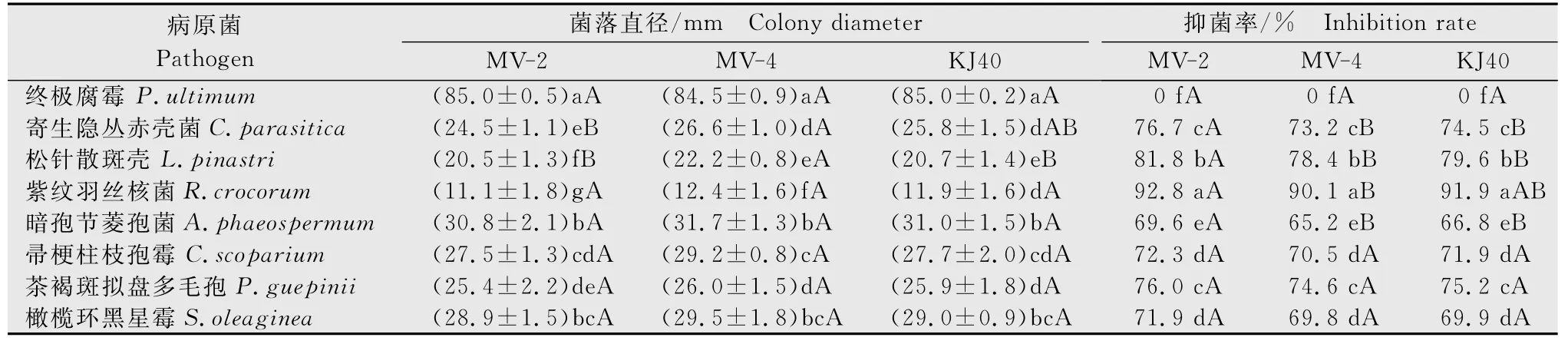
表1 KJ40及其突变株对供试植物病原真菌的抑菌率1)Table 1 Inhibition rate of KJ40and its mutant strains against tested plant pathogens
2.2 KJ40及其突变株发酵液萃取物及菌丝体浸出物的抑菌作用
KJ40、MV-2和MV-4发酵液的不同溶剂萃取物对供试病原菌的抑制作用结果(表2)显示,4 种有机溶剂萃取物对终极腐霉、茶褐斑拟盘多毛孢、橄榄环黑星霉无抑制作用,对其余5 种病原菌有不同程度的抑制作用,说明发酵液萃取物含有某些抗菌物质。在4 种溶剂中,乙酸乙酯萃取物的抑菌效果高于其余3 种,其中对紫纹羽丝核菌产生的抑菌圈直径最大,显著大于其余病原菌,孔洞周围出现明显的透明圈(图1)。在3 种供试拮抗菌株中,MV-2 和MV-4 抑菌效果大部分略好于原始菌株KJ40,但除乙酸乙酯萃取物对紫纹羽丝核菌和帚梗柱枝孢霉的抑制作用与KJ40 差异显著外,其余均不显著。MV-2 抑菌效果略好于MV-4,但差异均不显著。

表2 KJ40及其突变株发酵液萃取物对供试病原菌的抑菌活性1)Table 2 Inhibition activity of fermentation extract from KJ40and its mutant strains against tested plant pathogens

图1 3种拮抗菌发酵液的乙酸乙酯萃取物对紫纹羽丝核菌的抑制作用Fig.1 Inhibition of ethyl acetate extracts from three antifugal strains fermentation on Rhizoctonia crocorum
菌丝体浸出物对供试病原菌的抑制作用结果(表3)显示,4种有机溶剂浸出物对终极腐霉、寄生隐丛赤壳菌、帚梗柱枝孢霉无抑制作用,对其余5种病原菌有不同程度的作用,说明拮抗菌株胞内存在抑菌活性物质;结合表2结果,3种拮抗菌对寄生隐丛赤壳菌、帚梗柱枝孢霉有抑菌活性的物质只存在于发酵液萃取物中,而菌丝体浸出物中存在对茶褐斑拟盘多毛孢、油橄榄环黑星霉有抑菌作用的物质。同样,乙酸乙酯浸出物的抑菌效果显著优于其余3种溶剂,其中对紫纹羽丝核菌产生的抑菌圈直径最大,显著大于其余病原菌(P<0.05)。在3种供试拮抗菌株中,MV-2和MV-4抑菌效果稍好于原始菌株KJ40,但差异不显著。综合以上结果,乙酸乙酯萃取所得到发酵液萃取物和菌丝体浸出物抑菌效果最强。
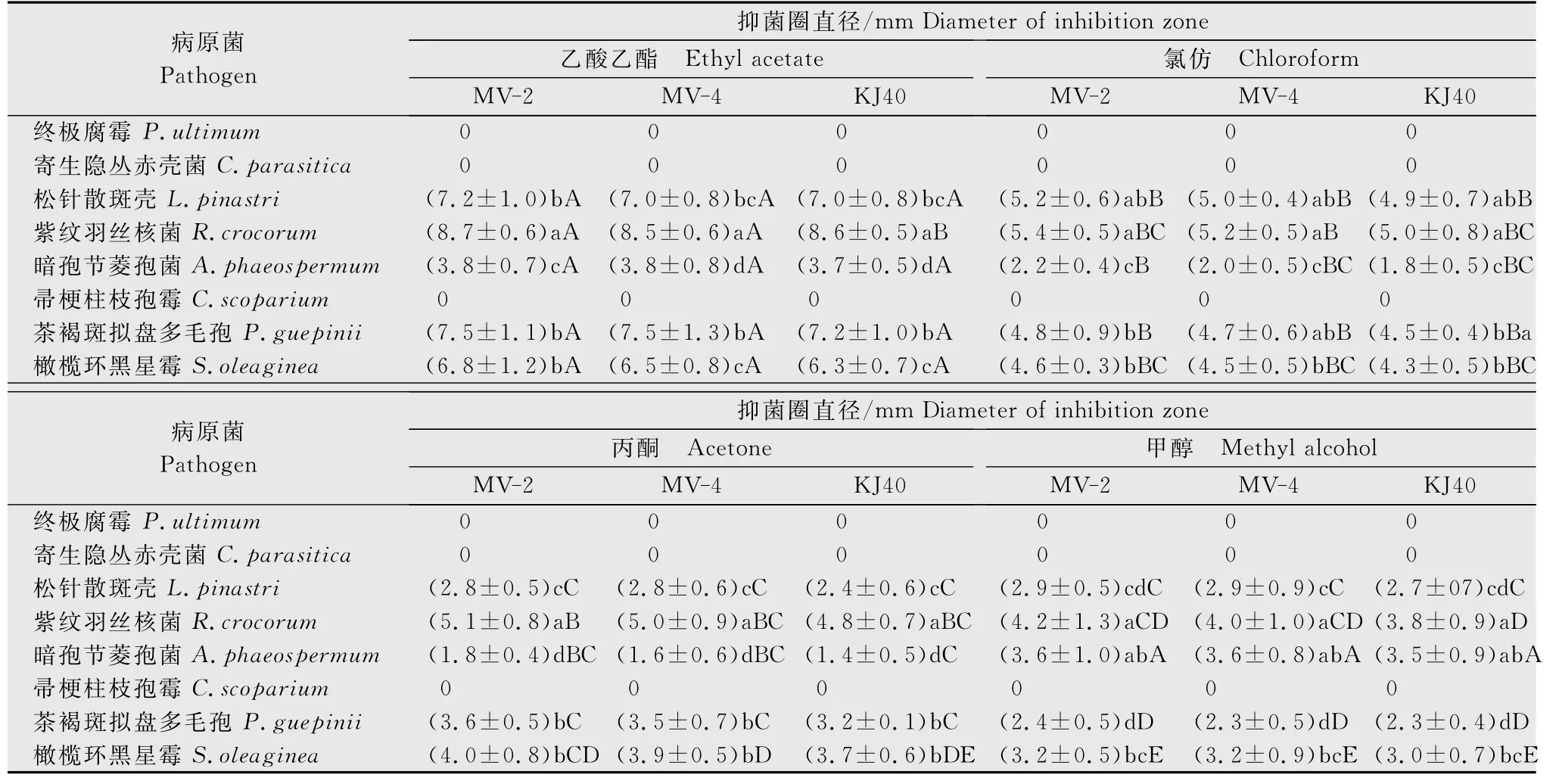
表3 KJ40及其突变株菌丝体浸出物对供试病原菌的抑菌活性1)Table 3 Inhibition activity of mycelium extracts from KJ40and its mutant strains against tested plant pathogens
2.3 KJ40及其突变株MV-2和MV-4抑菌物质的稳定性
MV-2、MV-4和KJ40活性物质经不同温度处理30min后,抑菌活性随温度升高而下降(图2a)。MV-2和MV-4 的抑菌物质经40~80 ℃处理30 min,其抑菌活性下降不显著;100和121 ℃处理后,其抑菌活性虽显著低于对照和前3个温度处理,但抑菌圈直径仍在11 mm 以上;KJ40 中的抑菌物质经不同温度处理后,其抑菌活性降幅显著,121 ℃处理仅有5.5mm 抑菌圈,说明突变株所产生的活性物质比原始菌株的热稳定性更强。
酸碱稳定性结果(图2b)表明,随pH 提高,3个拮抗菌株的抑菌活性增强,当pH 为7时,抑菌活性达到最大,抑菌圈与对照差异不显著;但随pH 继续增大,活性显著下降。对比突变株和原始菌株,可以看出不管pH 高低,MV-2、MV-4的活性物质对病原菌产生的抑菌圈仍较大,均大于10mm,说明突变株对酸碱的耐受性较强。
在紫外光下经不同时间照射后(图2c),随时间延长,KJ40及其突变株抑菌物质活性均降低。处理2h,MV-2和MV-4的抑菌活性与未经照射的处理差异不显著,并且其降幅低于KJ40;处理24h,KJ40活性物质的抑菌圈很小,说明其不耐紫外光照射,而MV-2和MV-4对紫外光有一定的耐受性。
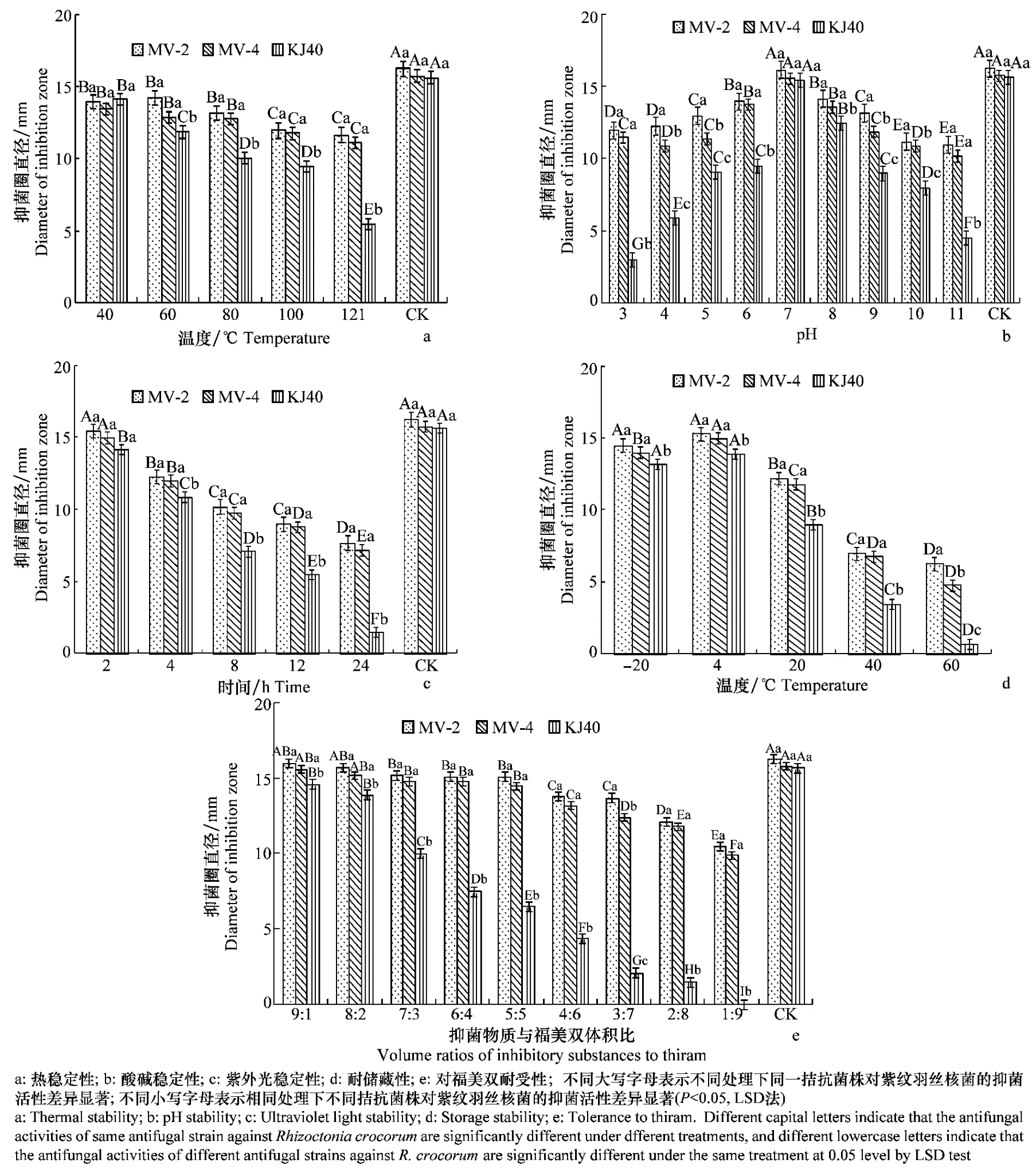
图2 KJ40及其突变株抑菌物质的稳定性Fig.2 Stability of antifungal substance from KJ40and its mutant strains
KJ40 及其突变株在不同温度中储藏30d 后(图2d),各处理的抑菌活性存在差异,-20 ℃和4℃储藏后3个菌株活性物质的抑菌活性变化不大,特别是2株突变株,其抑菌圈直径均大于14 mm。但20 ℃储藏后3个菌株的抑菌活性均有一定程度的降低,KJ40降幅最大;40和60 ℃储藏后,抑菌物质活性与-20 ℃和4 ℃比均显著下降。可见活性物质在4 ℃以下低温储藏更好。
在按不同比例与福美双混合后(图2e),从9∶1到5∶5之间,两株突变株抑菌物质活性差异不显著;当福美双含量继续增大,其活性降低。而KJ40抑菌物质加入福美双后其活性呈显著下降趋势,当与福美双的体积比达到1∶9时,其活性丧失,可见未经诱变的菌株对福美双耐受性较差。
综合来看,MV-2抑菌物质的稳定性强于MV-4,两者的活性物质比KJ40的活性物质更稳定。
2.4 KJ40及其突变株MV-2和MV-4对杨树紫纹羽病的盆栽防效
KJ40、MV-2、MV-4单独施用及与福美双混合施用后,杨树紫纹羽病的发病率、病情指数和防治效果见表4。结果显示,单独接种抑菌物质,MV-2和MV-4的防效显著优于KJ40;MV-2的防效略高于MV-4,但差异不显著。与单独施用福美双相比,MV-4的防效显著低于福美双,MV-2的防效虽亦低于福美双,但差异不显著。抑菌物质和福美双混合施用均比单独施用效果更好,其中MV-2和福美双混合施用杨树发病率显著降低,病情指数在10以下,防效最佳,超过80%。KJ40的抑菌物质无论单独施用还是和福美双混合施用,效果都不如MV-2和MV-4。以上结果说明,MV-2和MV-4产生的抑菌物质和福美双混用对杨树紫纹羽病有协同防治作用,且比KJ40更适宜在生产实践中用于病害的防治。
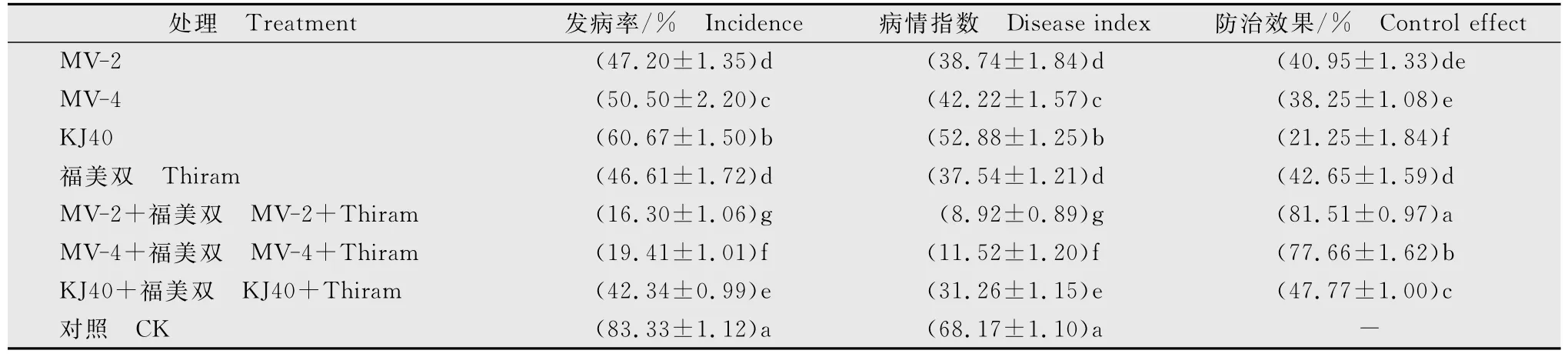
表4 KJ40及其突变株和福美双对杨树紫纹羽病的盆栽防效1)Table 4 Control effects of KJ40and its mutants and thiram on poplar purple root disease in potted experiments
3 讨论
由于传统农药以及新型生物农药的局限性,研究者更期望将具有抗药性的生物农药与化学农药相结合用于植物病害的防治,最大限度地发掘其生防潜力。本文以前期筛选到的具有抗药性、拮抗性稳定持久的桑氏链霉菌KJ40 突变株MV-2、MV-4[20]为基础,研究其抑菌谱。平板对峙试验结果显示,2个突变株除对鞭毛菌亚门藻状菌纲的终极腐霉无抑制作用外,对其余7株分属于子囊菌亚门、半知菌亚门和担子菌亚门的林木病原真菌抑制作用较强。通过4种有机溶剂对KJ40及其突变株发酵液和菌丝体进行萃取,得到的发酵液萃取物和菌丝体浸出物活性物质抑菌谱较广,但仍对终极腐霉无作用,其中乙酸乙酯萃取的物质活性最强。汪鹰[25]报道灰藤黄链霉菌(Streptomycesgriseoluteus)产生的多种吩嗪类活性代谢产物对终极腐霉有强烈抑制作用,与本试验结果不同,但链霉菌所产生的代谢产物多种多样,进一步的研究将集中在KJ40发酵产物中活性物质的分离纯化及结构鉴定,并对抑菌机理进行探索。结果中突变株和原始菌株及其活性物质均对杨树紫纹羽病病原菌紫纹羽丝核菌抑制作用最强,这可能与桑氏链霉菌本身就来自杨树根系有关。突变株MV-2及其活性物质抑菌作用最强,可能与诱变前后菌株产生的抑菌物质种类有所不同使得抑菌效果不同有关。本文只选择几种代表性林木病原真菌,为将桑氏链霉菌发展成为广谱性生防菌,下一步试验应扩大测试病原菌范围。
在稳定性检测中,MV-2 和MV-4 产生的抑菌物质具有较好的热稳定性、较宽的pH 作用范围,抗紫外线辐射能力也较强,而原始菌株各种稳定性均较差,因此,突变株的特性使其在生产实践中比原始菌株更能适应环境,具有更大的开发潜力。但在高温中储藏后抑菌物质的活性显著下降,结合隋勤等[2]的报道,可合理选择相应的稳定剂等助剂,对将实际投入应用的生防制剂剂型进行深加工,以增加其货架期和田间防治效果。另外,MV-2、MV-4和KJ40对福美双的耐受性也表明,突变株抑菌混合物在与福美双不同配比下其活性仍较强,而原始菌株抑菌活性则显著降低甚至丧失。
虽然笔者曾将桑氏链霉菌发酵液直接用于杨树紫纹羽病的防治[17],但由于链霉菌在自然条件下定殖及繁殖能力还不够稳定[26],如果直接和农药混用,将限制生防菌的存活率和向侵染部位的转运效率[27]。本试验尝试将桑氏链霉菌突变株产生的抑菌物质用于病害的防治,获得了很大突破,作用方式更直接,生物活性成分更高,这与张晓云[28]将枯草芽胞杆菌抗菌蛋白应用于黄瓜白粉病中的结果一致。盆栽试验还表明,福美双+MV-2活性物质混合施用防效最好,显著高于两者单独施用,MV-2、MV-4的抑菌物质对病原菌的抑制作用较KJ40有所提高;能让紫纹羽丝核菌无法扩展生长,达到杀灭紫纹羽丝核菌的效果。这一结果有效降低放线菌抗菌物质对化学药剂的敏感性,增加其生防潜能,使生防菌剂与杀菌剂协同效应在综合防治体系中的应用成为可能。但本试验中用的是无菌土,田间试验的环境比盆栽试验更为复杂,生防菌会受到温度、湿度、土壤pH 等的影响,田间试验的结果可能会与盆栽试验不一致[29]。MV-2、MV-4及其活性物质能否在田间土壤中定殖、在田间试验中是否具有防治作用还需进一步探究。
[1]Jarvis P著,关爱莹,刘长令编译.生物农药的现状与发展趋势[J].农药科学与管理,2002,33(3):29-30.
[2]隋勤,刘伟成,裘季燕,等.利迪链霉菌A02的抑菌谱及其抑菌活性的稳定性[J].植物保护,2007,33(5):67-71.
[3]付小军,盛鑫,马进,等.植物病害生物防治概述[J].陕西农业科学,2011(4):138-139.
[4]胡燕梅,杨龙.利用微生物防治植物病害的研究进展[J].中国生物防治,2006,22(S1):190-193.
[5]田连生,冯树波.耐药性木霉菌株的筛选及其对灰霉病的防治[J].生物技术,2005,15(5):26-28.
[6]周鑫钰,朱宏建,雷湘华,等.植物内生放线菌应用研究进展[J].江西农业学报,2010,22(12):87-90.
[7]El-Tarabily K A,Soliman M H,Nassar A H,et al.Biological control ofSclerotiniaminor using a chitinolytic bacterium and actinomycetes[J].Plant Pathology,2000,49(5):573-583.
[8]薛磊,王建涛,刘相春,等.拮抗性链霉菌对大丽轮枝菌微菌核形成与萌发的影响[J].植物保护学报,2012,39(4):289-296.
[9]曹琦琦,周登博,郑丽,等.水稻纹枯病菌拮抗菌的筛选、鉴定及培养条件探索[J].中国生物防治学报,2013,29(2):270-276.
[10]廖东奇,曾涛,马婷,等.放线菌WZ1-5019的鉴定及其发酵液对香蕉黑星病的田间防治效果试验[J].热带作物学报,2011,32(5):932-936.
[11]陈杰,汤琳,郭天文,等.马铃薯土传病原真菌拮抗放线菌的抗病促生作用[J].西北农林科技大学学报(自然科学版),2014,42(1):111-119.
[12]Han Xinyu,Zhang Chengsheng,Chen Xue,et al.Screening,identification and biocontrol effect of antagonisticStreptomycesstrain Tra69against tobacco bacterial wilt[J].Plant Diseases and Pests,2012,3(1):10-13,32.
[13]陈祈磊,赵子翰,王辂,等.黄灰链霉菌SIIA-A02191产生的多环口山酮类新抗生素Bromoxantholipin[J].中国抗生素杂志,2011,36(8):566-570.
[14]Bentley S D,Chater K F,Cerdeño-Tárraga A M,et al.Complete genome sequence of the model actinomyceteStreptomyces coelicolorA3(2)[J].Nature,2002,417(6885):141-147.
[15]Kuhad R C,Kapoor M,Rustagi R.Enhanced production of an alkaline pectinase fromStreptomycessp.RCK-SC by wholecell immobilization and solid-state cultivation[J].World Journal of Microbiology and Biotechnology,2004,20(3):257-263.
[16]Chakraborty S,Khopade A,Kokare C,et al.Isolation and characterization of novelα-amylase from marineStreptomycessp.D1[J].Journal of Molecular Catalysis B:Enzymatic,2009,58(1-4):17-23.
[17]李姝江,朱天辉,彭艳,等.桑氏链霉菌产几丁质酶特性及对杨树紫纹病的生防作用[J].东北林业大学学报,2014,42(3):116-121.
[18]Jain P K,Jain P C.Isolation,characterization and antifungal activity ofStreptomycessampsoniiGS 1322[J].Indian Journal of Experimental Biology,2007,45(2):203-206.
[19]杨春林,席亚东,谢华蓉,等.耐福美双的哈茨木霉菌株诱导及其几丁质酶生防特性研究[J].云南农业大学学报,2010,25(2):183-188.
[20]余琴,朱天辉,李姝江,等.耐福美双桑氏链霉菌生物型的选育[J].东北林业大学学报,2014,42(7):73-77.
[21]贾翠英,张玉辉,吴志洋.紫外诱变与羧甲基半胱氨酸复合筛选高产L-精氨酸菌株[J].核农学报,2012,26(6):879-883.
[22]贺建武,刘祝祥,龙华,等.波赛链霉菌JMC 06001抑菌活性物质的特性研究[J].微生物学杂志,2011,31(1):10-14.
[23]李姝江,梁漫,朱天辉,等.杂交竹梢枯病拮抗菌的筛选及抗菌蛋白分析[J].南京林业大学学报(自然科学版),2013,37(6):27-32.
[24]赵桂华,王海明,牛迎福,等.杨树紫纹羽病发生与防治[J].西部林业科学,2010,39(1):86-89.
[25]汪鹰.链霉菌P510 中吩嗪类抗生物质的分离纯化[D].上海:上海交通大学,2010.
[26]王家琛,蒋继志.放线菌MC-15发酵产物的稳定性及对马铃薯晚疫病的防治[J].中国农学通报,2010,26(19):253-257.
[27]Fernando W G D,Nakkeeran S,Zhang Y,et al.Biological control ofSclerotiniasclerotiorum(Lib.)de Bary byPseudomonasandBacillusspecies on canola petals[J].Crop Protection,2007,26(1):100-107.
[28]张晓云.枯草芽孢杆菌菌株CAB-1抑菌物质的分离鉴定及活性分析[D].保定:河北农业大学,2011.
[29]林珊.十字花科根肿病菌Plasmodiophorabrassicae生防菌的筛选及其诱变选育[D].雅安:四川农业大学,2012.
