不同药用植物提取液对大豆孢囊线虫的控制作用
2015-03-23周佳民黄文坤崔江宽苏致衡彭德良
周佳民,黄文坤,崔江宽,苏致衡,彭德良*
(1.湖南省农业科学院农业生物资源利用研究所,长沙 410125;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
大豆孢囊线虫病是大豆生产上的一种毁灭性病害,其病原为土传的大豆孢囊线虫(HeteroderaglycinesIchinohe)[1-3]。目前生产上主要是种植抗性品种、与非寄主作物轮作以及应用化学农药进行防治。这些措施虽具有一定的防治效果,但因品种单一使大豆的抗性丧失及环境污染等问题受到了很大的限制。因此,充分调查和挖掘出更多、更有效的新杀线虫植物将成为未来发展的方向[4]。
目前,国内外已报道的对植物寄生线虫有活性的植物有40多科近100种[5],但自然界植物资源极为丰富,许多具有杀线虫作用的植物还未被发现,本试验通过测定8种药用植物甲醇和无菌水提取液对大豆孢囊线虫抑杀效果,初步筛选出对大豆孢囊线虫抑杀具有生物活性的植物,旨在为寻找新型植物源杀线虫活性物质提供参考。
1 材料与方法
1.1 材料
1.1.1 供试植物及溶剂
供试的8种药用植物经湖南省农业科学院朱校奇研究员鉴定(表1),所用提取溶剂分别为甲醇及无菌水。
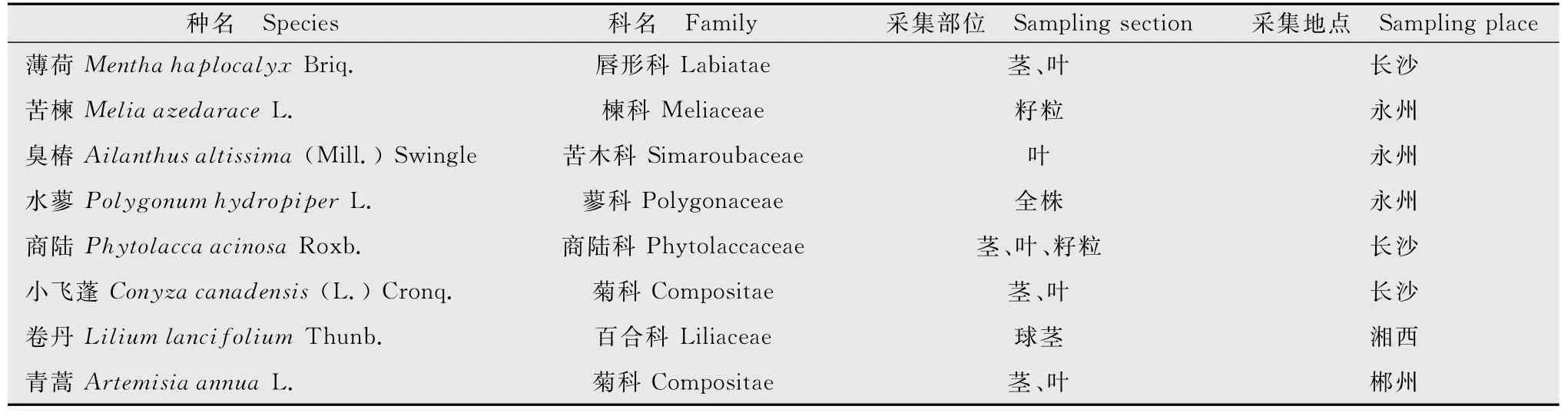
表1 供试植物名录Table 1 The list of tested plants
1.1.2 供试线虫
大豆孢囊线虫从中国农业科学院河北廊坊基地大豆种植地的土壤中分离。用漂浮法分离后在解剖镜下挑取新鲜、饱满的孢囊,用0.5%的次氯酸钠处理3 min,再用无菌水冲洗3 次,置于0.5 mmol/L ZnSO4溶液中,在25 ℃恒温条件下进行孵化,得到2 龄幼虫(J2),收集并置于4 ℃冰箱中保存备用[6-7]。
1.2 方法
1.2.1 植物活性成分提取
参照李大婧的超声波提取法[8]分别采用甲醇和无菌水从植物中提取活性成分。将采集的植物用纯净水洗净、晾干水分,放入105 ℃电热鼓风箱内杀青30min,然后在50℃下烘干,粉碎机粉碎并过40目筛网,得到植物干粉为待测样品。称取样品10.0 g于三角瓶中,分别以甲醇和无菌水为提取溶剂,加入100mL提取溶剂,室温下超声波提取30min,浸泡提取48h后,用滤纸过滤提取液,吸取提取液5 mL并用无菌水定容至100mL为室内待测液。
1.2.2 毒杀活性测定
将收集到的2龄幼虫加入无菌水,配制成浓度约为500条/mL 的线虫悬浮液,吸取1 mL 线虫悬浮液注入24孔细胞培养板的1个样品孔内,再加入待测提取液1 mL,以相应的提取液为对照,重复4次。处理48h,滴加1mol/L 的氢氧化钠溶液检查各处理的线虫死亡情况,线虫死亡计数标准参考以下的方法,即线虫呈僵直不动为死虫,线虫呈弯曲蠕动状态为活虫[9]。杀线虫强弱分级按Chandravadana等的方法进行[10-11]。具体分级标准为:“-”表示无活性,校正死亡率≤10.0%;“+”表示弱活性,校正死亡率为10.1%~30.0%,“++”表示中等活性,校正死亡率为30.1%~50.0%;“+++”表示较强活性,校正死亡率为50.1%~80%;“++++”表示强活性,校正死亡率>80.0%。
1.2.3 盆栽试验
室内盆栽以每种药用植物的每种提取液为1个处理,每处理4次重复。试验土壤取自中国农业科学院植物保护研究所河北廊坊基地大豆孢囊线虫发病严重的田块,装入盆口直径27cm,高30cm 的塑料盆内,混匀后称取土样200g,重复4次,采用漂浮法收集孢囊,在体视解剖镜下记录处理前孢囊的数量;5月10日,每盆播种10粒,大豆品种为市售‘中黄13’,出苗后定苗5株,在20~35℃条件下培养吸取20mL 各处理的提取液,稀释到400mL,分别在播种前、苗期以灌根方式施药2次。分别以甲醇稀释液400mL和纯净水400mL为对照。
1.2.4 取样及调查方法
大豆出苗60d后,测定大豆植株的株高,调查各种提取液对大豆生长的影响。在大豆开花期,采集大豆植株全部根系及根系周围的土壤,混匀后称取土样200g,采用漂浮法收集孢囊,在体视解剖镜下记录孢囊的数量,重复4次,统计分析各处理对大豆孢囊线虫病的防治效果[12]。
1.3 数据统计与分析
所测数据用DPS软件和Excel软件进行分析和处理,计算公式如下[12-14]:
死亡率(%)=(死亡线虫数/供试线虫数)×100;
校正死亡率(%)=[(处理组线虫死亡率-对照组线虫死亡率)/(1-对照组线虫死亡率)]×100;
孢囊减退率(%)=(施药前孢囊数-施药后孢囊数)/施药前孢囊数×100;
防治效果(%)=[(防治区孢囊减退率-对照区孢囊减退率)/(100-对照区孢囊减退率)]×100。
2 结果与分析
2.1 不同植物提取液对大豆孢囊线虫活性评价
从表2可见,药用植物青蒿甲醇和无菌水提取液对大豆孢囊线虫毒杀能力最强,处理48h线虫的校正死亡率分别为94.23%和82.15%,薄荷、苦楝、臭椿、水蓼、商陆、小飞蓬等药用植物提取液的毒杀活性次之,其甲醇提取液处理48h后,线虫的校正死亡率分别为76.94%、76.80%、75.00%、76.69%、86.93%、46.15%;无菌水提取液处理48h后,线虫的校正死亡率分别为63.58%、69.05%、76.23%、63.62%、55.05%、21.16%;卷丹甲醇提取液表现中等的杀虫能力,处理48h 线虫的校正死亡率为47.89%,药用植物小飞蓬无菌水提取液表现出较弱的杀虫能力,处理48h校正死亡率为21.16%,卷丹无菌水提取液对大豆孢囊线虫抑杀效果不理想,不表现活性或活性较弱,处理48h 的校正死亡率为2.51%;与卷丹和小飞蓬相比,青蒿、薄荷、苦楝、臭椿、水蓼、商陆等处理对大豆孢囊线虫抑杀效果均存在显著差异。

表2 植物提取液对大豆孢囊线虫2龄幼虫活性1)Table 2 Toxicity of plant extracts to Heterodera glycines J2
2.2 不同植物提取液对大豆孢囊线虫的盆栽防效
通过盆栽试验发现,植物提取液各处理的土壤中孢囊数量比对照明显减少,植物提取液各处理对大豆孢囊线虫的防治效果,与对照均存在显著差异;其中,水蓼甲醇提取液与无菌水提取液处理对大豆孢囊线虫的防治效果均最好,分别为72.37%和57.10%(表3),与除臭椿外其他处理存在显著差异;另外,同一植物提取液处理中,甲醇提取液处理的防治效果比无菌水提取液的有增高的趋势,尤其是水蓼和臭椿甲醇提取液对线虫防治效果都达到65.79%以上,与其他处理存在显著差异,具有较好的生防潜力。从表3还可以看出,各处理株高比对照有增高的趋势但没有显著差异。

表3 植物提取液对大豆孢囊线虫的防病效果Table 3 Control efficacy of plants extracts against Heterodera glycines
3 结论与讨论
大豆孢囊线虫病是一种土传病害,减少孢囊在土壤中的积累,抑制孢囊线虫卵孵化,是防治大豆孢囊线虫病的有效途径。我国具有丰富的药用植物资源,从植物中分离、提纯杀线虫化合物,开发高效、环保型的植物源杀线虫剂防治大豆孢囊线虫,有很好的现实和生态意义。本试验测定了8种药用植物甲醇和无菌水提取液的杀线虫活性,结果表明薄荷、苦楝、臭椿、水蓼、商陆等药用植物甲醇和无菌水提取液对大豆孢囊线虫表现出较强的毒杀活性,尤其是药用植物青蒿的甲醇和无菌水提取液对大豆孢囊线虫均表现出极强的毒杀活性。前人测定了苦楝提取物对南方根结线虫的毒杀活性,结果表明,苦楝的乙醇提取物有较强的杀线活性[15-16],Adegbite 等[17]的研究认为,楝树的提取物具有很好的杀线活性,是一种廉价和有效的杀线虫剂原料,但翁群芳等[18]的研究认为,苦楝、青蒿的提取液对南方根结线虫的毒杀活性较弱。本研究通过盆栽试验发现,水蓼、臭椿甲醇提取液对大豆孢囊线虫病防治效果好,具有较好的生防潜力,丰富了前人的研究结果。本试验还表明,各植物提取液处理株高比对照有增高的趋势但差异不显著,说明植物提取液对大豆的生长发育没有不利影响,为水蓼、臭椿等植物源农药的开发利用提供了理论依据。
在本试验研究中,薄荷、苦楝、水蓼、商陆、小飞蓬、青蒿、卷丹等药用植物甲醇提取液对大豆孢囊线虫的毒杀活性均优于无菌水提取液,这可能是因为这些药用植物中的某种功能性成分易溶于有机溶剂[19-21];本试验对部分药用植物提取物的杀线虫活性进行了研究,但起作用的杀线虫活性物质的成分及其作用机理以及对土壤微生物的影响还有待进一步研究。
[1]段玉玺,吴刚.植物线虫病害防治[M].北京:中国农业科学技术出版社,2002:122-130.
[2]孔祥超,李红梅,耿甜,等.大豆种质资源对大豆孢囊线虫3号和4号生理小种的抗性鉴定[J].植物保护,2012,38(1):146-150.
[3]Zheng J W,Li Y H,Chen S Y.Characterization of the viru-lence phenotypes ofHeteroderaglycinesin Minnesota[J].Journal of Nematology,2006,38(3):383-390.
[4]Wiratno,Taniwiryono D,van den Berg H,et al.Nematicidal activity of plant extracts against the root-knot nematodeMeloidogyneincognita[J].The Open Natural Products Journal,2009,2:77-85.
[5]翁群芳,钟国华,王文祥,等.植物提取物对南方根结线虫的控制作用[J].华南农业大学学报,2006,27(1):55-60.
[6]陈井生,李肖白,李泽宇,等.不同抑制性土壤真菌菌株对大豆胞囊线虫的抑制作用[J].河南农业科学,2011,40(7):90-92.
[7]林茂松,张治宇.尖镰孢菌非致病菌株对南方根结线虫数量的控制[J].南京农业大学学报,2001,24(1):40-42.
[8]李大婧,刘春泉,王振宇.超声波法提取万寿菊花中叶黄素的工艺条件优化[J].江苏农业学报,2005,21(4):374-377.
[9]高雯芳,朱阁,刘强.沙冬青和骆驼蓬水煮提取物对松材线虫的毒杀作用[J].天津师范大学学报(自然科学版),2009,29(3):55-57.
[10]吴慧平,徐晓莉,王军.茶籽醇提物对松材线虫及根结线虫室内活性测定分析[J].植物检疫,2007,21(6):335-337.
[11]Chandravadana M V,Sebastian E,Nidiry J,et al.Nematicidal activity of some plant extracts[J].Indian Journal of Nematology,1996,26(2):148-151.
[12]郝瑞,黄文坤,刘崇俊,等.新型种衣剂防治小麦禾谷孢囊线虫病研究[J].植物保护,2014,40(1):182-186.
[13]李俊喜,李辉,王维华,等.丛枝菌根真菌丛枝发育对大豆胞囊线虫病的影响[J].青岛农业大学学报(自然科学版),2010,27(2):95-99.
[14]裴世安,王暄,耿立新,等.不同杀线剂对小麦孢囊线虫病的防治效果[J].植物保护,2012,38(1):166-170.
[15]孙世伟,刘爱勤,苟亚峰,等.20种植物提取物对南方根结线虫的毒杀活性[J].热带农业科学,2009,29(10):30-33.
[16]柯云,潘沧桑.几种植物提取液对根结线虫的抑杀作用[J].厦门大学学报(自然科学版),2007,46(5):711-714.
[17]Adegbite A A,Adesiyan S O.Root extracts of plants to control root-knot nematode on edible soybean[J].Journal of Vegetable Science,2006,12(2):5-12.
[18]翁群芳,钟国华,王文祥,等.植物提取物对南方根结线虫的控制作用[J].华南农业大学学报,2006,27(1):55-60.
[19]周银丽,白建波,尹体刘,等.一枝蒿等6种植物提取液对水稻潜根线虫的抑杀作用[J].安徽农业科学,2010,38(25):13795-13796.
[20]苏秀荣,谢宁,张纪龙,等.银胶菊叶和花提取物对南方根结线虫的毒杀活性比较[J].植物资源与环境学报,2012,21(1):77-82.
[21]闫磊,肖婷,牛洪涛,等.15种植物源化合物对马铃薯茎线虫的活性比较[J].植物保护,2008,34(1):85-89.
