Pd(Ⅱ)与牛血清白蛋白相互作用的荧光光谱研究
2015-03-23叶满萍
郑 枭,叶满萍,李 裔
(中国计量学院 光学与电子科技学院,浙江 杭州 310018)
Pd(Ⅱ)与牛血清白蛋白相互作用的荧光光谱研究
郑 枭,叶满萍,李 裔
(中国计量学院 光学与电子科技学院,浙江 杭州 310018)
采用荧光光谱法研究了Pd(Ⅱ)与牛血清白蛋白(BSA)的相互作用.使用高斯多峰拟合法对Pd(Ⅱ)-BSA体系荧光光谱的各荧光成分进行了解析.结果表明,BSA的荧光主要来源于色氨酸(Trp)残基,并推测Pd(Ⅱ)与BSA结合作用的位置在第212位Trp残基上.研究了Pd(Ⅱ)与BSA相互作用的荧光猝灭光谱,通过紫外吸收光谱的变化和猝灭速率常数Kq的比较对Pd(Ⅱ)与BSA相互作用的荧光猝灭机理进行了判别.结果表明,Pd(Ⅱ)对BSA的荧光猝灭属于静态猝灭.
荧光光谱;荧光猝灭;牛血清白蛋白BSA;钯离子Pd(Ⅱ)
金属钯(Pd)离子进入生物体可能与蛋白质反应,影响正常的生理活动;同时钯的一些配合物具有高抗癌特性可用于治疗癌症等疾病[1-2].血清白蛋白(BSA)是人和动物体的血液中含量最丰富的蛋白质[3-5].
本文研究了Pd(Ⅱ)与BSA的相互作用的荧光光谱.使用高斯多峰拟合法[6]解析了Pd(Ⅱ)-BSA体系的荧光光谱各荧光成分;并对Pd(Ⅱ)-BSA荧光猝灭机理进行了探讨.
1 实验部分
1.1 仪器与试剂
F-2700荧光分光光度计,Lamda-1050紫外可见吸收光谱仪.
Pd(Ⅱ)溶液:准确称取0.044 3 g氯化钯(PdCl2)粉末溶解于蒸馏水中,定容至50 mL,配制成浓度为5×10-3mol/L的储备液.
BSA溶液:准确称取0.330 3 g牛血清白蛋白标准品溶解于蒸馏水中,定容至100 mL,配制成浓度为1×10-4mol/L的储备液.
Bitton-Robinson(B-R)缓冲溶液的配制:利用浓度均为0.04 mol/L的H3PO4、H3BO3和HAc溶液与0.2 mol/L NaOH溶液,按一定比例配制成不同pH值的缓冲溶液,并用酸度计校正pH值.
所用试剂均为分析纯,水为二次蒸馏水.
1.2 实验方法
1)紫外可见吸收光谱的测定
在5 mL的刻度试管中,依次加入适量的B-R缓冲溶液、BSA溶液和一定体积的Pd(Ⅱ)溶液,加水定容至刻度,摇匀,并避光静置一段时间,在室温下测量其紫外可见吸收光谱.
2)荧光光谱的测定
在5 mL的刻度试管中,依次加入适量的B-R缓冲溶液、BSA溶液和一定体积的Pd(Ⅱ)溶液,水定容至刻度,摇匀,避光静置一段时间后用荧光分光光度计测量荧光光谱.
2 实验结果与分析
2.1 Pd(Ⅱ)与牛血清白蛋白相互作用的紫外可见吸收光谱
按照实验方法(1),以水做参比,测得BSA溶液的吸收光谱如图1(a)中曲线.
BSA溶液有两个明显的吸收谱峰:278 nm和218 nm,其摩尔吸光系数ε分别为:2.64×104L·mol-1cm-1和3.57×105L·mol-1cm-1.
将BSA溶液与Pd(Ⅱ)溶液按照体积比1∶1混合,以水做参比,测得的吸收光谱如图1(b)中的曲线.加入BSA后,其摩尔吸光系数ε分别为:3.01×104L·mol-1cm-1和3.61×105L·mol-1cm-1.此外,BSA最大吸收波长也发生了变化:278 nm蓝移到276 nm,218 nm红移到220 nm.BSA与Pd(Ⅱ)反应后,吸收光谱特征和吸光度的变化为下文研究Pd(Ⅱ)-BSA体系荧光猝灭机制提供了依据.
2.2 Pd(Ⅱ)与牛血清白蛋白相互作用的荧光光谱
根据实验方法(2)测量Pd(Ⅱ)-BSA体系的荧光光谱,结果如图2.

图2 不同波长激发下BSA及Pd(Ⅱ)-BSA体系的荧光光谱图Figure 2 Fluorescence spectra of BSA and Pd(Ⅱ)-BSA system at different wavelength excitation
图2(a)、(b)分别是选用277 nm、228 nm激发BSA溶液得到的荧光光谱.从图2(a)、(b)可知,加入Pd(Ⅱ)后,两种波长激发下BSA荧光强度均变小,且BSA的荧光展宽均在280~400 nm范围内,光谱走向属于不规则的曲线,并伴随着重叠峰和肩峰.由此推断BSA的荧光光谱是多种荧光基团共同作用的结果.为此,我们采用高斯多峰拟合法来分辨牛血清白蛋白的荧光光谱肩峰与重叠的荧光峰[7].
2.2.1 Pd(Ⅱ)与牛血清白蛋白相互作用的二阶导数荧光光谱
在228 nm激发下对BSA与Pd(Ⅱ)-BSA体系的荧光光谱求二阶导数,BSA与Pd(Ⅱ)-BSA体系的二阶导数光谱分别如图3(a)、(b),其中实线为二阶导数光谱,虚线为归一化的荧光光谱.

图3 在228 nm激发下BSA与Pd(Ⅱ)-BSA体系的二阶导数光谱和荧光光谱Figure 3 Second derivative spectrometry and fluorescence spectra of BSA and Pd(Ⅱ)-BSA system at 228 nm excitation
由图3可知,在228 nm激发下,BSA二阶导数极小值分别为306.5 nm、322.5 nm和337.5 nm,加入Pd(Ⅱ)后,Pd(Ⅱ)-BSA体系的二阶导数极小值分别为304 nm、321 nm和337.5 nm.由此可见,加入Pd(Ⅱ)前后二阶导数荧光光谱的极小值位置相差不大,即原始荧光光谱的峰值位置基本相同.
BSA能够产生荧光的基团只有色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基[8],Trp、Tyr和Phe荧光激发与发射峰分别位于λex/λem=283 nm/346 nm,λex/λem=277 nm/304 nm和λex/λem=261 nm/284 nm.由此可以确定305 nm附近处的小肩峰来自于Tyr残基,325 nm和335 nm附近相互重叠的强峰来自于Trp残基.因此,Pd(Ⅱ)-BSA体系二阶导数图中峰值位置及归属可用表1表示.
2.2.2 Pd(Ⅱ)与牛血清白蛋白相互作用的高斯多峰拟合
根据二阶导数极小值的位置在228 nm激发下分别对BSA和Pd(Ⅱ)-BSA体系280~400 nm区间内的原始荧光光谱进行高斯曲线拟合,拟合结果如图4所示,图中实线代表原始光谱,星号虚线代表高斯拟合后的曲线,虚线代表各组成峰.
表1 二阶导数图中峰值位置及归属表
Table 1 Second derivative peak position and attribution table diagram

峰值峰值位置/nm归属1305酪氨酸2325色氨酸3335色氨酸

图4 在228 nm激发下BSA与Pd(Ⅱ)-BSA体系的高斯拟合结果Figure 4 Gaussian fitting results of BSA and Pd(Ⅱ)-BSA system at different wavelength excitation
由图4中可以看出,BSA和Pd(Ⅱ)-BSA体系的高斯曲线拟合的结果与原始荧光光谱的吻合度都比较高,说明拟合结果理想.在228 nm激发下BSA及Pd(Ⅱ)-BSA体系的高斯多峰拟合参数表分别见表2、3.
表2 BSA体系的高斯多峰拟合参数表
Table 2 Multi-peak gaussian fitting parameter table of BSA system

峰值面积峰值位置宽度高度1552.9300.611.538.526011.9328.226.9178.038047.2346.139.8161.4
表3 Pd(Ⅱ)-BSA体系的高斯多峰拟合参数表
Table 3 Multi-peak gaussian fitting parameter table of Pd(Ⅱ)-BSA system
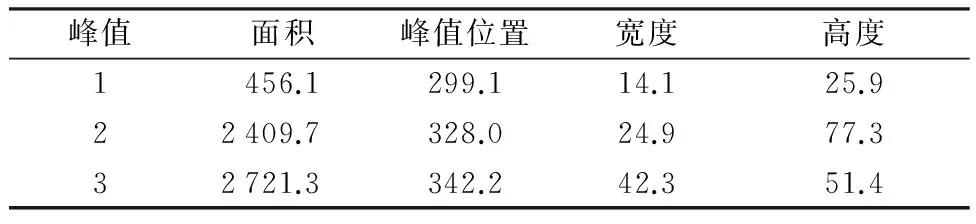
峰值面积峰值位置宽度高度1456.1299.114.125.922409.7328.024.977.332721.3342.242.351.4
高斯多峰拟合后,根据表2、3中的面积(Area)参数分别计算2种体系下原始光谱高斯曲线拟合结果中各组成峰的峰面积,并根据表2中所列各组成峰的归属,计算每种荧光基团相对于蛋白质荧光总面积的相对面积,BSA与Pd(Ⅱ)-BSA体系各荧光基团相对面积的差异预示着两种体系中荧光物质的含量发生了变化.
在228 nm激发下BSA及Pd(Ⅱ)-BSA体系的各荧光成分相对含量对比图如图5.

图5 在228 nm激发下BSA及Pd(Ⅱ)-BSA体系各荧光成分相对含量对比Figure 5 Relative content contrast of the fluorescent components of BSA and Pd(Ⅱ)-BSA system at 228 nm excitation
结果表明,在228 nm激发下两种体系Trp残基的相对贡献量均在90%以上,占据整个BSA总体荧光的主体地位.此外,在228 nm激发下加入Pd(Ⅱ)后Tyr残基的相对含量均有所增加,这有可能是由于Pd(Ⅱ)使得裸露在外的Trp残基结构发生一定的变化,使Trp残基荧光相对贡献量减少,BSA仅在第212位和第134位含有Trp残基,而BSA荧光主要是由第212位Trp残基发出的,因此可推测Pd(Ⅱ)与BSA的结合位置极有可能为第212位Trp残基.
2.2.3 Pd(Ⅱ)与牛血清白蛋白相互作用的高斯多峰拟合
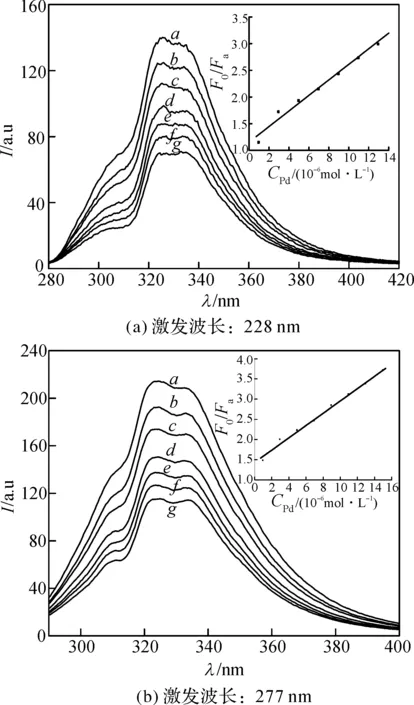
图6 不同波长激发下Pd(Ⅱ)-BSA体系荧光光谱图Figure 6 Fluorescence spectra of Pd(Ⅱ)-BSA system at different wavelength excitation
选用277 nm和228 nm波长激发,分别测量了不同浓度Pd(Ⅱ)对BSA的荧光猝灭作用(见图6).其中c[Pd(Ⅱ)]/(10-6mol/L):a:3,b:5,c:7,d:9,e:11,f:13,g:15,c(BSA)=2×10-6mol/L,pH=7.结果表明,不同浓度Pd(Ⅱ)会与BSA相互作用产生不同程度的猝灭,而且在一定范围内ΔF与Pd(Ⅱ)浓度成正比.
荧光猝灭机理可分为静态猝灭和动态猝灭.静态猝灭是由于猝灭剂与荧光体分子在基态形成不发光的配合物或分子间复合物,从而导致荧光体发光强度降低的过程;动态猝灭是荧光体激发态分子与猝灭剂之间的相互作用过程,该过程遵Stern-Volmer方程[9-10]
F0/Fa=1+Kqτ0c(Q)=1+Ksvc(Q)
(1)
式中:Kq—双分子猝灭过程的速率常数;Ksv—Stern-Volmer猝灭常数;c(Q)—猝灭剂浓度.
为了确定Pd(Ⅱ)对BSA荧光猝灭机理的类型,先假定该过程为动态猝灭过程,以F0/F对c[Pd(Ⅱ)]作Stern-Volmer图(见图6中的插图).
在277 nm激发下,Pd(Ⅱ)-BSA体系的Stern-Volmer方程为F0/F=1.43+1.52×105c[Pd(Ⅱ)](mol/L),将大分子的平均荧光寿命取为10 ns计算,可得出Kq=1.52×1013(mol/L)-1·s-1,此值远大于大分子最大荧光速率常数2.0×1010(mol/L)-1s-1.相同的方法,在228 nm激发下,Stern-Volmer方程为F0/F=1.15+1.46×105c[Pd(Ⅱ)](mol/L),求得此时Kq=1.46×1013(mol/L)-1·s-1,同样远大于大分子最大荧光速率常数.由此可以判断不同波长激发下,Pd(Ⅱ)与BSA作用后的猝灭机理属于静态猝灭.
综上所述,猝灭速率常数Kq、吸收光谱的变化均表明Pd(Ⅱ)对BSA的荧光猝灭作用是属于静态猝灭过程.
3 结 语
本文用高斯多峰拟合法对Pd(Ⅱ)-BSA体系的荧光光谱各荧光成分进行了解析,并推测了Pd(Ⅱ)与BSA结合作用的位置可能在第212位Trp残基;分析了Pd(Ⅱ)-BSA体系的荧光猝灭机理,结合紫外可见吸收光谱更为准确的判定了Pd(Ⅱ)对BSA的荧光猝灭作用属于静态猝灭.
[1] KIELHORN J, MEIBER C, KELLER D, et al. Palladium-a review of exposure and effects to human health[J]. International Journal of Hygiene and Environmental Health,2002,205(6):417-432.
[2] GARRETT C E, PRASAD K. The art of meeting palladium specifications in active pharmaceutical ingredients produced by Pd‐catalyzed reactions[J]. Advanced Synthesis & Catalysis,2004,346(8):889-900.
[3] YUE Y, ZHANG Y, ZHOU L, et al. In vitro study on the binding of herbicide glyphosate to human serum albumin by optical spectroscopy and molecular modeling[J]. Journal of Photochemistry and Photobiology B: Biology,2008,90(1):26-32.
[4] YUE Y, LIU J, FAN J, et al. Binding studies of phloridzin with human serum albumin and its effect on the conformation of protein[J]. Journal of Pharmaceutical and Biomedical Analysis,2011,56(2):336-342.
[5] ZHANG Y, Li J, Dong L, et al. Characterization of interaction between esculin and human serum albumin in membrane mimetic environments[J]. Journal of Molecular Structure,2008,889(1):119-128.
[6] 李建东,吴敏,丁建华.高斯拟合法研究肝病变白鼠血清荧光光谱[J].激光杂志,2004,25(5):95-96. LI Jiandong, WU Min, DING Jianhua. Study on the second derivative spectra of rats serum fluorescence spectrum of liver fibrosis[J]. Laser Journal,2004,15(8):1007-1010.
[7] 顾春峰,兰秀风,于银山,等.牛奶水溶液的荧光光谱研究[J].光子学报,2012,41(1):107-111. GU ChunFeng, LAN XiuFeng, YU YinShan, et al. Fluorescence spectrum of milk solution[J]. Acta Photonica Simica,2012,41(1):107-111.
[8] RUAN K, LI J, LIANG R, et al. A rare protein fluorescence behavior where the emission is dominated by tyrosine: case of the 33-kDa protein from spinach photosystem II[J]. Biochemical and Biophysical Research Communications,2002,293(1):593-597.
[9] HU Y J, LIU Y, ZHANG L X, et al. Studies of interaction between colchicine and bovine serum albumin by fluorescence quenching method[J]. Journal of Molecular Structure,2005,750(1):174-178.
[10] WANG Q, LIU P, ZHOU X, et al. Thermodynamic and conformational investigation of the influence of CdTe QDs size on the toxic interaction with BSA[J]. Journal of Photochemistry and Photobiology A: Chemistry,2012,230(1):23-30.
Fluorescence spectra of Pd(Ⅱ)-BSA(bovine serum album) solvent systems
ZHENG Xiao, YE Manping, LI Yi
(College of Optical and Electronic Technology, China Jiliang University, Hangzhou 310018, China)
The fluorescence spectra of Pd(Ⅱ)-BSA were studied. The multi-peak gaussian fitting was used to analyse the spectra. It was found that the luorescence of BSA mainly originated from the tryptophan (Trp) residue; and the location of interaction between Pd(Ⅱ) and BSA might be at the 212th Trp residue. By an analysis of the fluorescence quenching spectra of the interaction solvent between Pd(Ⅱ) and BSA, the changes of the UV-Vis absorption spectra, and the comparison of the quench constantKq, the fluorescence quenching mechanism of the Pd(Ⅱ)-BSA system was identified. The results show that the quench procedure is static quench.
fluorescence spectrum; fluorescence quench; bovine serum album; palladinm ion Pd(Ⅱ)
1004-1540(2015)01-0060-05
10.3969/j.issn.1004-1540.2015.01.011
2014-11-21 《中国计量学院学报》网址:zgjl.cbpt.cnki.net

O657.3
A
