黄蜀葵化学成分与药理活性研究进展
2015-03-23谢国勇李旭森秦民坚
温 锐,谢国勇,李旭森,秦民坚*
(1.中国药科大学 中药资源学教研室,江苏 南京 210009;2.中国药科大学 教育部现代中药研究重点实验室,江苏 南京 210009)
黄蜀葵化学成分与药理活性研究进展
温 锐1,2,谢国勇1,2,李旭森1,2,秦民坚1,2*
(1.中国药科大学 中药资源学教研室,江苏 南京 210009;2.中国药科大学 教育部现代中药研究重点实验室,江苏 南京 210009)
黄蜀葵[Abelmoschusmanihot(L.) Medicus]为锦葵科秋葵属植物,主要含黄酮类、有机酸类、甾类及挥发性成分,具有消炎止痛、抗氧化、保肝保肾、保护心脑血管等药理活性。通过系统的文献调研,对黄蜀葵花、根茎叶、种子的化学成分和药理活性分别进行了总结,为进一步开发利用该植物资源提供参考。
黄蜀葵;锦葵科;化学成分;药理活性
黄蜀葵[Abelmoschusmanihot(L.) Medic.]为锦葵科(Malvaceae)秋葵属(Abelmoschus)一年至多年生草本植物,始载于宋代掌禹锡所著《嘉佑本草》,其后历代本草均有记载,并收载于各版《中华人民共和国药典》。黄蜀葵原产于我国南方,喜温暖湿润,现除西北、东北等地外,全国大部分地区均有分布或栽培[1]。历代本草多用其花入药,其次是种子、根,茎和叶少用。其花味甘性寒,具有清热利湿、消肿解毒的功能;用于湿热壅遏、淋浊水肿;外治痈疽肿毒,水火烫伤。种子又称胡葵子,味甘性寒,具有补脾健胃、生肌功效,治疗消化不良、不思饮食等[2]。黄蜀葵为药食同源植物,近年来研究较多,本文将从其名称考证、化学成分及药理活性等方面进行详细的综述,旨在为该植物资源的进一步开发利用和质量评价提供科学依据。
1 名称考证
古往今来,同名异物,异物同名层出不穷。黄蜀葵也是异名繁杂,据可考文献记载有:黄葵(《说文》);侧金盏,秋葵(《群芳谱》);棉花葵(《植物名实图考》);黄秋葵,金花捷报,水棉花,棉花七,棉花蒿,小棉花,溪麻,野芙蓉,野甲花(《中药大辞典》);豹子眼睛花、霸天伞(《全国中草药汇编》)[3]。除此之外,各地区还有俗名[4]:如假阳桃(福建、广东、广西);黄花莲、鸡爪莲、疽疮药、追风药(江西);荞面花(昆明);漏芦花(四川)等。
《说文》记载黄蜀葵Abelmoschusmanihot(L.) Medic. 为黄葵, 《本草纲目》也将黄蜀葵简述为“黄
葵”,而今锦葵科秋葵属另有黄葵Abelmoschusmoschatus(L.) Medik,两者形态特征相似,黄葵蒴果长圆形,长5~6 cm,顶端尖,比黄蜀葵略长,种子肾形,具麝香味是其特点。黄蜀葵与黄葵原指一物,现为同属两种。古称黄蜀葵为秋葵或黄秋葵,今亦为同属两种。
此外,还存在关于黄蜀葵与菜芙蓉究竟是否为同一种植物的争议。菜芙蓉(HibiscusmanihotL.)又名金花葵、野芙蓉,中国科技大学生命科学院沈显副教授指出,菜芙蓉的中文学名叫黄蜀葵,而北京玺同春科技开发中心王绍章教授认为,菜芙蓉是野芙蓉三个种群中的一种,和黄蜀葵同属。根据恩格勒植物分类系统,锦葵科秋葵属有7个种,分别为:黄蜀葵(原变种)Abelmoschusmanihot(L.) Medic var.manihot,刚毛黄蜀葵(变种)Abelmoschusmanihot(L.) Medic var.pungens(Roxb.) Hochr,长毛黄葵AbelmoschuscrinitusWall.,咖啡黄葵Abelmoschusesculentus(L.) Moench,黄葵Abelmoschusmoschatus(L.) Medik,木里秋葵AbelmoschusmuliensisK. M. Feng,箭叶秋葵Abelmoschussagittifolius(Kurz) Merr.。其中并没有HibiscusmanihotL.,并且在1984版《中国植物志》上“HibiscusmanihotL.”是收录于“黄蜀葵”项下,而中国植物主题数据库显示,“Hibiscusmanihot”被SP2000收录,为异名,其接受名为“Abelmoschusmanihot”。
中文文献关于黄蜀葵、菜芙蓉与金花葵引用混乱。根据文献调研,现今实验性研究报道中的菜芙蓉与黄蜀葵为同一植物。由于黄蜀葵与金花葵均有菜芙蓉一称,CNKI收录的文献中则是金花葵与菜芙蓉混用。
1984年全国资源普查时并未找到金花葵植物,因此其已被生物界认定灭绝,而2003年8月,中国农科院唐益雄教授在河北省邢台市考察时,发现了金花葵植物群落,该发现又成为了黄蜀葵与金花葵是两种植物的力证。关于金花葵的文献记载仅有《顺德府志》(邢台市明、清两代称顺德府):“顺德府有特产植物金花葵”。自2003年经专家确认在河北邢台发现的植物群落为金花葵后,中国农业科学院与山东东圣达实业集团合作在山东省齐河县赵官镇大面积种植金花葵,并获得成功。虽然国内已普遍认为黄蜀葵与金花葵为两种植物,但却还未得到国际上的认可,并且作为独立种,金花葵还没有官方学名。
2 资源分布
黄蜀葵原产于我国南方,后引入印度等国。黄蜀葵对霜冻非常敏感,因此其在热带及亚热带地区能更好的生长[5]。黄蜀葵(原变种)产于河北、山东、河南、陕西、湖北、湖南、四川、贵州、云南、广西、广东和福建等省区,印度、斯里兰卡、北昆士兰等地也有分布,常生于山谷草丛、田边或沟旁灌丛间;刚毛黄蜀葵(变种)产于云南、贵州、四川、湖北、广东、广西及台湾等省区,亦分布于印度、锡金、尼泊尔和菲律宾等地[4-5]。变种刚毛黄蜀葵与原变种的不同处在于植株全体密被黄色长刚毛。
3 临床应用
黄蜀葵作为传统民间用药,其药用历史悠久,主要用于治疗慢性支气管炎、慢性肾病及其并发症、泌尿感染、水火烫伤、口腔溃疡、乳糜尿及止痛等[5]。安徽、江苏等地用黄蜀葵花水煎液治疗黄疸和急慢性肝炎[6]。由江苏苏中药业开发的Ⅲ类新药黄葵胶囊,由黄蜀葵花醇提物组成,临床用于治疗慢性肾小球肾炎,取得良好疗效。
《嘉佑本草》记载:“黄蜀葵花,六、七月采,阴干之……治诸恶疮脓水久不瘥者,作末敷即愈,为疮家要药。”《本草衍义》中述:“子临产时,取四十九粒,研烂,用温水调服,良久产。”《岭南采药录》记载:“消疮排脓用黄蜀葵根,捣烂敷;治疳疔痔疮时黄蜀葵根,煎水洗。”《本草纲目》亦云:“花、子与根性功相同,可以互用。无花用子,无子用根……治痈疽肿毒……无花,用根、叶亦可。”但现代化学研究表明,黄蜀葵花主要含黄酮类成分,种子主要含氨基酸和不饱和脂肪酸,根茎叶中主要为多糖类物质。化学成分不同,药理活性往往不同,现代药理研究也表明,黄蜀葵花、种子、根、茎叶的药理活性有所不同。
黄蜀葵在少数民族用药治疗的病症与古籍记载基本吻合,中国植物主题数据库收载了黄蜀葵作为傈僳药(质腊西、nifsair yot)、畬药(野芙蓉、三胶破)、瑶药(温补迥、水芙蓉)、白药(华福菜)、傣药[文波,不来俄、郭波(西傣),水海郎扭日、烘董(德傣)]、景颇药(棘脚,半检播)、哈尼药(碧约)、彝药(野棉花、冶绵华)、藏药(索玛那保)、苗药(朝天木麻,崽狗鞭,Nadang-lishne)及基洛药(补拍勒)等11种少数民族用药功效。
此外,尼泊尔将黄蜀葵根的汁液热敷用于治疗扭伤[5];千里达(Trinidad)和多巴哥岛(Tobago)将黄蜀葵种子粉碎泡脚用于治疗脚部痉挛;在巴布亚新几内亚,瓦努阿图,斐济和新喀里多尼亚以及中国将黄蜀葵(种子)用于催产,以缓解分娩痛苦,并且能刺激泌乳,抑制月经过多,甚至可以用于诱发流产[7]。
4 化学成分研究
近年来,随着提取方法、分离手段的进步,关于黄蜀葵化学成分的研究越来越多,但主要都集中于对黄蜀葵花部的化学成分研究,关于种子、根、茎和叶的研究则相对较少。
4.1 花的化学成分
据研究报道,黄蜀葵花中的主要化学成分为黄酮醇类化合物,其它则包括有机酸类、鞣酸类、甾类及长链烃类等化合物。
4.1.1 黄酮类
黄蜀葵花中主要的黄酮类成分为:金丝桃苷、芦丁、异槲皮苷、hibifolin、杨梅素、槲皮素、槲皮素-3′-O-葡萄糖苷。迄今为止,文献报道的黄蜀葵花黄酮类化合物见下表1[1,8-14]。

图1 黄蜀葵花中的黄酮类成分

编号名称R1R2R3R4R5R6R71槲皮素(quercetin)OHOHOHHOHOHH2金丝桃苷(hyperoside)OGalOHOHHOHOHH3异槲皮苷(isoquercitrin)OGlcOHOHHOHOHH4槲皮素-3-O-β-芸香糖苷(quercetin-3-O-β-rutinoside)ORha→GlcOHOHHOHOHH5槲皮素-3-O-β-刺槐糖苷(quercetin-3-O-β-robinobioside)ORha→GalOHOHHOHOHH6槲皮素3-O-β-D-木糖基-(1→2)-β-D-半乳糖苷(quercetin-3-O-β-D-xylopyranosyl-(1→2)-β-D-galactopyranoside])OGal→XylOHOHHOHOHH7槲皮素-3-O-β-D-6″-乙酰葡萄糖苷(quercetin-3-O-B-D-6″-acetylgluco-pyranoside)O-6″-acetylGlcOHOHHOHOHH8槲皮素-3-O-[β-D-木糖基-(1→2)-α-L-鼠李糖基-(1→6)]-β-D半乳糖苷(quercetin-3-O-[β-D-xylopyranosyl-(1→2)-α-L-rhamnopyranosyl-(1→6)]-β-D-galactopyranoside)OGal→Rha→XylOHOHHOHOHH9槲皮素-3'-O-β-D-葡萄糖苷(quercetin-3'-O-β-D-glucoside)OHOHOHHOGlcOHH10槲皮素-7-O-β-D-葡萄糖苷(quercetin-7-O-β-D-glucoside)OHOHOGlcHOHOHH11杨梅素(myricetin)OHOHOHHOHOHOH12杨梅素-3-O-β-D-葡萄糖苷(myricetin-3-O-β-D-glucoside)OGlcOHOHHOHOHOH13大麻苷(cannabiscitrin)OHOHOHHOHOHOGlc14杨梅素-3-O-β-D-半乳糖苷(myricetin-3-O-β-D-galactopyr-anoside)OGalOHOHHOHOHOH15杨梅素-3-O-β-D-芸香糖苷(myricetin-3-O-β-D-rutinoside)ORha→GlcOHOHHOHOHOH16杨梅素-3-O-β-刺槐糖苷(myricetin-3-O-β-robinobioside)ORha→GalOHOHHOHOHOH17myricetin-3-O-β-D-xylopyranosyl-(1→2)-β-D-glucopyrano-sideOGlc→XylOHOHHOHOHOH18棉皮素(gossypetin)OHOHOHOHOHOHH19棉皮素-3-O-β-D-葡萄糖-8-O-β-D-葡萄糖醛酸(gossypetin3-O-β-glucopyranoside-8-O-β-glucuronopyranoside)OGlcOHOHOGluOHOHH20棉皮素-3'-O-β-D-葡萄糖苷(gossypetin-3'-O-β-D-gluco-side)OHOHOHOHOGlcOHH21棉花皮素-8-O-β-D-葡糖醛酸苷(gossypetin-8-O-β-D-glucu-ronide)OHOHOHOGluOHOHH22山奈酚3-O-[(3″-O-乙酰基-6″-O-(E)-对羟基桂皮酰基)]-O-β-D-葡萄糖苷(kaempferol3-O-[3″-O-acetyl-6″-O-(E)-p-coumaroyl]-β-D-glucopyranoside)见图2OHOHHHOHH23银椴苷(tiliroside)见图2OHOHHHOHH248-甲氧基槲皮素(8-methoxy-quercetin)OHOHOHOCH3OHOHH255-羟基-4',7,8-三甲氧基黄酮HOHOCH3OCH3HOCH3H263',5-二羟基-7,8-二甲氧基黄酮-4'-O-β-D-葡萄糖苷HOHOCH3OCH3OHOGlcH
续表1

编号名称R1R2R3R4R5R6R7274'-甲氧基-5,7-二羟基黄酮-8-[O-β-D-木糖基-(1→3)]-O-β-D-葡萄糖苷HOHOHOGlc→XylHOCH3H283'-甲氧基-5,7-二羟基黄酮-8[O-β-D-木糖基-(1→3)]-O-β-D-葡萄糖苷HOHOHOGlc→XylOCH3HH29myricetin-3-O-β-D-xylopyranosyl-(1→2)-β-D-galactopyrano-sideOGal→XylOHOHHOHOHOH303,3'4',5,5',7,8-heptahydroxylflavone-3'-O-β-D-glucopyrano-sideOHOHOHOHOGlcOHOH313,3',4',5,5',7,8-heptahydroxylflavone-8-O-β-D-glucuronopyr-anosideOHOHOHOGlcAOHOHOH323,3',4',7-tetrahydroxyl-5-methoxylflavone-3-O-robinosideOGal→RhaOCH3OHOHOHOHH33quercetin-3'-O-(6″-acetyl)-β-D-glucopyranosideOHOHOHHO-6-acetylGlcOHH34quercetin-8-(6″-acetyl)-β-D-glucopyranosideOHOHOH6-ethylGlcAOHOHH
注:Gal=β-D-galatopyranosy;Glc =β-D-glucopyranosyl;Xyl =β-D-xylopyranosyl ;
Glu=β-D-glucuronopyranosy;Rha =α-L-rhamnopyranosyl
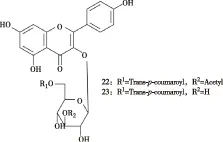
图2 化合物22,23结构
4.1.2 有机酸类
从黄蜀葵花中分离得到的有机酸类化合物有2,4-二羟基苯甲酸(2,4-dihydroxybenzoicacid)、没食子酸(gallic acid)、咖啡酸(caffeic acid)、3-O-咖啡酸奎尼酸(3-O-caffeoylquinic acid)、3,5-二-O-咖啡酸奎尼酸(3,5-di-O-caffeoylquinic acid)、4,5-二-O-咖啡酸奎尼酸(4,5-di-O-caffeoylquinic acid)、3,4-二-O-咖啡酸奎尼酸(3,4-di-O-caffeoylquinicacid)、原儿茶酸(proto-catechuic acid)等[1,8,13]。
4.1.3 甾类
黄蜀葵花中含有豆甾醇(stigmasterol)、α-菠甾醇(α-spinasterol)、β-谷甾醇(β-sitosterol)、β-谷甾醇-3-O-β-D-葡萄糖苷(β-sitosterol-3-O-β-D- glucopyranoside)、β-胡萝卜苷(β-daucosterol)等甾类成分[1,8]。
4.1.4 挥发性成分
张元媛[10]等利用LC-MS分离鉴定了黄蜀葵花中11个挥发性成分,分别为:十四(烷)酸(tetradecanoic acid)、十六烷(hexadecane)、6,10-二甲基-2-十一烷酮(6,10-di-methyl-undecanone)、二十一烷(heneicosane)、十六(烷)酸(hexadecanoic acid)、十八烷(octadecane)、十一烯酸烯丙酯(allyl undecylenate)、2,6,10,15-四甲基十七烷(2,6,10,15-tetra-methy-heptadecane)、9,12-二烯十八酸(9,12-octadecadienoic acid (z,z))、二十二烷(docosane)、二十四烷(tetracosane),此外还有顺丁烯二酸(maleic acid)、正三十七烷酸(heptatriacontanoic acid)、正三十烷醇(1-triacontanol)[1,8]。
4.1.4 其他
除上述几大类化合物外,黄蜀葵花中还含有香豆素类如6-甲氧基-7-羟基香豆素(6-methoxyl-7-hydroxyl coumarin);长链脂肪烃类如1-O-十六烷酸甘油酯(glycerolmonopalmitate),含氮化合物类如腺苷(adenosine)、鸟苷(guanosine)等,以及4-羟基苯甲酸-β-D-葡萄糖酯(4-hydroxybenzoic acid-β-D-glucose ester)、原儿茶酸3-O-β-D-葡萄糖苷(protocatecheuic acid -3-O-β-D-glucoside)、黄蜀葵神经酰胺等[1,8,13]。
4.2 黄蜀葵种子的化学成分
Jarret等研究指出黄蜀葵种子油含量为16.1~22.0%[15]。林文群等[16]对黄蜀葵种子的化学成分进行了研究,结果表明黄蜀葵种子脂肪油中含有大量的不饱和脂肪酸,含量高达91.815%以及丰富的氨基酸。必需氨基酸含量较高,占总氨基酸的30.59%。黄蜀葵中的无机元素含量也非常丰富,包括K、Ca、Fe、Mn、Cu、Zn、Mo等24种矿物元素,且汞、砷、镉等有害元素的含量低于食品卫生标准。因此,黄蜀葵种子具有较高的营养价值和医疗保健功效,具有开发利用的巨大潜在价值。
4.3 黄蜀葵根、茎、叶的化学成分
黄蜀葵植物粘液中主要含多糖类物质和蛋白质。Rao K S等[17]研究指出黄蜀葵叶子含1.77 %脂质,2.20%蛋白质,1.61%灰分,水分含量则高达88.4%,其中脂质是由非极性脂质、糖脂和磷脂组成。有报道称黄蜀葵木质茎中含有甾类、三萜和黄酮类化合物,Jain等[18]从黄蜀葵木质茎的石油醚部位分得豆甾醇和γ-谷甾醇。黄蜀葵多糖干态为淡棕黄色或带绿色粉末,在食品工业中用作增稠剂和稳定剂,根的黏质可用作润滑药,用于黏膜炎症,起保护和缓解刺激的作用。高素莲等[19]研究表明多糖中含有半乳糖、阿拉伯糖和鼠李糖3种成分,红外吸收光谱法鉴定其糖苷键为α-吡喃糖苷键;而王雪梅等[20]研究表明4种多糖主要由半乳糖、葡糖糖和甘露糖组成,还可检出极少量的阿拉伯糖,但未检出鼠李糖,与高素莲等报道不一致,说明不同来源的黄蜀葵多糖在单糖组成上存在较大差异。
5 药理活性
黄蜀葵作为传统用药,可用于治疗多种疾病。黄蜀葵不同部位具有不同的化学成分,药理活性也有所差别。现代研究多集中于黄蜀葵花,黄蜀葵花总黄酮(TFA)为其药效成分,现代药理学研究主要集中于TFA及金丝桃苷等单体化合物。随着研究的深入及研究手段的创新,对黄蜀葵其他部位的药理活性也展开了系统研究。
5.1 黄蜀葵花的药理作用
5.1.1 保肝作用
江苏、安徽等地用黄蜀葵花的煎剂治疗黄疸和急慢性肝炎,药理学研究表明黄蜀葵花中总黄酮(TFA)提取物是其主要的保肝活性成分。
Ai等[6]利用CCl4诱导体外培养的肝细胞损伤和大鼠肝损伤两种模型检测TFA的保肝作用,结果表明TFA能通过抗氧化应激与抗炎作用来保护CCl4导致的肝(细胞)损伤。当用不同浓度的TFA处理CCl4的肝细胞时,其存活率随TFA浓度的上升而增加,而培养液中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和碱性磷酸酶(ALP)的水平则明显降低;TFA能显著抑制由CCl4引起的大鼠血清中ALT、AST、ALP及γ-谷氨酰转移酶(γ-GT)的增加,降低丙二醛(MDA)水平,并提高肝脏中谷胱甘肽(GSH)的含量,同时剂量依赖性的增强SOD、GPx、CAT、GST等抗氧化酶的活性,抑制TNF-α、IL-1β、NO等炎症因子的释放。组织分析还表明TFA能缩小CCl4引起的肝损伤范围。
从黄蜀葵花中分离得到的金丝桃苷能抗HBV(乙肝病毒),Wu等[21]利用肝癌细胞模型和鸭乙肝病毒感染模型(DHBV)来检测的金丝桃苷的保肝作用,金丝桃苷的保肝作用呈剂量和时间双重依赖型,它能抑制TNF-α诱导的肝细胞凋亡。
5.1.2 对肾脏的保护作用
肾小球足细胞凋亡是糖尿病肾病(DN)重要的病理原因,TFA能显著降低链脲霉素诱导的DN大鼠的尿微量蛋白,改善足细胞凋亡;金丝桃苷预孵育能缓解由晚期糖基化产物(AGEs)引起的足细胞凋亡,并能抑制由AGEs引起的细胞凋亡蛋白酶的增加[22]。
Ⅲ类新药黄葵胶囊,由黄蜀葵花醇提物组成,其主要活性成分为TFA,临床用于治疗慢性肾小球肾炎。它能通过抑制P38 MARK信号通路改善阿霉素肾病炎症,TFA能够提高湿热型慢性肾炎大鼠的红细胞免疫黏附功能、抑制系膜细胞增殖和基质增生,抗肾纤维化,抗肾小管上皮损伤,减轻肾小管间质病变、改善蛋白尿、血尿、肾功能等临床表征[23]。
5.1.3 改善脑卒中后抑郁
脑卒中后抑郁(PSD)是脑卒中引发的抑郁症,是脑卒中常见的并发症,郝吉莉[24]采用线栓法阻断右侧大脑中动脉1小时后再灌注制备局灶性脑缺血模型,在此基础上复合慢性应激和孤养制备的PSD大鼠模型来研究TFA对脑卒中后抑郁的保护作用,结果表明TFA可不同程度地改善 PSD大鼠的抑郁状态,使体重相对增加,活动增多,糖水消耗量增加,通过抑制脂质过氧化、改善血液流变学及抑制下丘脑-垂体-肾上腺(HPA)轴的过度激活来达到抗PSD的作用。刘梅等[25]研究表明TFA能改善PSD小鼠的行为障碍,上调SOD、GSH-Px至正常水平,降低MDA水平以及由PSD引起的神经元死亡与减少;上调BNDF的mRNA和蛋白质表达以及CREB的mRNA水平。
5.1.4 对心肌缺血缺氧损伤及缺血再灌注损伤的保护作用
TFA能不同程度减轻缺血再灌注损伤模型的心肌损伤程度,降低心律失常的发生率,显著降低心肌组织和血清中MDA含量,同时增强SOD、GSH-Px活性,抑制血清中肌酸磷酸激酶和乳酸脱氢酶的产生和释放,上调bcl-2 mRNA的表达,下调缺血心肌组织中ICAM-1 mRNA的表达,降低心肌细胞凋亡率[26]。说明TFA可能是通过抑制心肌脂质过氧化及心肌炎症反应、抑制心肌细胞凋亡以及改善心肌能量代谢来发挥其保护作用。
5.1.5 对脑缺血损伤及缺血再灌注损伤的保护作用
NO在一定范围内可通过脑血管扩张,增加脑血流量及抑制血小板聚集和中性粒细胞黏附对脑缺血产生保护作用。文继月等[27]利用右大脑中动脉缺血模型研究黄蜀葵总黄酮药理预适应对大鼠脑局部缺血再灌注损伤的保护作用,结果表明一定量TFA和硝苯地平均能降低大鼠脑梗塞范围,抑制血清中LDH活性和MDA水平,上调大脑iNOS mRNA的表达,提高脑缺血组织中NO水平。郭岩等[28]通过结扎两侧颈总动脉造成小鼠全脑缺血模型,研究黄蜀葵总黄酮对脑缺血-再灌注损伤的保护作用,研究显示TFA能延长小鼠缺氧后的存活时间,提高脑局部缺血后的存活率,以及抑制大脑皮层中MDA的升高;抑制家兔脑缺血再灌注诱导的脑电描记、MDA和LDH的变化。该作用的机制可能与清除自由基与抑制脂质过氧化有关。而一定量TFA能改善脑细胞的超微结构,剂量依赖性抑制中脑动脉闭塞大鼠脑细胞的凋亡,说明TFA能通过抑制细胞凋亡发挥脑缺血损伤保护作用。
5.1.6 抗炎作用
炎症介质是一组参与炎症反应并具有致炎作用的体液性物质,它不仅与炎症有关,而且也参与其他病理过程和正常生理调控过程。
给大鼠左后足趾皮内注射0.1 mL弗氏完全佐剂诱发大鼠佐剂性关节炎,给药TFA后,可使大鼠白细胞介素-1、肿瘤坏死因子-α、前列腺素E2和NO等炎症因子含量显著降低,说明TFA能减轻大鼠原发性、继发性关节肿胀和多发性关节炎程度,其作用途径可能与调节机体异常免疫有关[29];而黄蜀葵花提取物对 LPS 诱导的人中性粒细胞分泌 IL- 8 具有抑制作用, 但尚未观察到其具有抑制 PMN 活化的作用。
5.1.7 抗氧化作用
现代药理研究表明,机体代谢产生的自由基的积累是引发各种病症的病机之一。维生素C(抗坏血酸)是一种高效的抗氧化剂,参与机体许多的新陈代谢过程。黄蜀葵花的醇提物与之相比具有更高的抗氧化活性。研究表明黄蜀葵花醇提物对超氧阴离子、氢自由基、DPPH自由基的清除力以及抑制醛糖还原酶活性均高于维C[14]。
5.1.8 对血液系统的影响
以体外培养的人脐静脉血管内皮细胞(HUVEC)为模型,MTT法检测不同浓度的TFA对细胞增殖的影响、Transwell小室细胞迁移实验检测药物对细胞迁移能力的作用、管形形成实验观察药物对细胞分化的影响,结果表明,一定浓度的TFA能明显促进HUVEC分化形成新生血管;而金丝桃苷能通过内皮依赖和非内皮依赖机制显著超极化大鼠基底动脉平滑肌细胞,从而舒张基底动脉[30]。郭岩等[31]以血栓大鼠模型检测TFA对血小板的影响,一定浓度的TFA能减少血栓湿重,有效抑制骨胶原引起的血小板聚集。 凝血过程的关键是凝血酶,凝血酶是血栓疾病预防治疗的关键靶点,目前抗血栓的治疗方法大多集中在阻断凝血酶活性或阻断其生成上,刘一等[32]利用毛细管区带电泳检测到部分黄蜀葵黄酮能与凝血酶相互作用。
5.1.9 对肿瘤细胞的抑制作用
仇燕等[33]利用MTT法研究黄蜀葵花醇提物(AFEE)及其中的金丝桃苷对海拉细胞生长的抑制作用,结果显示AFEE及金丝桃苷能显著抑制海拉细胞的生长,IC50均为228 μg/ml,且AFEE对羟基、超氧负离子和DPPH自由基的清除力随着总黄酮含量的增加而增强,AFEE对海拉细胞生长的抑制作用呈剂量依赖性。
5.1.10 镇痛
采用冰醋酸致小鼠扭体模型(AA)、福尔马林模型(For)及KCl诱痛模型来观察TFA的镇痛作用;采用连续给药方式观其作用有无成瘾性。结果表明TFA可不同程度地抑制小鼠扭体反应;TFA(140、280 mg/kg,ig)可使福尔马林致小鼠疼痛的Ⅰ、Ⅱ相反应明显减轻,TFA对同侧福尔马林导致的疼痛可产生同样抑制作用,但对侧福尔马林致小鼠疼痛无明显影响;动脉注射TFA 200 mg/kg可明显减轻KCl诱发的家兔疼痛反应,说明TFA具有一定的镇痛作用且局部给药有效,连续用药无成瘾性[34]。
5.1.11 对脂质的影响
研究表明黄蜀葵黄酮能抑制甘油三酯(TG)在3T3-L1脂肪细胞中的积累,能缓解大鼠高血脂症,降低总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)及氧化型低密度脂蛋白(ox-LDL)水平,延缓泡沫细胞的形成和动脉粥样硬化的发生[35]。
5.1.12 其他
除上述药理活性外,黄蜀葵还能抑制变形链球菌的生长和产酸,抑制大鼠海马神经元NMDA受体介导的生物电流,治疗小面积的烧烫伤,提高机体免疫力,缓解疲劳,延缓衰老[36]。
5.2 黄蜀葵叶的药理作用
5.2.1 止痛活性
实验人员通过热板法和尾部浸渍法来研究黄蜀葵叶石油醚和甲醇提取物的止痛活性,结果表明这两种提取物均有良好的止痛效果,且止痛能力呈剂量依赖性[37]。
5.2.2 预防骨质疏松
骨质疏松是一种单位体积内骨组织减少的病症,在老年人及绝经后的妇女中比较常见,骨质疏松容易导致骨折及呼吸功能下降等。研究表明缺乏雌二醇是其主要病理原因,现在一般采用激素替代疗法,但容易产生副作用。越来越多的研究者开始从天然植物中寻找安全的无毒副作用的植物药。研究人员向切除卵巢的大鼠日常饮食中加入适量的黄蜀葵叶,喂养3个月后,与对照组相比,黄蜀葵叶能提高大鼠股骨及其干骺端和骨干亚区的骨矿物密度及骨矿物质含量,从而预防大鼠的骨质疏松症[38]。
5.3 黄蜀葵茎的抗炎活性
Jain等利用角叉菜胶和组胺诱导的两种大鼠足跖肿胀模型来检测黄蜀葵木质茎石油醚和甲醇提取物的抗炎活性,结果表明两种提取物均有显著地抗炎活性,且抗炎效果呈剂量依赖性;黄蜀葵木质茎提取物无急性毒性[39]。
5.4 黄蜀葵种子中不饱和脂肪酸对实验性高血脂大鼠血脂和肝功能的影响
黄蜀葵籽不饱和脂肪酸可明显降低模型大鼠血清中总胆固醇、甘油三酯、高密度脂蛋白、丙氨酸转氨酶和天冬氨酸转氨酶水平,减少肝脂堆积,从而达到调血脂和护肝的作用[40]。
6 总 结
黄蜀葵作为药食同源植物,在民间应用十分广泛。其资源丰富,在全国各地均有分布或栽培,植株抗逆性强,但鲜有栽培技术方面的研究。目前栽培的品种基本是直接由野生种驯化而来,而在大面积种植中,黄蜀葵病毒可大面积发生,选育优良品种则是解决病毒的根本途径,今后应从健康、优良的种苗抓起,结合栽培技术的研究,满足优质中药材原料的供应。目前对黄蜀葵的化学成分与药理活性研究多集中于其花,对于根、茎、叶和种子的研究则相对较少,研究多局限于花的总黄酮,对单体化合物的研究较少,且很多药理作用的目标成分尚不明确,尚未充分挖掘和研究黄蜀葵许多独特药效,开发的中药产品不能满足市场需求。因此接下来应重点研究化学成分与药理活性之间的关系,为资源的充分开发利用寻找科学依据。
[1] 陈刚. 黄蜀葵花的化学成分和降糖活性研究[D]. 北京: 中国人民解放军军事医学科学院, 2006.
[2] 刘爽, 江蔚新, 吴斌. 黄蜀葵化学成分及药理活性研究进展[J]. 中国现代中药, 2010, 12(8): 5-9.
[3] 居文政. 黄蜀葵的本草考证[J]. 时珍国药研究, 1994, 5(2): 6-7.
[4] 中国科学院中国植物志编辑委员会. 中国植物志: 第49卷[M]. 北京: 科学出版社, 2013.
[5] Todorwal A, Jain P, Bari S.AbelmoschusmanihotLinn: ethnobotany, phytochemistry and pharmacology[J]. Asian Journal of Traditional Medicines, 2011,6(1): 1-7.
[6] Ai G, Liu Q, Hua W, et al. Hepatoprotective evaluation of the total flavonoids extracted from flowers ofAbelmoschusmanihot(L.) Medic: In vitro and in vivo studies[J]. Journal of ethnopharmacology, 2013, 146(3): 794-802.
[7] Puel C, Mathey J, Kati-Coulibaly S, et al. Preventive effect ofAbelmoschusmanihot(L.) Medik. on bone loss in the ovariectomised rats[J]. Journal of ethnopharmacology, 2005, 99(1): 55-60.
[8] 赖先银, 赵玉英, 梁鸿. 黄蜀葵花化学成分的研究[J]. 中国中药杂志, 2006, 31(19): 1597-1600.
[9] 王先荣, 周正华, 杜安全, 等. 黄蜀葵花黄酮成分的研究[J]. 中国天然药物, 2004, 2(2): 91-93.
10. 张元媛, 贾晓妮, 曹永翔, 等. 黄蜀葵花化学成分研究[J]. 西北药学杂志, 2008, 23(2): 80-82.
[11] 李春梅, 王涛, 张祎, 等. 中药黄蜀葵花化学成分的分离与鉴定 (Ⅰ)[J]. 沈阳药科大学学报, 2010, 27(9): 711-714.
[12] 李春梅, 王涛, 张祎, 等. 中药黄蜀葵花化学成分的分离与鉴定 (Ⅱ)[J]. 沈阳药科大学学报, 2010 (10): 803-807.
[13] 李春梅, 安雅婷, 王涛, 等. 中药黄蜀葵花化学成分的分离与鉴定 (Ⅲ)[J]. 沈阳药科大学学报, 2011, 28(7): 520-525.
[14] Zhang Y, He W, Li C, et al. Antioxidative flavonol glycosides from the flowers of Abelmouschus manihot[J]. Journal of natural medicines, 2013, 67(1): 78-85.
[15] Jarret R L, Wang M L, Levy I J. Seed oil and fatty acid content in okra (Abelmoschus esculentus) and related species[J]. Journal of agricultural and food chemistry, 2011, 59(8): 4019-4024.
[16] 林文群, 陈忠, 陈金玲, 等. 黄蜀葵种子形态及其化学成分的研究[J]. 天然产物研究与开发, 2002 (3): 41-44.
[17] Rao K S, Dominic R, Singh K, et al. Lipid, fatty acid, amino acid, and mineral compositions of five edible plant leaves[J]. Journal of agricultural and food chemistry, 1990, 38(12): 2137-2139.
[18] Jain P S, Bari S B, Surana S J. Isolation of stigmasterol and y-sitosterol from petroleum ether extract of woody stem ofAbelmoschusmanihot[J]. Asian journal of biological sciences, 2009, 2(4): 112-117.
[19] 高素莲, 张秀真. 黄蜀葵多糖的分析[J]. 分析测试学报, 2002, 21(6): 72-74.
[20] 王雪梅, 汪莹莹, 吴迷迷, 等. 黄蜀葵多糖的分子质量测定及单糖组成分析[J]. 安徽大学学报: 自然科学版, 2011, 35(3): 82-87.
[21] Wu L, Yang X, Huang Z, et al. In vivo and in vitro antiviral activity of hyperoside extracted fromAbelmoschusmanihot(L.) medik[J]. Acta pharmacologica sinica, 2007, 28(3): 404-409.
[22] Zhou L, An X F, Teng S C, et al. Pretreatment with the total flavone glycosides of FlosAbelmoschusmanihotand hyperoside prevents glomerular podocyte apoptosis in streptozotocin-induced diabetic nephropathy[J]. Journal of medicinal food, 2012, 15(5): 461-468.
[23] Tu Y, Sun W, Wan Y G, et al. Huangkui capsule, an extract fromAbelmoschusmanihot(L.) Medic, ameliorates adriamycin-induced renal inflammation and glomerular injury via inhibiting p38MAPK signaling pathway activity in rats[J]. Journal of ethnopharmacology, 2013, 147(2): 311-320.
[24] 郝吉莉. 黄蜀葵总黄酮抗脑卒中后抑郁作用及部分机制研究[D]. 合肥: 安徽医科大学, 2007.
[25] Liu M, Jiang Q H, Hao J L, et al. Protective effect of total flavones ofAbelmoschusmanihotL. Medic against poststroke depression injury in mice and its action mechanism[J]. The Anatomical Record, 2009, 292(3): 412-422.
[26] 范丽, 郭岩, 陈志武, 等. 黄蜀葵花总黄酮预处理对家兔心肌缺血再灌注损伤的影响[J]. 中国药理学通报, 2006, 22(1): 106-109.
[27] Wen J Y, Chen Z W. Protective effect of pharmacological preconditioning of total flavones of abelmoschl manihot on cerebral ischemic reperfusion injury in rats[J]. The American journal of Chinese medicine, 2007, 35(04): 653-661.
[28] 郭岩, 陈志武. 黄蜀葵总黄酮对全脑缺血损伤的保护作用[J]. 中国药理学通报, 2002, 18(6): 692-695.
[29] 刘必全, 胡勇, 张建华, 等. 黄蜀葵花总黄酮对大鼠佐剂性关节炎的防治作用[J]. 中国临床康复, 2006, 10(35): 34-37.
[30] Fan Y F, Chen Z W, Guo Y, et al. Cellular mechanisms underlying Hyperin-induced relaxation of rat basilar artery[J]. Fitoterapia, 2011, 82(4): 626-631.
[31] Yan G, Li F, Liu Y D, et al. Effects of total flavone of Abelmoschl Manihot L. Medic on the function of platelets and its mechanism[J]. Chinese journal of integrative medicine, 2005, 11(1): 57-59.
[32] Liu Y, Lai X, Ling X, et al. Interactions between thrombin with flavonoids fromAbelmoschusmanihot(L.) medicus by CZE[J]. Chromatographia, 2006, 64(1-2): 45-50.
[33] Qiu Y, Song J, Wang S. Antioxidant Activity of Ablmoschus manihot Flower Ethanolic Extract and Its Inhibitory Effect on the Growth of Hela Cells[J]. Food Science, 2011, 19: 047.
[34] 范丽, 董六一. 黄蜀葵花总黄酮镇痛作用研究[J]. 中药药理与临床, 2003, 19(1): 12-14.
[35] An Y, Zhang Y, Li C, et al. Inhibitory effects of flavonoids fromAbelmoschusmanihotflowers on triglyceride accumulation in 3T3-L1 adipocytes[J]. Fitoterapia, 2011, 82(4): 595-600.
[36] Cheng X P, Qin S, Dong L Y, et al. Inhibitory effect of Total Flavone ofAbelmoschusmanihotL. Medic on NMDA receptor-mediated current in cultured rat hippocampal neurons[J]. Neuroscience research, 2006, 55(2): 142-145.
[37] lain Pritam S, Amol A T, Sanjay B B, et al. Analgesic Activity of Abelmoschus manihat Extracts[J]. International Journal of pharmacology, 2011, 7(6): 716-720.
[38] Puel C, Mathey J, Kati-Coulibaly S, et al. Preventive effect ofAbelmoschusmanihot(L.) Medik. on bone loss in the ovariectomised rats[J]. Journal of ethnopharmacology, 2005, 99(1): 55-60.

[40] 吴正平. 金花葵籽不饱和脂肪酸对实验性高脂血症大鼠血脂和肝功能的影响[J]. 中成药, 2011, 33(7): 1245-1247.
Advance Research on Chemical Constituents and Pharmacological Activities ofAbelmoschusmanihot(L.) Medic.
Wen Rui1,2, Xie Guoyong1,2, Li Xusen1,2, Qin Minjian1,2*
(1. Department of Resources Science of Traditional Chinese Medicines; 2. State Key Laboratory of Natural Medicines, China Pharmaceutical University, Nanjing 210009, China)
Abelmoschusmanihot(L.) Medic. belongs to Malvaceae. The chemical constituents in the plant are mainly flavonoids, organic acids, steroids and volatile compounds. It has a wide range of pharmacological activities, such as analgesic, anti-inflammory, anti-oxidant, hepatoprotective, renal protection, cardiovascular protection etc. Through a sysmatic literature review, the phytochemistry and pharmacological activities ofA.manihotare summarized. It will provide a certain scientific and theoretical basis for its further development.
Abelmoschusmanihot(L.) Medic.; Malvaceae;phytochemicals;pharmacological activity
2014-09-25
温锐,女,硕士研究生,从事生药学研究。E-mail: 0816wenrui@163.com
*通讯作者:秦民坚,男,教授,博士生导师,从事中药资源与开发研究。E-mail: minjianqin@163.com
10.3969/j.issn.1006-9690.2015.02.010
R284;R285
A
1006-9690(2015)02-0037-08
