无患子皂素无水乙醇提取工艺及提纯方法比较研究
2015-03-23杨鹤群菅红磊朱莉伟孙达峰张卫明蒋建新
杨鹤群,菅红磊,朱莉伟,孙达峰,张卫明,蒋建新*
(1.北京林业大学材料科学与技术学院,林业生物质材料与能源教育部工程中心,北京 100083;2.南京野生植物综合利用研究院,江苏 南京 210042)
无患子皂素无水乙醇提取工艺及提纯方法比较研究
杨鹤群1,菅红磊1,朱莉伟1,孙达峰2,张卫明2,蒋建新1*
(1.北京林业大学材料科学与技术学院,林业生物质材料与能源教育部工程中心,北京 100083;2.南京野生植物综合利用研究院,江苏 南京 210042)
采用无水乙醇对无患子果皮中的皂素进行提取分离。提取工艺研究表明,当固液比为1:6,在50 ℃,150 r/min摇床中提取6 h后,无患子皂素的得率为37.5%。通过向提取液中分别加入丙酮和无水乙醚可将皂素析出分离,皂素得率分别为17.9%和32.0%。丙酮析出分离出的皂素得率较低,但疏松洁白,颗粒较细,纯度为90.5%。无水乙醚析出分离的皂素颜色微黄,颗粒较大,纯度为84.7%,得率高达85.3%,是理想的无患子皂素提纯溶剂。
无患子皂素;提取;无水乙醇;提纯;丙酮;乙醚
无患子(SapindusmukurossiGaertn.)又名木患子、油患子、苦患树、黄目树等,属无患子科(Sapindaceae),为落叶大乔木,高可达20余米,树皮灰褐色或黑褐色,主要分布于我国东部、南部至西南部,各地寺庙、庭园和村边常见栽培。日本、朝鲜、中南半岛和印度等地也常栽培。核果肉质,果的发育分果爿近球形,直径2~2.5 cm,橙黄色,干时变黑。种子球形,黑色,坚硬。根和果入药,具有清热解毒、化痰止咳的功能;果皮中含有皂素,可代替肥皂作洗涤之用,尤宜于丝质品之洗涤;木材质软,边材黄白色,心材黄褐色,可做箱板和木梳等[1]。
无患子皂素为非离子型表面活性剂,具有很强的表面活性,由于其具备良好的去污能力和起泡性且对人体无毒害,可用于天然洗发香波及各种洗护品中[2-3]。皂素存在于很多植物中,有关皂苷抑菌作用的报道很多,彭茜等研究发现皂荚皂苷在较低的质量浓度(16~64 g/L)下对细菌的生长能起到一定的抑制作用,且抑菌活性与质量浓度呈正相关;茶皂苷在质量浓度为16 g/L的时候对啤酒酵母菌有杀灭作用[4]。研究表明,无患子皂素属于齐墩果烷型三萜皂素类[5-7],具有抗菌、杀菌和消炎功效,因此可被用于杀菌剂和杀虫剂[8-10]。此外,Upadhyay和Singh研究了无患子果粉的杀螺活性,结果表明无患子果粉的乙醇萃取物的杀螺活性远远要高于其他有机溶剂萃取物,并且证明了其中的杀螺有效成分为皂素和鞣酸[11]。Chen等的研究结果表明无患子种子提取物对黑色素瘤和肺细胞系的增殖扩散具有特异性抑制作用[12]。无患子皂素作为一种天然表面活性剂,还可以大大减弱木质素对纤维素酶的抑制作用,在高底物浓度条件下利用生物质发酵制备乙醇时起着重要作用[13]。
本文采用无水乙醇作为提取溶剂,对无患子果皮中皂素的提取及分离纯化工艺进行了研究,该工艺操作步骤简单,产品易于分离,为天然无患子皂素的开发利用提供了理论依据。
1 材料与方法
1.1 材料与仪器
无患子果,产地福建,剥壳及粉碎后过20目筛,得到无患子果皮粉,干燥密封保存。香草醛,浓硫酸,无水乙醇,无水乙醚,丙酮均为分析纯,主要仪器UV-2102C 型紫外可见分光光度计,尤尼科(上海)仪器有限公司。
1.2 实验方法
1.2.1 无患子皂素定量方法的建立
本实验中无患子皂素的定量采用香草醛-浓硫酸显色法[14]。香草醛-浓硫酸与皂苷反应形成特征的红色,是最广泛采用的皂素显色法,反应机理是使羧基脱水,增加双键结构,再经双键位移,双分子缩合反应生成共轭双键系统,又在酸作用下形成阳碳离子盐而显色。香草醛-浓硫酸显色剂是一种广谱性显色剂,很多物质如醇类、酚类、有机酸、挥发油、甾体、萜类等都可以显色。由于香草醛-浓硫酸显色剂并不是皂素的特异显色剂,乙醇和丙酮均可与香草醛-浓硫酸显色剂发生显色反应,而且显色比皂素明显,因此使用此方法定量,一定要保证操作的统一性,否则误差非常大。
1.2.1.1 溶液的配制
标准样品溶液:精确称取经干燥恒重的标准样品25 mg,溶解于体积浓度为50%乙醇中,置于25 mL容量瓶中定容,得到浓度为1 mg/mL的皂素标准溶液,摇匀备用。
香草醛溶液:0.8 g香草醛溶于10 mL无水乙醇,得到浓度为8 %的香草醛溶液。
硫酸溶液:77 mL质量分数95%硫酸加到23 mL去离子水中,得到体积浓度为77%的硫酸。
1.2.1.2 最大吸收波长的确定
取标准样品溶液0.5 mL,准确加入8%香草醛溶液0.5 mL,于冰水浴中加入77%硫酸液4 mL,摇匀,于60 ℃水浴加热15 min,然后置于冰水浴中冷却10 min,室温下以试剂为空白,用l cm比色皿在紫外-可见分光光度计上进行波长扫描,得出无患子皂素的最大吸收波长。
1.2.1.3 标准曲线的绘制
分别取标准样品溶液0.1、0.2、0.3、0.4、0.5 mL,置于具塞试管中,并加水至溶液体积为0.5 mL,按1.2.1.2中加入香草醛-浓硫酸显色剂反应后,在最大吸收波长下测定其吸光度,并以吸光度对浓度绘制标准曲线。
1.2.2 皂素的提取工艺
1.2.2.1 乙醇浓度的影响
称取约10 g的无患子果皮粉,以固液比1 ∶6分别加入浓度为0、45、75和100%的乙醇水溶液,在50 ℃,150 r/min摇床中提取6 h,使用香草醛-浓硫酸显色法测定提取液中的皂素含量。
1.2.2.2 固液比的影响
称取约10 g的无患子果皮粉,分别以固液比1 ∶2、1 ∶4、1 ∶6、1 ∶8、1 ∶10、1 ∶15加入无水乙醇,在50 ℃,150 r/min摇床中提取6 h,使用香草醛-浓硫酸显色法测定提取液中的皂素含量。
1.2.2.3 反应时间的影响
称取约10 g的无患子果皮粉,以固液比1:6加入60 mL无水乙醇,在50 ℃,150 r/min摇床中提取,反应过程中使用香草醛-浓硫酸显色法测定提取液中的皂素含量,得到皂素提取率随时间的变化曲线。
1.2.2.4 反应温度的影响
称取约10 g的无患子果皮粉,以固液比1 ∶6加入无水乙醇,分别在40、50、60和70 ℃,150 r/min摇床中提取6 h,使用香草醛-浓硫酸显色法测定提取液中的皂素含量。
1.2.3 皂素提纯
1.2.3.1 丙酮析出法
将上述无水乙醇提取液过滤除掉固体残渣后,分别加入1、2、3、5、10倍体积的丙酮,经3000 r/min离心15 min后,倒掉上清液,丙酮和乙醚依次洗涤,得到丙酮提纯皂素,80 ℃烘干后称重,计算得率。
1.2.3.2 无水乙醚析出法
将上述无水乙醇提取液过滤除掉固体残渣后,分别加入1、2、3、5、10倍体积的无水乙醚,经3000 r/min离心15 min后,倒掉上清液,乙醚洗涤,得到乙醚提纯皂素,80 ℃烘干后称重,计算得率。
2 结果与分析
2.1 无患子皂素定量方法的建立
如图1所示,无患子皂素与香草醛-浓硫酸反应后在459 nm处有最大吸收。在459 nm下测得无患子皂素的定量标准曲线(见图2),方程为y=1.030 8x-0.022 7,
式中:y—皂素经香草醛-浓硫酸显色后在459 nm下的吸光度;x—溶液中的皂素浓度,mg/mL。
皂素得率通过以下公式进行计算:
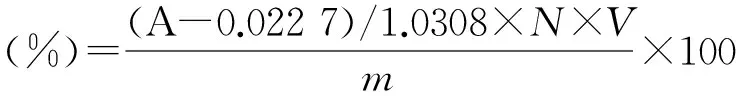
式中:A—吸光度;N—稀释倍数;V—样品溶液的总体积,mL;m—溶液中原料质量,mg。

图1 无患子皂素标准溶液的紫外吸收光谱图
2.2 无患子皂素的提取工艺
2.2.1 乙醇浓度对皂素得率的影响
如图3所示,皂素的得率随乙醇浓度的上升而下降,在水溶液中,无患子皂素的提取得率高达46.9%,而在无水乙醇中无患子皂素的得率为37.5%。乙醇浓度越低,皂素提取液的颜色越深,25%乙醇溶液和水的皂素提取液呈乳浊液状, 这可能是由于固体残渣在水中有润胀性,吸水后固体颗粒膨胀体积增大,在水中悬浮不会沉降下来。皂素提取液经过滤除去固体残渣后,分别加入5倍溶液体积的丙酮,只有无水乙醇提取液中的皂素可以沉淀析出,其他含水体系的皂素溶液在加入丙酮变为乳浊液状,无沉淀析出。无患子皂素中含有-COOH、糖苷键和多个-OH,属于中等极性至弱极性物质[15-16],强极性的水可将无患子果皮中的强极性物质如蛋白质、糖类、氨基酸、果胶等浸出,由此可得,虽然无患子皂素在水溶液中的提取得率较高,但是分离纯化较困难,所以选择无水乙醇作为无患子皂素的提取溶剂。

图2 无患子皂素定量标准曲线

图3 乙醇浓度对无患子皂素得率的影响
2.2.2 固液比对皂素得率的影响
如图4所示,皂素得率随固液比的增加而升高,当固液比增加至1 ∶6时,继续提高固液比对皂素得率的增幅不大。溶剂的用量越大,有效成分从固相传递到液相的推动力越大,传质速率愈快;当溶剂用量达到物料充分浸润时,继续增加溶剂用量对分离效果影响不大,因此确定固液比为1 ∶6。
2.2.3 提取时间对皂素得率的影响
如图5所示,皂素得率随提取时间的增加而升高,6小时后皂素得率增加不明显。增加提取时间有利于组分从固相扩散到液相,当提取时间达到一定值后萃取达到平衡,继续延长提取时间,无患子水提液中的生物碱、氨基酸、蛋白质、粘液质、鞣质、糖等杂质溶解量加大,反而不利于分离,因此确定提取时间为6h。

图4 固液比对无患子皂素得率的影响
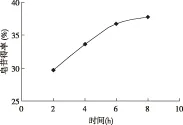
图5 提取时间对无患子皂素得率的影响
2.2.4 反应温度对皂素得率的影响
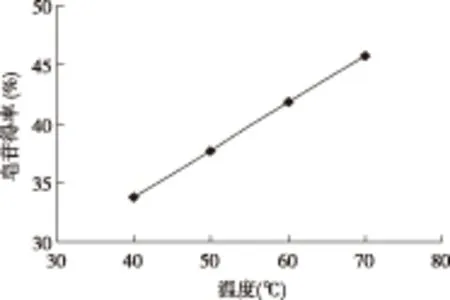
图6 提取温度对无患子皂素得率的影响
如图6所示,提取温度越高,皂素的得率越高,皂素得率与温度之间的关系接近线性。随提取温度升高,溶剂的粘度降低,这有利于组分的扩散,但与此同时,糖类、蛋白质、果胶等杂质会溶出,这将增加后处理分离的难度;若提取温度过高,无患子皂素将会发生水解变性,生成副产物,所以提取操作温度对分离效果的影响较大。另外,随提取温度升高,乙醇的挥发速率会增加,需要增加挥发溶剂的冷凝回收装置,因此选择在50 ℃下提取无患子皂素。
2.3 无患子皂素提纯
如图7所示,在皂素提取液中加入不同体积的丙酮或无水乙醚将皂素沉淀析出。随丙酮的加入量增加,沉淀颜色由淡黄变得洁白,当加入2倍体积的丙酮后,皂素沉淀得率最高可达17.9%,皂素纯度为90.5%,再继续提高丙酮的加入量,皂素得率反而出现下降趋势,这可能是因为丙酮加入量大于2倍溶液体积后,沉淀变得细微疏松,颜色洁白,皂素的纯度较高。随无水乙醚的加入量增加,皂素沉淀量增加,当加入10倍体积的无水乙醚时,皂素沉淀得率可达32.0%,而无水乙醇提取时香草醛-浓硫酸显色法测得的溶液中皂素得率为37.5%,因此无水乙醚对无患子皂素的沉淀率高达85.3%,所得皂素纯度为84.7%,是比较理想的皂素提纯分离方法。

图7 丙酮和无水乙醚对无患子皂素沉淀分离的影响
溶剂按极性排列为:乙醇>丙酮>乙醚,无患子皂素为中等极性至弱极性物质,根据相似相溶原理,在皂素的乙醇提取液中加入极性较弱的丙酮和非极性的乙醚后,由于皂素的溶解度下降而析出。非极性的无水乙醚会使皂素迅速沉淀析出,因此沉淀易结团,沉淀颗粒较大,呈微黄色,但是得率较高。加入极性较弱的丙酮后,会使部分中等极性的皂素析出,沉淀疏松洁白,呈絮状,但是得率较低,在加入过多丙酮后,体系会转变为乳状分散体。
3 结 论
本文对无患子皂素的提取提纯方法进行了研究。研究表明,水提取无患子皂素的得率较高,但是皂素在水溶液中分离困难,因此选用无水乙醇作为提取溶剂。在50 ℃、固液比1 ∶6、摇床转速150r/min条件下,用无水乙醇作为溶剂提取6h后,无患子皂素的得率为37.5%。无患子皂素从无水乙醇提取液中自然结晶困难,采用溶剂丙酮和无水乙醚将皂素沉淀析出可以得到纯度较高的皂素产品。当在皂素提取液中加入10倍体积的无水乙醚后,虽然所得沉淀颜色微黄,易结团,颗粒较大,皂素得率为32.0%,沉淀率高达85.3%,因此无水乙醚是比较理想的无患子皂素沉淀剂。丙酮沉淀出的皂素纯度较高,疏松洁白,颗粒较细,但是得率较低仅为17.9%。
[1] 中国植物志编辑委员会. 中国植物志:第47卷第1分册[M]. 北京: 科学出版社, 1998.
[2] 孙洁如, 陈孔常, 周鸣方, 等. 无患子表面活性物及其复配体系的性质研究[J]. 日用化学工业, 2002, 32( 4) :16- 18.
[3] 段纪东, 张鹏, 武士威, 等. 无患子提取物的泡沫性能研究[J]. 辽宁化工, 2007, 36(9): 595-597.
[4] 彭茜, 徐荣, 殷宁, 等. 皂荚皂苷与茶皂苷抗菌活性研究[J]. 林产化学与工业, 2009, S1:203-206.
[5] Kimata H, Nakashima T, Kokubun S, et al. Saponins of pericarps of Sapindus mukurossi Gaertn. and solubilization of monodesmosides by bisdesmosides [J]. Chemical & pharmaceutical bulletin, 1983, 31(6): 1998-2005.
[6] Azhar I, Usmanghani K, Perveen S, et al. Two triterpenoidal saponins from Sapindus mukorossi Gaertn. [J]. Pakistan Journal of Pharmaceutical Sciences, 1993, 6(2): 71-77.
[7] Huang H C, Wu M D, Tsai W J, et al. Triterpenoid saponins from the fruits and galls of Sapindus mukorossi [J]. Phytochemistry, 2008, 69(7): 1609-1616.
[8] Chopra R N, Badhwar R L, Nayar S L. Insecticidal and piscicidal plants of India [J]. Journal of the Bombay Natural History Society, 1941, 42: 854-902.
[9] Tamura Y. 无患子果皮中皂素的抗皮真菌活性[J]. 国外医学中医中药分册, 2004, 24( 5): 300-301.
[10] Ojha P, Maikhuri J P, Gupta G. Effect of spermicides onLactobacillusacidophilusin vitro-nonoxynol-9 vs. Sapindus saponins [J]. Contraception, 2003, 68: 135-138.
[11] Upadhyay A, Singh D K. Molluscicidal activity ofSapindusmukorossiandTerminaliachebulaagainst the freshwater snail Lymnaea acuminata [J]. Chemosphere, 2011, 83(4): 468-474.
[12] Chen C Y, Kuo P L, Chen Y H, et al. Tyrosinase inhibition, free radical scavenging, antimicroorganism and anticancer proliferation activities ofSapindusmukorossiextracts [J]. Journal of the Taiwan Institute of Chemical Engineers, 2010, 41(2): 129-135.
[13] Xing Y, Ji L, Liu Z P, et al. Effects of Gleditsia saponin on high-solids enzymatic hydrolysis of furfural residues[J]. Industrial Crops & Products, 2014.
[14] 侯如燕, 宛晓春, 黄继轸. 油茶皂素标准品的制备及定量方法的比较[J]. 食品与发酵工业, 2005, 31(8): 62-65.
[15] 饶厚曾, 郭隆华. 无患子皂素提取工艺研究[J]. 江西科学, 2002, 20(1): 55-58.
[16] 欧敏锐, 黄基才, 李兴淑, 等. 无患子皂素HLB值的化学计算[J]. 海峡药学, 2009, 21(2): 67-69.
Ethanol Extraction and Purification of Saponin fromSapindusmukurossiGaertn
Yang Hequn1, Jian Honglei1, Zhu Liwei1, Sun Dafeng2, Zhang Weiming2, Jiang Jianxin1,*
(1.College of Material Science and Technology, MOE Engineering Research Center of Forestry Biomass Materials and Bioenergy, Beijing Forestry University, Beijing 100083, China; 2.Nanjing Institute for Comprehensive Utilization of Wild Plants, Nanjing 210042, China)
The saponin was extracted fromSapindusmukurossiGaertn. using anhydrous ethanol as extraction solvent. The effects of temperature, solid-liquid ratio and time on extraction efficiency were investigated. The results showed that the optimal conditions for the extraction of saonin were temperature of 50 ℃, solid-liquid ratio of 1 ∶6 and time of 6 h. At the optimal conditions, the yield ofSapindusmukurossisaponin reached 37.5%. The isolation of saponin from the ethanol extraction was carried out by the addition of acetone or anhydrous ether, yielding 17.9% and 32.0% of sapindosides (on the basis of the weight of pericarps), respectively. The saponin precipitated by acetone with a purity of 90.5% were porous and fine-grained with white color, while the saponin obtained from anhydrous ether precipitation with a purity of 84.7% were yellowish with lager particle size. The precipitation rate of saponin from the ethanolic extract by anhydrous ether was 85.3%, which suggested the potential of anhydrous ether for the isolation of saponin.
Sapindusmukurossisaponin; extraction; anhydrous ethanol; purification; acetone; ether
2014-07-18
“十二五”国家科技支撑计划资助项目( 2012BAD36B01);大学生创新计划(X201410022049);国家林业局重点资助项目( 2012-03)。
杨鹤群(1994-),女,梁希实验班,本科在读,研究方向:天然产物化学。
10.3969/j.issn.1006-9690.2015.02.001
TQ423
A
1006-9690(2015)02-0001-04
*通讯作者:蒋建新,教授,博士研究生导师。主要研究方向:林产化工及生物燃料化学品。
