日粮不同蛋白质水平对绵羊IGF-1和GH分泌及基因表达的影响
2015-03-22闫云峰杨永林潘晓亮邹云龙
闫云峰,杨 华,杨永林,潘晓亮,邹云龙
(1.新疆农垦科学院 兵团绵羊繁育生物技术重点实验室,石河子 832000;2.石河子大学动物科技学院,石河子 832001; 3.西北民族大学生命科学与工程学院,兰州 730000)
日粮不同蛋白质水平对绵羊IGF-1和GH分泌及基因表达的影响
闫云峰1,2,杨 华1*,杨永林1,潘晓亮2,邹云龙3
(1.新疆农垦科学院 兵团绵羊繁育生物技术重点实验室,石河子 832000;2.石河子大学动物科技学院,石河子 832001; 3.西北民族大学生命科学与工程学院,兰州 730000)
本研究旨在探讨不同蛋白质水平日粮对绵羊胰岛素样生长因子-1(IGF-1)和生长激素(GH)分泌及基因mRNA表达量的影响,为科学配置肉羊饲料及研究肉羊生长发育提供基础。选择6月龄体重相近的多胎萨福克公羔18只,随机分为3组,分别饲喂不同蛋白质水平的日粮(低蛋白日粮、中蛋白日粮和高蛋白日粮)。采用ELISA方法和SYBR Green Real-time PCR方法检测日粮不同蛋白质水平对不同生长发育阶段(30、60 、90 和120 d)羔羊外周血中IGF-1、GH浓度和皮肤组织中基因表达的影响。结果显示,日粮蛋白质水平显著影响绵羊平均日增重、外周血中IGF-1和GH的浓度以及皮肤组织IGF-1基因的表达丰度,而未显著影响GH基因的表达丰度。结果提示,随着日粮蛋白质水平的升高,绵羊生长发育快,外周血中IGF-1浓度增加,GH浓度降低,IGF-1基因表达量增加。
绵羊;蛋白水平;IGF-1;GH;分泌;基因表达
动物的生长发育受神经内分泌生长轴的调控,即“下丘脑-垂体-靶器官”途径,胰岛素生长因子(Insulin-like growth factor-1,IGF-1)和生长激素(Growth hormone,GH)处于生长轴的中心环节,对动物生长发育起着重要的调控作用[1-2]。IGF-1也称生长介素,是一种含有70个氨基酸的细胞增殖调控因子,由肝和骨髓基质细胞分泌,动物体内约90% 的IGF-1来源于肝,其主要通过GH对GHR作用而使IGF-1进入血液[3],促进骨骼增长、加速蛋白质合成和降解脂肪[4]。GH 也称促生长激素,由垂体嗜酸性细胞产生,是动物垂体前叶合成和分泌的具有种属特异性的一种单链多肽激素,普遍存在于各种脊椎动物中[5]。GH有两种作用方式:一是作用于靶器官上的相应受体,产生的IGF-I以内分泌的方式进入循环血液,通过与结合蛋白(IGFBPs)结合最终对动物的生长发育发挥调节作用。二是GH直接作用于靶器官相应受体,通过自分泌或者旁分泌IGFs,或直接影响细胞代谢而对动物器官的生长发育进行调节。研究表明GH和IGF-1基因在绵羊多种组织中广泛表达,其中在皮肤组织中呈中丰度表达[6-8]。
营养物质对动物体的某些基因表达起着重要的调控作用,其作用主要发生在转录或翻译前水平,而对翻译后的影响较小。大多数的研究主要以猪、鸡和大鼠为研究对象,以绵羊为研究对象的试验较少,营养物质影响基因表达及分泌是否存在种属特异性值得探究。本试验以新疆农垦科学院培育的多胎萨福克新品系为试验材料,采用ELISA方法分析日粮不同蛋白质水平影响绵羊外周血中IGF-1和GH的分泌,应用实时荧光定量PCR方法分析日粮不同蛋白质水平影响绵羊IGF-1和GH基因表达,旨在探讨营养物质与内分泌及生长轴基因表达的关系,为肉羊新品系培育和高效养殖提供依据。
1 材料与方法
1.1 试验动物及日粮
选用新疆农垦科学院种羊场 6月龄生长发育正常、平均体重33.65 kg的多胎萨福克公羔18只(P>0.05),按照中国肉羊饲养标准(NY/T816-2004)设计日粮,采用单因子试验设计,随机分为3组(15%为低蛋白组;18%为中蛋白组;21%为高蛋白组),每组均以6只羔羊为研究对象,各组除日粮蛋白质水平不同外,能量及其他营养指标基本保持一致。根据新疆当地饲养绵羊的主要饲料成分及营养价值得出饲料配方及营养水平见表1。
1.2 样品采集
每组羔羊单独舍饲,每天饲喂 2 次,自由饮水,羔羊经预饲期7 d,试验期120 d,分为0、30、60、90和120 d 5个时间点,采样当天于清晨08:00称量空腹状态下的羔羊体重,并采集颈静脉血液2 mL及体侧部皮肤组织。静脉血于4 ℃静置1 h,900×g离心15 min,分离血清,取上清分装,-20 ℃冻存;从低蛋白组、中蛋白组和高蛋白组中各随机选取3只羔羊,在5个时间点采集每只羔羊的皮肤组织样本,皮肤组织立即放入液氮中速冻,-80 ℃冰箱中保存备用。
1.3 主要仪器与试剂
酶标仪(Model 550,美国Bio-Rad公司)、实时荧光定量PCR仪(Light Cycler 2.0,美国Roche公司),Precellys 24 组织匀质器(法国Bertin公司),微量紫外可见分光光度计(NanoPhotometer,德国Implen公司)。
绵羊GH、IGF-1的ELISA检测试剂盒购自上海蓝基生物科技有限公司,E.Z.N.A.TMTotal RNA KitⅠ购自美国Omega生物技术公司,Primer ScriptTMRT reagent Kit with gDNA Eraser购自宝生物工程(大连)有限公司、FastStar DNA Master SYBR Green I购自美国Roche生物科技公司。
1.4 试验方法
1.4.1 绵羊外周血中IGF-1、GH的ELISA检测 取分装5个时间点的羔羊血清,共计90份,根据ELISA检测试剂盒说明书进行绵羊外周血中IGF-1和GH浓度的测定。
1.4.2 绵羊IGF-1和GH基因的引物设计 以3-磷酸甘油醛脱氢酶基因(Glyceraldehyde-3-phosphate dehydrogease,GAPDH)作为持家基因,从GenBank数据库检索绵羊IGF-1(NM-001009774)、GH(NM-001009315)mRNA序列,用Primer premier 5.0软件设计定量PCR引物,GAPDH引物参考杨华等[9]报道的序列,引物序列见表2,由上海立菲生物技术有限公司合成。
表1 日粮组成与营养水平(干物质,%)
Table 1 Compositions and nutrient levels in diet (air dry basis,%)

项目Item低蛋白组Lowproteingroup中蛋白组Mediumproteingroup高蛋白组Highproteingroup日粮组成Ingredient玉米Corn26.010.00.0苜蓿干草Alfalfa30.025.050.0棉籽壳Cottonshell32.027.013.0番茄渣Tomatopomace10.020.010.0食盐Salt0.50.50.5精料补充料Feedsupplement0.016.025.0石粉Limestone1.01.01.0缓冲剂Bufferingagent0.50.50.5合计Total100.0100.0100.0营养水平Nutrientlevel消化能/(MJ·kg-1)DE15.215.015.4粗蛋白质/(g·kg-1)CP150.0180.0210.0钙/(g·kg-1)Ca4.14.24.3总磷/(g·kg-1)TP2.02.02.1
营养水平除代谢能、钙、磷为计算值外均为实测值
The nutrient levels are measured values,except ME,calcium and phosphorus are calculated values
表2IGF-1、GH和GAPDH引物参数
Table 2 Parameters of oligo-nucleotide primer pairs for theIGF-1,GHandGAPDH
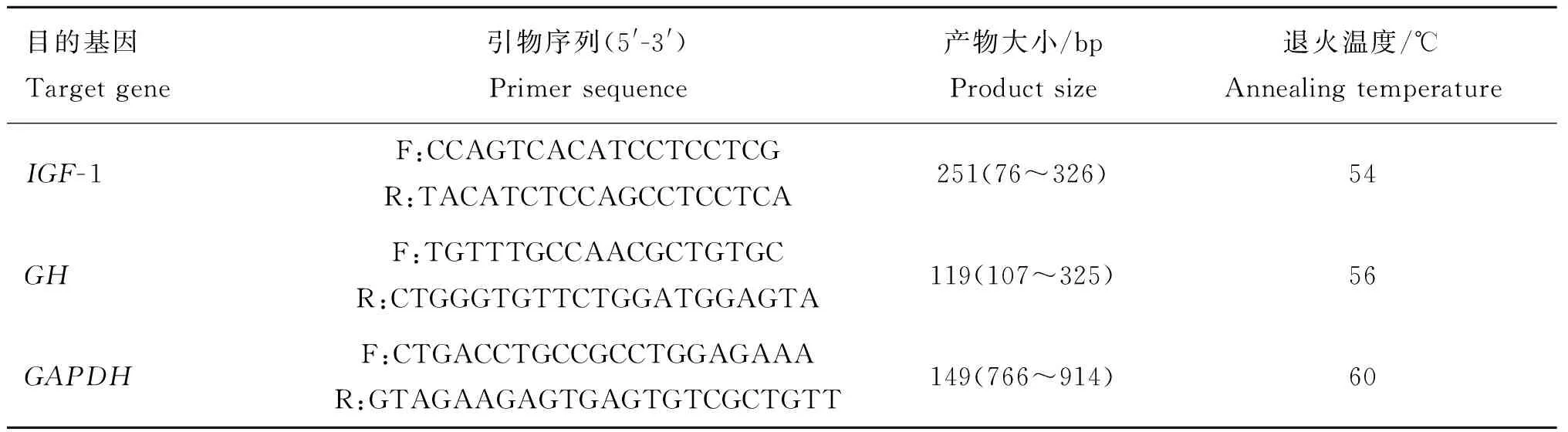
目的基因Targetgene引物序列(5'-3')Primersequence产物大小/bpProductsize退火温度/℃AnnealingtemperatureIGF-1F:CCAGTCACATCCTCCTCGR:TACATCTCCAGCCTCCTCA251(76~326)54GHF:TGTTTGCCAACGCTGTGCR:CTGGGTGTTCTGGATGGAGTA119(107~325)56GAPDHF:CTGACCTGCCGCCTGGAGAAAR:GTAGAAGAGTGAGTGTCGCTGTT149(766~914)60
1.4.3 总RNA提取 皮肤组织总RNA提取按照E.Z.N.A.TMTotal RNA KitⅠ试剂盒说明书,用微量紫外可见分光光度计测定总RNA浓度和纯度,并用1.0%琼脂糖凝胶电泳检测总RNA的质量。
1.4.4 RT-PCR 按照Primer ScriptTMRT reagent Kit with gDNA Eraser试剂盒说明书对总RNA进行反转录。GAPDH、IGF-1和GH基因的PCR反应体系为25 μL,包括1.5 μL cDNA模板,12.5 μL 2×EasyTaq PCR SuperMix,上游和下游引物(10 μmol·L-1)各1 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,退火温度退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。
1.4.5 PCR 产物克隆及序列分析GAPDH、IGF-1和GH基因RT-PCR产物应用天根生化科技(北京)有限公司胶回收试剂盒进行纯化,按照宝生物工程(大连)有限公司pMD18-T Vector Cloning Kit操作说明将目的基因与pMD18-T载体连接,转化入DH5α感受态细胞,挑选单个白色菌落进行PCR鉴定,阳性重组质粒的菌液送上海立菲生物技术有限公司测序,测序后的序列应用DNAMAN6.0软件和BLAST进行同源性分析。
1.4.6IGF-1和GH基因荧光定量分析 通过测序分析验证引物扩增片段为目的基因片段,应用FastStar DNA Master SYBR Green I试剂盒对各组绵羊皮肤组织cDNA进行IGF-1和GH基因的荧光定量分析。将含有GAPDH、IGF-1和GH基因片段的质粒用双蒸水以10倍梯度连续稀释,即100、101、102、103,得到荧光定量PCR标准品,每个基因4个梯度,制作荧光定量PCR标准曲线。
荧光定量PCR反应体系为20 μL,其组成为2 μL RT产物,2.4 μL MgCl2(3 mmol·L-1),目的基因引物(10 μmol·L-1)各1 μL,2 μL FastStar DNA Master SYBR Green I(10×),补加ddH2O至终体积。反应程序:95 ℃ 预变性10 min;95 ℃ 变性10 s,退火温度退火10 s,72 ℃ 延伸10 s,45个循环;72 ℃ 延伸5 min。熔解曲线用于检验扩增产物的特异性,其反应程序:95 ℃ 0 s;65 ℃ 15 s;95 ℃ 0 s(温度变化速率为0.1 ℃·s-1)。5个时间点每组3只羔羊的所有样品进行3次平行检测,并在每批次荧光定量PCR反应时设阴性对照,记录各样品的Ct值。
1.4.7 数据分析 采用2-△△Ct方法[10]分析GH和IGF-1基因相对表达量,应用SPSS 19.0统计分析各试验组羔羊的平均日增重、GH和IGF-1基因相对表达量及外周血中GH和IGF-1浓度数据。采用数学模型:yij=μy+αi+β(xij-μx)+eij进行单因素协方差分析,其中,αi为第i种饲料蛋白含量固定效应,xij为个体体重,μy为基因相对表达量均值或浓度均值;μx为体重均值;β为y随x变化的回归系数;eij为随机误差。各饲养阶段的羔羊平均日增重、基因相对表达量及浓度均以“平均值±标准差”表示,并用Duncan对各组平均数进行显著性检验。
2 结 果
2.1 不同蛋白质水平日粮对绵羊平均日增重的影响
从表3结果可见,整个饲养期间,3个试验组羔羊随着饲养天数的增加体重增加,低蛋白组、中蛋白组和高蛋白组平均日增重依次187.50、220.83和251.33 g·d-1,60~120 d高蛋白组羔羊平均体重显著高于低蛋白组(P<0.05),0~120 d高蛋白组平均日增重显著高于低蛋白组63.83 g·d-1(P<0.05),料肉比优于低蛋白组,虽然3组间料肉比无显著差异,但高蛋白组较低蛋白组更具有潜在的生长优势。饲养期间羔羊增重所消耗的饲料总量即料肉比以高蛋白组最低,中蛋白组次之,低蛋白组最高,表明日粮蛋白水平越高,羔羊的增重越快,饲料报酬越高。说明日粮中蛋白水平能够影响羔羊增重效果,供给合适的高蛋白水平日粮可促进羔羊快速生长。
2.2 不同蛋白质水平日粮对绵羊外周血中IGF-1和GH含量的影响2.2.1 不同蛋白质水平日粮对绵羊外周血中IGF-1含量的影响 经ELISA检测分析,绵羊外周血中IGF-1浓度标准曲线(y=-0.494 4x+3.094 5,R2=0.972 6)的相关系数R2大于0.97,结果良好,可以进行后续试验。单因素协方差分析可见(表4),整个饲养期间,各试验组均以饲养0 d时水平为基线(P>0.05),低蛋白组IGF-1含量在饲养0~90 d呈下降趋势,但在饲养120 d表现上升趋势,总体水平较0 d时含量下降;中蛋白组IGF-1含量在饲养0~120 d呈上升趋势;高蛋白组IGF-1含量在饲养30 d上升较快,之后变化波动较小,呈平稳上升趋势。各试验组羔羊外周血中IGF-1在0 d时含量均无显著差异(P>0.05);60~120 d高蛋白组IGF-1含量均显著高于低蛋白组(P<0.05),2组与中蛋白组差异均不显著(P>0.05),与羔羊0~120 d的生长发育一致。说明绵羊生长发育过程中,日粮蛋白水平和外周血中IGF-1含量呈正相关,随着蛋白水平的增加,外周血中IGF-1含量也相应增加。
2.2.2 不同蛋白质水平日粮对绵羊外周血中GH含量的影响 经ELISA检测分析,绵羊外周血中GH浓度标准曲线(y=-0.428 5x+2.668 2,R2=0.991 3)的相关系数R2大于0.99,结果良好,可以进行后续试验。单因素协方差分析可见(表4),整个饲养期间,各试验组均以饲养0 d时水平为基线(P>0.05),低蛋白组GH含量在饲养0~120 d呈平稳上升趋势;中蛋白组GH含量在饲养0~120 d 呈下降趋势;高蛋白组GH含量以饲养0 d时水平最高,为1.59 ng·mL-1,饲养期间GH含量呈下降趋势。在饲养60 d时,低蛋白组GH含量达到最高,为2.48 ng·mL-1,中蛋白组和高蛋白组GH最高含量为饲养0 d时含量,即1.74和1.59 ng·mL-1;饲养90 d的低蛋白组GH含量显著高于高蛋白组(P<0.05);饲养120 d的低蛋白组GH含量显著高于中蛋白组和高蛋白组(P<0.05)。说明绵羊生长发育过程中,日粮蛋白水平和外周血中GH含量呈负相关,随着蛋白水平的增加,外周血中GH含量降低。
表3 不同蛋白水平条件绵羊平均日增重、料肉比的变化分析
Table 3 The analysis of average daily gain and efficiency feed utilization under different protein levels
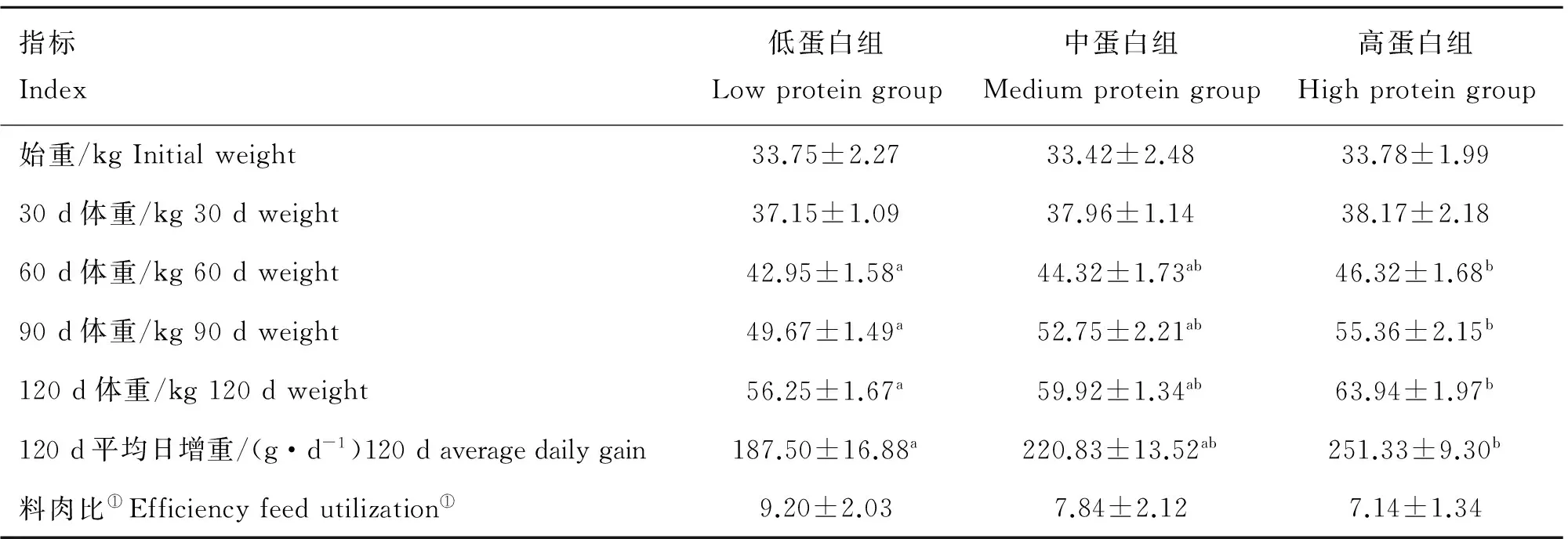
指标Index低蛋白组Lowproteingroup中蛋白组Mediumproteingroup高蛋白组Highproteingroup始重/kgInitialweight33.75±2.2733.42±2.4833.78±1.9930d体重/kg30dweight37.15±1.0937.96±1.1438.17±2.1860d体重/kg60dweight42.95±1.58a44.32±1.73ab46.32±1.68b90d体重/kg90dweight49.67±1.49a52.75±2.21ab55.36±2.15b120d体重/kg120dweight56.25±1.67a59.92±1.34ab63.94±1.97b120d平均日增重/(g·d-1)120daveragedailygain187.50±16.88a220.83±13.52ab251.33±9.30b料肉比①Efficiencyfeedutilization①9.20±2.037.84±2.127.14±1.34
同行不同小写字母表示差异显著(P<0.05),下表同。①.饲料为TMR混合日粮
Values with different lowercase letter in the same row indicate significant difference(P<0.05).The same as below.①.Feed for the total mixed ration
表4 不同蛋白质水平条件下IGF-1和GH的含量变化
Table 4 The analysis of IGF-1 and GH concentrations change under different protein levels
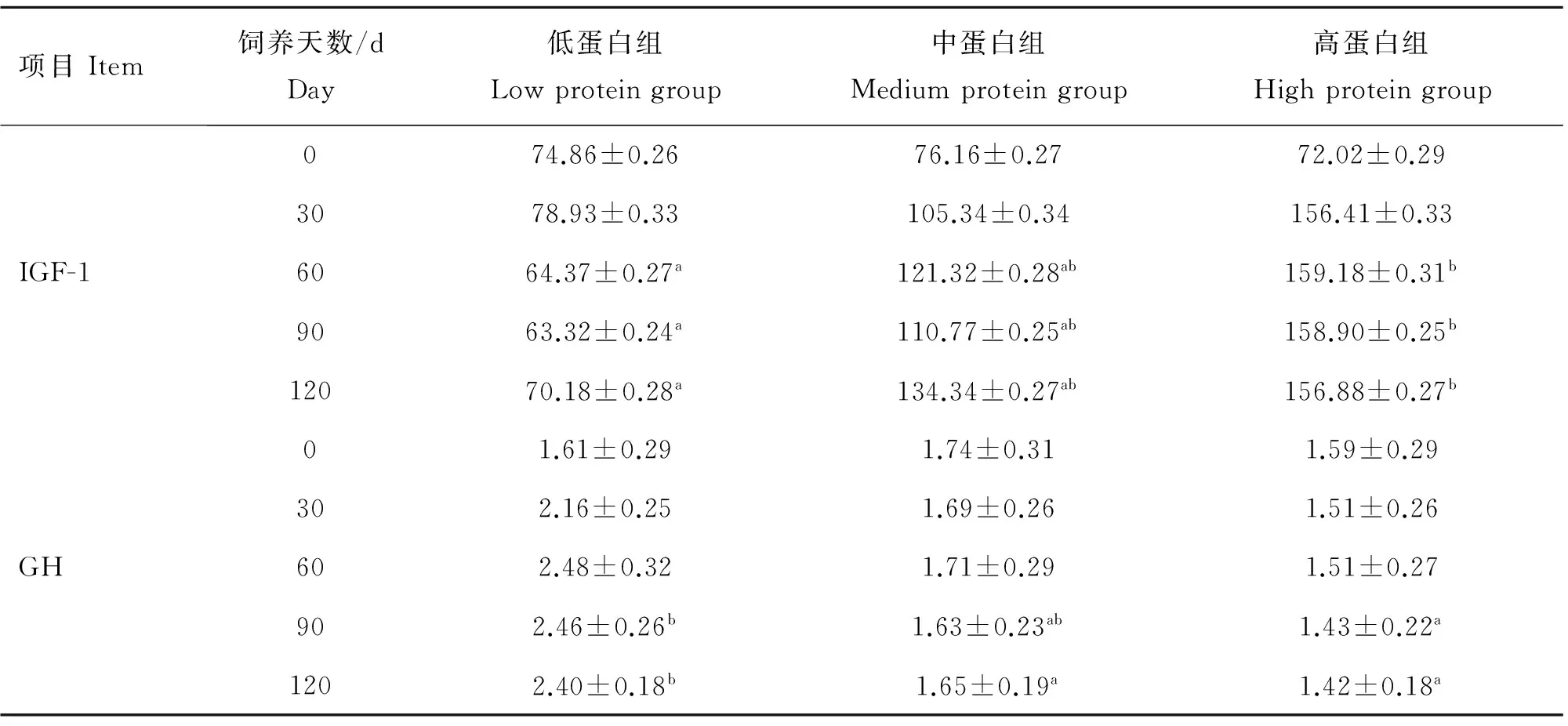
ng·mL-1
2.3 不同蛋白质水平日粮对绵羊IGF-1和GH基因表达的影响
2.3.1 RNA电泳结果 总RNA经1.0%琼脂糖凝胶电泳检测结果(图1)表明,28S和18S两条带清晰,灰度比值接近2∶1,且OD260 nm/OD280 nm比值为1.8~2.0,证明所提取的 RNA 结构完整,可用于下一步合成cDNA。

图1 总RNA琼脂糖凝胶电泳检测Fig.1 The agarose gel electrophoresis of total RNA
2.3.2 目的基因PCR扩增结果及序列分析 以绵羊cDNA 为模板,以IGF-1、GH和GAPDH基因引物分别进行 PCR 扩增,目的基因片段的长度分别为 251、119和149 bp,经2.0%琼脂糖凝胶电泳检测,与预期结果一致(图2)。经序列测定和序列分析,证明所克隆的基因分别为IGF-1、GH和GAPDH基因片段。
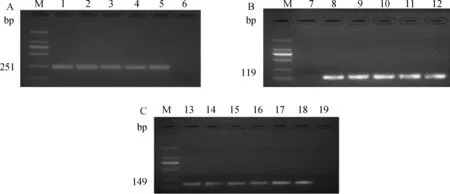
1~5.IGF-1基因PCR产物; 8~12.GH基因PCR产物; 13~18.GAPDH基因PCR产物;M.DNA相对分子质量标准DL2000;6,7,19.空白1-5.IGF-1; 8-12.GH; 13-18.GAPDH; M.DL2000 marker;6,7,19.Control图2 绵羊IGF-1、GH和GAPDH基因的RT-PCR电泳图Fig.2 RT-PCR of IGF-1,GH and GAPDH gene of sheep
2.3.3IGF-1和GH基因荧光定量PCR检测 通过熔解曲线分析,发现IGF-1基因在90 ℃ (图3),GH基因在87 ℃ (图4),GAPDH基因在90 ℃(图5),均为单一峰,3个基因扩增时均无非特异性PCR产物、引物二聚体和污染的存在,表明其被特异扩增。通过实时荧光定量PCR,获得了S型动力学曲线图。每个基因的指数扩增期和平台期都比较明显,从11~32个循环均能检测出,线性范围较广,扩增曲线较理想,表明此次实时荧光定量PCR试验数据能够用于目的基因的相对定量分析。
2.3.3.1IGF-1基因的相对表达量分析:经单因素协方差分析可见(表5),整个饲养期间,各试验组均以饲养0 d时IGF-1基因相对表达量水平为基线(P>0.05),低蛋白组IGF-1基因相对表达量随饲养天数增加而呈下降趋势,在饲养90 d时其表达量维持稳定;中蛋白组IGF-1基因相对表达量较为平稳,总体呈上升趋势;高蛋白组IGF-1基因相对表达量随饲养天数增加呈上升趋势。在饲养60和120 d时,高蛋白组IGF-1基因相对表达量显著高于中蛋白组和低蛋白组(P<0.05)。说明绵羊生长发育过程中,日粮蛋白水平和IGF-1基因的表达量呈正相关,随着蛋白水平的增加,IGF-1基因的表达丰度增加。

图3 IGF-1基因的扩增曲线与熔解曲线Fig.3 The amplification and dissociation curves of IGF-1 gene

图4 GH基因的扩增曲线与熔解曲线图 Fig.4 The amplification and dissociation curves of GH gene

图5 GAPDH基因的扩增曲线与熔解曲线Fig.5 The amplification and dissociation curves of GAPDH gene
2.3.3.2GH基因的相对表达量分析:经单因素协方差分析可见(表5),整个饲养期间,各试验组均以饲养0 d时GH基因相对表达量水平为基线(P>0.05),低蛋白组、中蛋白组和高蛋白组GH基因相对表达量较为平稳;整个饲养期间3个试验组GH基因表达量都没有显著变化(P>0.05)。低蛋白组GH基因相对表达量在饲养120 d最高,达到1.42;中蛋白组GH基因相对表达量在饲养60 d最高,为1.45;而高蛋白组则以饲养0 d时GH基因相对表达量最高。绵羊生长发育过程中,日粮蛋白水平没有显著影响GH基因的表达丰度。
3 讨 论
近年来,随着分子生物学的不断发展,人们已认识到作为外部因子的营养物质与基因表达之间存在着广泛的互作,这种互作是动物体内、外因子互作的一个重要方面。研究表明,日粮中主要营养物质如碳水化合物、蛋白质、氨基酸和脂肪对动物体内许多基因,如猪生长激素受体(GHR)[11]、绵羊IGF-1[12]、人IGFBP-1[13]等的表达都有影响。营养与基因表达调控已成为当今动物营养学的研究热点之一,如何通过改变日粮组成调节体内相关基因的表达,从而使动物体处于最佳生长状态已成为动物营养学研究的重点。
3.1 不同蛋白质水平日粮对绵羊外周血中IGF-1和GH含量的影响
动物生长是一个极其复杂的过程,受营养水平、遗传、内分泌调节、环境及饲养管理等众多因素影响,其中,营养水平、环境及饲养管理等外在因素最终是通过体内神经内分泌激素的变化而影响动物的生长发育。研究证实,猪[14]和牛[15]等动物血液中IGF-1含量与体重及增重呈正相关。李光玉等[16]报道日粮中消化蛋白质与梅花鹿和东北马鹿外周血中IGF-1 含量呈显著正相关(P<0.05),与血清GH浓度无显著相关(P>0.05);张勇等[17]也指出日粮中蛋白质水平的提高能够增加猪血液中IGF-1的含量。当营养不良时,导致血液中GH分泌增加,肝中生长激素受体(GHR)和血液IGF-1的含量降低[18]。本研究发现,中蛋白组和高蛋白组IGF-1含量及日增重随日龄增加而表现上升趋势,但高蛋白组IGF-1含量和平均日增重要高于中蛋白组,差异不显著(P>0.05);低蛋白组0~120 d平均日增重则低于高蛋白组(P<0.05)和中蛋白组,且IGF-1含量表现出降低趋势。在0~120 d饲养期,外周血中IGF-1含量变化趋势与羔羊的生长发育趋势一致。研究结果与J.M.Pell等[12]结论一致,证明了日粮蛋白水平和绵羊外周血中IGF-1含量呈正相关,日粮蛋白水平的增加,导致外周血中IGF-1含量也相应增加。
表5 不同蛋白水平IGF-1和GH基因表达量变化
Table 5 The relative express analysis ofIGF-1 andGHgenes under different protein levels
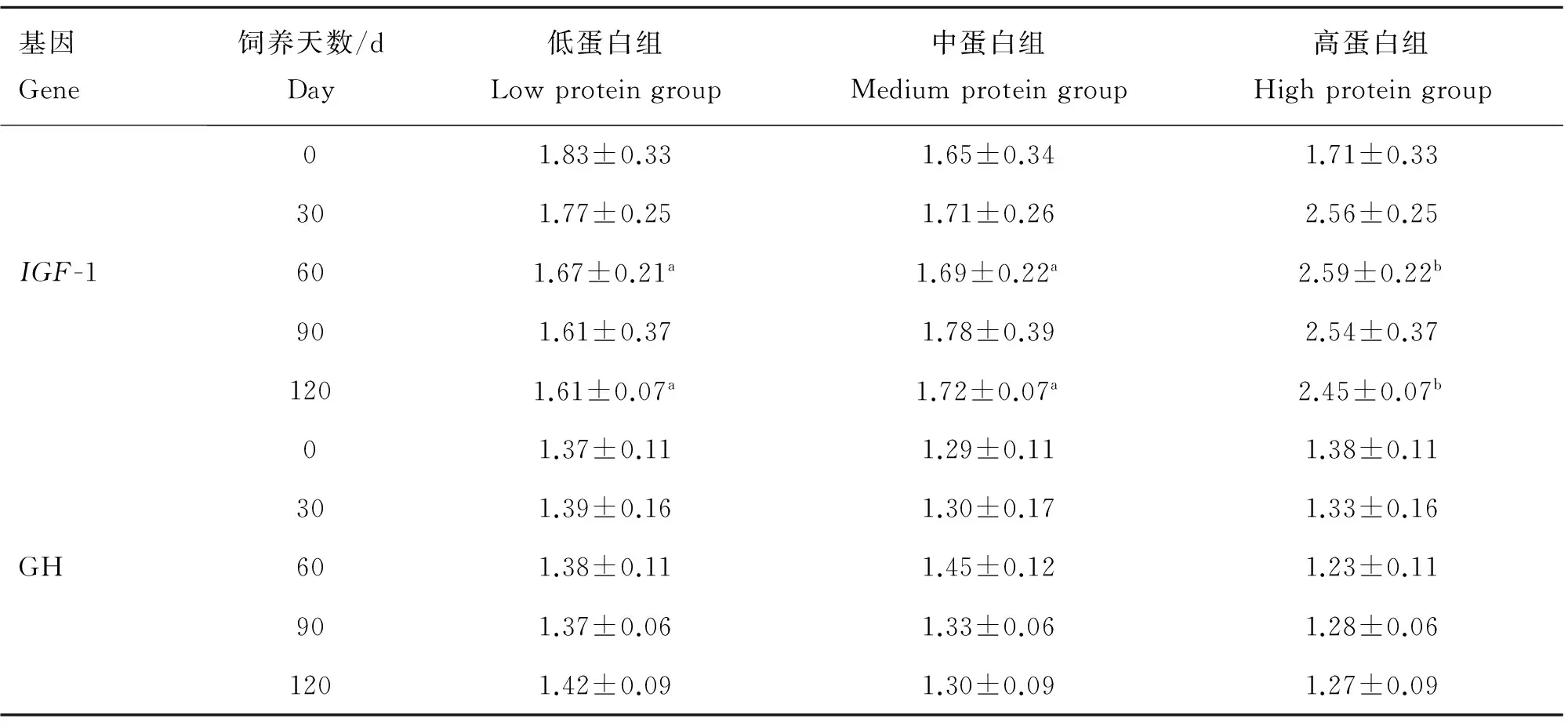
基因Gene饲养天数/dDay低蛋白组Lowproteingroup中蛋白组Mediumproteingroup高蛋白组HighproteingroupIGF-101.83±0.331.65±0.341.71±0.33301.77±0.251.71±0.262.56±0.25601.67±0.21a1.69±0.22a2.59±0.22b901.61±0.371.78±0.392.54±0.371201.61±0.07a1.72±0.07a2.45±0.07bGH01.37±0.111.29±0.111.38±0.11301.39±0.161.30±0.171.33±0.16601.38±0.111.45±0.121.23±0.11901.37±0.061.33±0.061.28±0.061201.42±0.091.30±0.091.27±0.09
研究表明,动物的促生长效应主要依赖 GH 刺激产生IGF-1,IGF-1再作用于靶细胞而发挥作用。而GH的合成与分泌受生长激素释放激素(GHRH)和生长激素释放抑制激素(SS)的双重控制,GHRH 除促进分泌GH 外,还可以增加细胞内的mRNA;SS能抑制GHRH 的合成产生,与GHRH 共同调节GH。J.N.Mao等[19]试验证明生长速度慢的肉鸡,其血液中GH含量较生长速度快的要高。P.J.Godowski等[20]证明患有Laron型侏儒症的病人,其血液中GH水平要高于正常人,但比正常人的IGF-1水平要低。赵茹茜等[21]也在伴性侏儒鸡上发现类似的情况。本研究证明,绵羊生长发育中,日粮蛋白水平和外周血中GH含量呈负相关,蛋白水平的增加导致外周血中GH含量降低。针对绵羊的研究结果与鸡和哺乳动物的结论相同,营养状况影响外周血中IGF-1和GH浓度,动物营养不良导致的生长受阻,其血液中GH水平往往是升高而并非下降,而血液中IGF-1含量降低。
从本试验结果可见,IGF-1和GH含量在各个饲养阶段表现出负反馈调节,在高蛋白组和低蛋白组尤其明显,这也说明羔羊在应对各种不同蛋白水平的应激时,垂体中GH会刺激肝脏中IGF-1的合成和分泌,随后扩散到机体各个组织中,其通过抑制肝糖释出,增加葡萄糖摄取和转化,抑制脂肪分解,促进脂质和糖原及蛋白质的合成而调节羔羊的生长。与中蛋白组相比,高蛋白组羔羊IGF-1含量增加,其GH合成和分泌就会受到抑制,从而形成一个负反馈调节回路[22],使动物的生理水平维持在一个相对稳定状态。尽管GH控制着IGF-1的水平,但血液中IGF-1的水平也受其他因素的调控,如甲状腺和胰岛素等激素也能够调节GH的合成,从而调节IGF-1的分泌。同时,机体组织本身也可以产生IGF-1,或IGF-1可通过自分泌以一种局部生长因子促进细胞增殖,增加动物体重[23]。
3.2 不同蛋白质水平日粮对绵羊IGF-1和GH基因表达的影响
动物的生长发育是由多个基因控制、整合的一个极其复杂的生理调节过程。营养对基因表达主要是通过营养物质的成分和摄入量影响蛋白质合成来进行调控;其次是基因表达后其能够对动物代谢产生作用,重新分配动物生长需要的物质。一般认为营养不良时,因肝中GH受体基因表达丰度的下降致使IGF-1基因的表达下降,但蛋白质和能量的作用机制有所不同。J.M.Brameld等[24]认为,蛋白质对IGF-1基因的表达主要以氨基酸的形式调控,而能量则主要以葡萄糖的形式调控GH受体基因的表达,进而影响IGF-1基因的表达。
不同学者先后报道,用低蛋白质或无蛋白质的日粮饲喂小鼠,其肝中IGF-1 mRNA 的表达量呈明显的下降趋势[25-26]。此外,在蛋白质和能量比例不同的日粮下,绵羊肝IGF-1 mRNA 的表达量也存在同样的结果,表明IGF-I基因的转录水平与营养不良密切相关[27]。研究表明,猪的IGF-1 mRNA的表达量在猪脂肪组织中随着蛋白质水平的升高而增加,营养不良直接抑制IGF-1基因表达,其主要原因是GH作用受阻[11]。本研究通过荧光定量PCR分析GH和IGF-1基因的相对表达量,结果表明,日粮中蛋白质水平对IGF-1 mRNA 表达量存在显著的影响,其中低蛋白组IGF-1 mRNA表达量较试验的饲养0 d时IGF-1表达量水平有所下降,在60和120 d低蛋白组与中蛋白组的IGF-1表达量均显著低于高蛋白组(P<0.05),这也预示着羔羊营养供给匮乏时,生长发育受到限制,随着日粮蛋白质水平的降低,绵羊IGF-1 mRNA表达呈下降趋势,该规律与刘景云等[28]和张玲等[29]的研究结果相同,同样,当日粮中蛋白质水平增加时,IGF-1 mRNA表达有上升的趋势。
GH基因表达受到生长发育相关基因的双向调控。赵茹茜等[30]报道,蛋鸡cGHmRNA随营养限制其表达量升高,相反,过度摄取营养则cGHmRNA表现下降。周其伟等[31]研究表明,羔羊GHRHR基因表达可能影响GH基因表达,且GHmRNA基因有先升高再下降的表达变化模式。本研究结果发现低蛋白组GHmRNA基因表达量高于高蛋白组,但差异不显著(P>0.05),与赵茹茜等[30]结论一致。针对绵羊不同饲养阶段GHmRNA表达规律,低蛋白组GHmRNA表达呈上升趋势,高蛋白组则呈下降趋势,该结论与R.Q.Zhao等[32]在鸡研究中的结果一致。众所周知,GH首先与细胞表面特异性受体(GHR)结合形成配体受体复合物,再由受体介导激发一系列生化反应,最终启动GH的目标基因(IGF-1)转录;而外周血中GH分泌和合成受GHRH和SS的调节,GHRH、SS和GHR调控作用在生长发育中可能并不协同,是导致本试验中绵羊外周血中GH分泌和皮肤组织中该基因的表达存在差异的原因之一。此外由于GHmRNA的表达依赖于其受体的表达,但这是否引起羔羊GH受体的表达变化,或者是调控采食的相关基因以及内分泌系统与基因表达间的相互作用有待进一步研究。
4 结 论
低蛋白质日粮减缓绵羊生长发育,促进GH分泌,减少IGF-1分泌,下调IGF-1基因表达丰度;高蛋白质日粮促进绵羊生长发育,降低GH分泌,增加IGF-1分泌,上调IGF-1基因表达丰度。
[1] MULLER E E,LOCATELLI V,COCCHI D.Neuroendocrine control of growth hormone secretion [J].PhysiolRev,1999,79(2):511-608.
[2] LOUVEAU I,GONDRET F.Regulation of development and metabolism of adipose tissue by growth hormone and the insulin-like growth factor system [J].DomestAnimEndocrinol, 2004,27(3):241-255.
[3] 周锦玉.吉林白鹅 IGF-1基因的SNP与产绒性状的相关性研究[D].长春:吉林农业大学,2007. ZHOU J Y.Studieson single nucleotide polymorphismsofIGF-1andthe associationwith down traitsinJilinWhiteGoose[D].Changchun:Jilin Agricultural University,2007.(in Chinese)
[4] 邢海权,闫梦菲.胰岛素样生长因子IGF-1的研究进展 [J].兽医研究,2011,(5):36-37. XING H Q,YAN M F.The research progress of insulin-like growth factor-1[J].VeterinaryResearch,2011,(5):36-37.(in Chinese)
[5] 单秋枝,仲崇刚.生长激素基因研究进展 [J].中国畜禽种业,2008,4(4):64-66. SHAN Q Z,ZHONG C G. The research progress of growth hormone gene[J].TheChineseLivestockandPoultryBreeding,2008,4(4):64-66.(in Chinese)
[6] 闫云峰,杨 华,杨永林,等.萨福克羊GH和IGF-1基因组织表达水平的分析 [J].家畜生态学报,2014,35(4):18-22. YAN Y F,YANG H,YANG Y L,et al.Tissue expression analysis ofGHandIGF-1 genes in sheep[J].ActaEcologiaeAnimalisDomastici,2014,35(4):18-22.(in Chinese)
[7] 贾 斌,席继峰,张苏云,等.绵羊皮肤中GHR、IGF-1和IGF-1R基因表达的发育性变化及品种特点 [J].遗传,2006,9:1078-1082. JIA B,XI J F,ZHANG S Y,et al.The developmental patterns of GH-R,IGF-1 and IGF-IR gene expression in sheep skin[J].Hereditas(Beijing),2006,9:1078-1082.(in Chinese)
[8] HARRIS P M,MCBRIDE B W,GURNSEY M P,et al.Direct infusion of a variant of insulin-like growth factor-1 into skin of sheep and effects on local blood flow,amino acid utilisation and cell replication[J].Endocrinology,1993,139:463-472.
[9] 杨 华,刘守仁,钟发刚,等.BMPR-IB基因在绵羊不同组织的表达差异性研究 [J].中国畜牧杂志,2009,45(11):6-8. YANG H,LIU S R,ZHONG F G,et al.Study on expression differencesof BMPR-IB gene in different tissues of sheep[J].ChineseJournalofAnimalScience,2009,45(11):6-8.(in Chinese)
[10] UVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 [-Delta Delta C(T)] Method [J].Methods,2001,25:402-408.
[11] BRAMELD J M,ATKINSON J L,SAUNDERS J C,et al.Effects of growth hormone administration and dietary protein intake on insulin-like growth factor 1 and growth hormone receptor mRNA expression in porcine liver,skeletal muscle,and adipose tissue [J].JAnimSci, 1996,74(8):1832-1841.
[12] PELL J M,SAUNDERS J C,GILMOUR R S.Differential regulation of transcription initiation from insulin-like growth factor-I(IGF-I) leader exons and of tissue IGF-I expression in response to changed growth hormone and nutritional status in sheep [J].Endocrinology,1993,132:1797-1807.
[13] BRUHAT A,JOUSSE C,FAFOURONOUX P.Amino acid limitation regulates gene expression [J].ProcNutrSoc,1999,58:625-632.
[14] CASAS-CARRILLO E,KIRKPATRICK B W,PRILL-ADAMS A,et al.Relationship of growth hormone and insulin-like growth factor-1 genotypes with growth and carcass traits in swine [J].AnimGenet, 1997,28(2):88-93.
[15] BARTKE A.Role of growth hormone and prolactin in the control of reproduction:What are we learning from transgenic and knock-out animals [J].Steroids, 1999,64(2):598-604.
[16] 李光玉,高秀华,王凯英.梅花鹿、马鹿营养与其血清 IGF-1 浓度的关系研究 [J].特产研究,2004,(1):1-5. LI G Y,GAO X H,WANG K Y. Research on the relationship of the serum concentrationsof insulin growth factor-1 and the levels of nutrientsin the Sika Deer and Chinese Wapiti[J].SpecialWildEconomicAnimalandPlantResearch,2004,(1):1-5.(in Chinese)
[17] 张 勇,宿永波,朱宇旌.日粮蛋白质水平对猪背最长肌calpain1含量、嫩度及血液激素水平的影响 [J].中国饲料,2008,(14):22-26. ZHANG Y,XU Y B,ZHU Y J. Effects of diet protein level on calpain1 concentration,meat tendernessin longissimusdorsiand blood hormones[J].ChinaFeed,2008,(14):22-26.(in Chinese)
[18] BREIER B H.Regulation of protein and energy metabolism by the somatotropic axis [J].DomestAnimEndocrinol,1999,17(2):209-218.
[19] MAO J N,BURNSIDE J,POSTEL-VINAY M C,et al.Ontogeny of growth hormone receptor gene expression in tissue of growth-selected strains of broiler chickens [J].JEndocrinol,1998,156(2):67-75.
[20] GODOWSKI P J,LEUNG D W,MEACHAM L R,et al.Characterization of the human growth hormone receptor gene and demonstration of a partial gene deletion in two patients with Laron-type dwarfism [J].ProcNatlAcadSci,1989,86(20):8083-8087.
[21] 赵茹茜,李四桂.禽类生长轴的发育及其对生长的调节 [J].畜牧与兽医,1999,31(4):35-37. ZHAO R X,LI S G. The role of poultrygrowth axis in development and regulate growth[J].AnimalHusbandryandVeterinaryMedicine,1999,31(4):35-37.(in Chinese)
[22] PICHA M E,TURANO M J,BECKMAN B R,et al.Endocrine biomarkers of growth and applica- tions to aquaculture:a minireview of growth hormone,insulin-like growth factor(IGF)-1,and IGF-binding proteins as potential growth indicators in fish [J].NorthAmJAquaculture,2008,70(2):196-211.
[23] 赵咏梅.GH-IGF-1轴的作用机制[J].四川医学,2005,6(7):808-810. ZHAO Y M. The mechanism of GH-IGF-1 axis[J].SichuanMedical,2005,6(7):808-810.(in Chinese)
[24] BRAMELD J M,GILMOUR R S,BUTTERY P J.Glucose and amino acids interact with hormones to control expression of insulin-like growth factor-I and growth hormone receptor mRNA in cultured pig hepatocytes [J].JNutr,1999,129(7):1298-1306.
[25] STRAUS D S,TAKEMOTO C D.Effect of fasting on insulin-like growth factor-1(IGF-1) and growth hormone receptor mRNA levels and IGF-1 gene transcription in rat liver [J].MolEndocrinol,1990,4(1):91-100.
[26] VANDEHAAR M J,MOATS-STAATS B M,DAVENPORT M L,et al.Reduced serum concentrations of insulin-like growth factor-1(IGF-1) in protein-restricted growing rats are accompanied by reduced IGF-I mRNA levels in liver and skeletal muscle[J].JEndocrinol,1991,130(2):305-312.
[27] PELL J M,BATES P C.Collagen and non-collagen protein turnover in skeletal muscle of growth hormone-treated lambs [J].JEndocrinol,1987,115(1):R1.
[28] 刘景云,张英杰,刘月琴.日粮不同蛋白水平对绵羊脂肪和肌肉中 IGF-1基因表达的影响 [J].畜牧兽医学报,2009,40(2):197-202. LIU J Y,ZHANG Y J ,LIU Y Q.Effects of dif ferent dietary crude protein level on the expression of igf-Ⅰmrna in adipose and muscle tissue of sheep[J].ActaVeterinariaetZootechnicaSinica,2009,40(2):197-202.(in Chinese)
[29] 张 玲,董 飚,段修军,等.日粮粗蛋白质水平对鹅组织 IGF-I mRNA 表达的影响 [J].江苏农业学报,2012,27(6):1330-1334. ZHANG L, DONG B, DUAN X J,et al.Effects of dietary crude protein levels on IGF-I mRNA expression in some tissues of geese[J].JiangsuJournalofAgriculturalScience,2012,27(6):1330-1334.(in Chinese)
[30] 赵茹茜,GROSSMANN R,陈 杰.营养对肉鸡和蛋鸡生长轴基因表达的影响 [C].第四届中国畜牧兽医青年科技工作者学术研讨会,2001:4. ZHAO R X,GROSSMANN R,CHEN J. The impact of nutrition on gene expression in growth axis of broilers and laying hens[C].The Proceeding of the Fourth Symposium on Chinese Animal Husbandry and Veterinary Young Scientists,2001:4.(in Chinese)
[31] 周其伟,白春生,贾 斌,等.中国美利奴绵羊肉用品系生长轴相关基因表达对其十二指肠发育的影响 [J].畜牧兽医学报,2010,41(8):967-973. ZHOU Q W ,BAI C S,JIA B,et al.Ef fects of growth-related genes expression on duodenal development in chinese merino sheep(meat line)[J].ActaVeterinariaetZootechnicaSinica,2010,41(8):967-973.(in Chinese)
[32] ZHAO R Q,DECUYPERE E,GROSSMANN R.Secretory patterns of plasma GH and IGF-1 conc- entrations in meat-type and laying-type chickens during early post hatch development [J].AvianPoultBiolRev, 1995,(6):270.
(编辑 郭云雁)
Effects of Different Dietary Protein Levels on the Secretion and mRNA Expression of IGF-1 and GH in Sheep
YAN Yun-feng1,2,YANG Hua1*,YANG Yong-lin1,PAN Xiao-liang2, ZOU Yun-long3
(1.TheBreed&BiotechnologyKeyLaboratoryofSheepinBingtuan,XinjiangAcademyofAgriculturalandReclamationSciences,Shihezi832000,China; 2.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832001,China; 3.LifeScienceandEngineeringCollegeofNorthwestUniversityforNationalities,Lanzhou730000,China)
The objective of this study was to discuss the effects of different dietary protein levels on insulin-like growth factor-1(IGF-1) and growth hormone(GH) secretion and mRNA expression in sheep,to provide a theoretical basis for scientific preparation of feed and study the growth in sheep.Eighteen 6-month-old prolific Suffolk rams were randomly allocated into 3 treatments with different dietary protein levels(low protein,medium protein and high protein).The concentrations in peripheral blood and mRNA expression levels in skin of IGF-1 and GH were detected at different growth stages(30,60,90 and 120 d) with different dietary protein levels by ELISA and SYBR Green Real-time PCR methods.The results showed that the average daily gain,the concentrations of IGF-1 and GH in peripheral blood,the mRNA expression ofIGF-1 in skin were significantly affected by dietary protein levels.However,mRNA expression ofGHgene did not change significantly.With the increased protein intake,the growth of sheep was faster,the concentration of IGF-1 was increased,but the concentration of GH was decreased in peripheral blood,mRNA expression ofIGF-1 gene was up-regulated.
sheep;protein levels;IGF-1;GH;secretion;gene expression
10.11843/j.issn.0366-6964.2015.01.011
2014-05-05
国家自然科学基金项目(31360541);兵团博士资金专项(2011BB015);兵团农业科技攻关项目(2011BA006)
闫云峰(1986-),男,河北张家口人,硕士生,主要从事动物营养调控研究,E-mail:xjnkyxms@126.com
*通信作者:杨 华,副研究员,E-mail:yhxjcn@sina.com
S826;S816.4
A
0366-6964(2015)01-0085-11
